“溶液中粒子浓度大小比较”题型的解题思路与技巧
贾硕杰
摘 要:以“电解质溶液中的粒子浓度大小比较”这一类高考热点题型常见思维障碍为切入点,帮助学生构建单一溶质溶液中电离、水解过程的原型定向,实现解题思想和解题方法的达成,进一步上升到解答两种溶质溶液中粒子浓度习题的高度,有效实现原型内化。
关键词:电解质溶液;粒子浓度大小比较;规律和应用;思维原型理论
中图分类号:G633.8 文献标识码:A 文章编号:1009-010X(2015)30-0067-03
“电解质溶液中的粒子浓度大小比较”是历年高考的“热点”之一。该题型考查的知识点多、知识面广,灵活性、综合性都较强,有较好的区分度。它能有效地测试出学生对弱电解质的电离、水的电离及溶液的pH、盐类的水解等基本概念的掌握程度以及对这些知识的综合运用能力。
该类试题主要考查弱电解质的电离、水的电离及溶液的pH、盐类的水解等基本概念的掌握程度以及对这些知识的综合运用能力。试题的呈现形式为:单一溶质、两种溶质的溶液。设问指向有:溶液中离子浓度比较、三种守恒的应用、pH、水的电离、离子积常数、溶解性。其中溶液中离子浓度比较、三种守恒的应用,属高考命题中出现频率较高的热点。
一、单一溶质的溶液中离子浓度比较的解题思想
(一)做这类试题要注意的内容
1.分析试题,建构解题思路,形成解题方法:①溶液的组成是什么?②电离、水解孰强?③溶液的酸碱性如何?如第1题A选项,溶质为NaHCO3,HCO3-水解程度大于电离程度,溶液显碱性。
2.明确电离、水解的过程,通过电荷守恒、原子守恒的等式,后推导质子守恒的表达式,分析溶液中离子浓度大小顺序。
(二)该类试题解题方法
1.粒子浓度比较时依据:强过程>弱过程;多步>一步;显性>隐性
NaHCO3溶液中存在以下四个电离或水解过程: NaHCO3=Na++HCO3-②HCO3-+H2O (H2CO3+OH-)③HCO3-(H++CO32-)④H2O(H++OH-),以上四个过程体现了由强到弱的顺序,即①中NaHCO3完全电离最强,②中HCO3-的水解程度比③中HCO3-的电离程度大,②中HCO3-水解程度比④中H2O的电离程度大,在比较浓度大小时依据强过程产生的离子浓度比弱过程产生的离子浓度大,可确定Na+和HCO3-比其他离子浓度大,H2CO3和OH-居中,H+和CO32-最小再依据多步大于一步可确定OH-> H2CO3,H+> CO32-,这样可排出总的离子浓度顺序为:c(Na+)>c(HCO3-)> c(OH-) >c(H2CO3) > c(H+)>c(CO32-),而现依据显性大于隐性的思路,明确溶液呈碱性,可进一步验证c(OH-) > > c(H+)。
2.不论溶液是酸性、中性、碱性,三大守恒永远成立。其中质子守恒的等式可以通过电荷守恒、原子守恒的等式推导得出。比如第1题B选项,溶质是两种,质子守恒的等式可以通过电荷守恒、原子守恒的等式推导得出:2c(H+)+ c (CH3COOH) =2c(OH-) +c (CH3COO-)。而试题可能的设问还有以下三种离子浓度大小比较方式:(1)c (CH3COOH) ____c (CH3COO-);(2)c(H+)+ c (CH3COOH) ____c(OH-) +c (CH3COO-);(3)c(H+) ____ c(OH-)。③明确“中性”和“中和”的區别。
二、两种溶质的溶液中离子浓度比较的解题思想
3.总结分析7条顺序,得出规律,提升结题思维与方法。
(1)顺序1、2、3溶液呈酸性, c(CH3COO-)和c(OH-)在两头,而 c(H+)和c(Na+)在中间出现>、=、<的变化,溶质均为CH3COOH和CH3COONa,随着NaOH逐滴加入,CH3COONa逐渐增多,CH3COOH相对变少。
(2)顺序4溶液为中性,c(CH3COO-)= c(Na+),c(H+)= c(OH-),CH3COOH几乎被中和完全。
(3)顺序5、6、7溶液呈碱性, c(H+)和c(Na+)在两头而c(CH3COO-) 和c(OH-)在中间出现>、=、<的变化,顺序5可看作CH3COOH和NaOH恰好中和,顺序6、7溶质均为CH3COONa和NaOH。
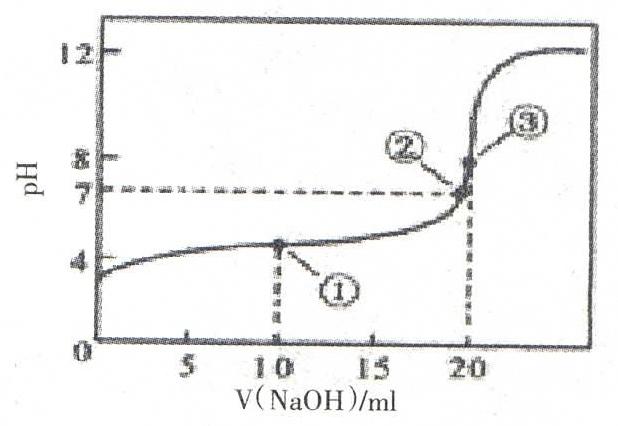
分析其中图中①点即为顺序3, 可视为CH3COOH与CH3COONa相等,电离大于水解,C(CH3COO-)> C(Na+),溶液呈酸性,存在c (CH3COO-)+ 2c(OH-)= c (CH3COOH)+ 2c(H+),A选项错误;①之前的点可看作顺序1、2。其中图中②即为顺序4,即溶液呈中性,C(CH3COO-)= C(Na+),B选项错误;其中图中③即为顺序5,恰好完全中和,溶质为CH3COONa,C(Na+)> C(CH3COOH) > c(OH-) > c(H+),C选项错误;③之后的点可看作顺序6、7,选项D是刚刚滴加0.1000 mol·L-1NaOH时的情境,为①之前的点,D选项正确。
三、总结与反思
从2010年江苏高考真题、2012年四川高考真题遇到的思维障碍点入手,致力于构建单一溶质溶液中电离、水解过程的原型定向,实现解题思想和解题方法的达成,再由此借助“将浓度相等的NaOH溶液滴加到CH3COOH溶液中”这一具体情境,体会量变到质变的过程,把握三大守恒的灵活应用,从而上升到解答两种溶质溶液中粒子浓度习题的高度,有效实现原型内化。解题思维遵循心智能力的心理学原理,按照冯忠良教授的思维原型理论[1],帮助学生经历原型定向、原型操作、原型内化的智力形成三个阶段,达成应有的思维能力。但分析将浓度相等的NaOH溶液滴加到CH3COOH溶液中这一具体情景时,学生虽体会到量变到质变的过程,也能理解七个离子浓度顺序,但这种量变过程还不够具体详尽。可通过酸碱中和滴定的数字化实验[2],让学生通过计算机观察到pH传感器[3]测定NaOH溶液滴定CH3COOH溶液过程中溶液pH和光电门传感器测定的NaOH溶液体积两组对应的数据,并且借助计算机以图像形式显示出来滴定曲线图。使学生获得感性和理性的认识,非常直观地掌握了酸碱恰好中和与中性的区别,从而加深了对该类试题的理解。
参考文献:
[1]冯忠良.教育心理学[M].人民教育出版社,2011.
[2]吴顺迪.利用数字化实验系统绘制中和滴定曲线[J].高中数理化,2012,06.

