基于SSR标记构建白蜡种质资源分子身份证
胡春龙等


摘要:以山东省林业科学研究院寿光试验站收集的46份白蜡为试验材料,对白蜡种质资源分子身份证的构建进行探究。利用SSR标记技术对白蜡试材进行区分,从150对引物中筛选出11对SSR引物对选定白蜡试材进行扩增,每个引物可以检测到3~5个基因型,平均每对引物扩增出2.52条带和2.09条多态性带,平均多态性位点百分率为82.93%。将11对引物及其检测出的等位基因依次赋值,构建了供试白蜡种质资源的分子身份证,能够达到区分各品种的目的。
关键词:白蜡;SSR;分子身份证
中图分类号:S687.1∶Q781文献标识号:A文章编号:1001-4942(2015)05-0006-05
Establishment of Molecular ID for Fraxinus
Germplasms Based on SSR Markers
Hu Chunlong1, Zhang Chen1, Liu Cuilan2,3, Li Li2,3,
Yan Liping2,3, Wu Dejun2,3, Xia Yang2,3, Xing Shiyan1, Wang Kaifang2*
(1.College of Forestry, Shandong Agricultural University, Taian 271018, China; 2.Shandong Academy of Forestry,
Jinan 250014,China; 3.Shandong Provincial Key Laboratory of Forest Tree Genetic Improvement, Jinan 250014, China)
AbstractUsing 46 Fraxinus materials from the Shouguang Experimental Station of Shandong Academy of Forestry, the establishment of molecular ID for Fraxinus germplasms was studied. These Fraxinus materials were distinguished by SSR markers. Eleven pairs of primers screened from 150 pairs were used to amplify the selected Fraxinus materials. The results showed that 3~5 genotypes could be detected by each primer. The average number of bands and polymorphic bands were 2.52 and 2.09 amplified by every pair of primers. The average polymorphic loci percentage was 82.93%. After assignment of 11 pairs of primers and their alleles, the molecular IDs were established for the tested Fraxinus germplasms, which could well distinguish the varieties of Fraxinus.
Key wordsFraxinus velutina Torr; SSR; Molecular ID
白蜡(Fraxinus sp.)属双子叶植物纲,木犀科(Oleceae),木犀亚科(Oleoideae)。目前发现的白蜡约有70多种,在我国已见约34种。白蜡树耐盐碱、干形出众,作为一种常见绿化树种,在我国分布广泛。由于白蜡种质资源种类繁多,品种的鉴定引起研究者广泛关注。20世纪80年代末,微卫星标记技术(SSR)的不断发展和完善为白蜡种质资源分子层面的鉴定奠定了基础。
SSR微卫星标记分布比较均匀、稳定性较高、重复性好且多态性丰富,在拟南芥等植物中的编码区、非编码区均广泛存在,为种质资源的纯度及品种真实性鉴定提供理论依据。近年来,部分学者通过SSR技术在荔枝、黑核桃等植物上取得一定进展,并成功构建了大豆、香蕉、甘蔗、梨和桃等种质资源的分子ID。然而到目前为止,SSR标记技术在白蜡上还鲜有应用。本研究利用SSR标记技术,以山东省林业科学研究院寿光试验站保存的46份白蜡为试材,运用相关软件进行分析,通过分子层面的研究,以期为探究构建白蜡种质分子身份证的方法提供理论依据,为白蜡新品种的审定、DUS测试、分子标记辅助育种等奠定理论基础。
1材料与方法
1.1试验材料
选用山东省林业科学研究院寿光试验站收集保存的46份白蜡为试材(表1)。
1.2白蜡基因组DNA提取
取白蜡试材的新鲜叶片置于-50℃保存,采用改进CTAB法提取白蜡基因组DNA。
1.3DNA检测方法
将提取的白蜡基因组DNA进行琼脂糖凝胶电泳检测,经EB染色后在紫外灯下拍照,检测是否有DNA条带。利用微量分光光度计检测DNA质量,将DNA按1∶50稀释,置于-20℃保存备用。
1.4引物的合成与PCR反应
SSR引物为山东省林业科学研究院通过转录组测序开发合成的白蜡特异性引物,由上海生工生物工程股份有限公司合成。反应体系为10 μL,包含:Mg2+(25 mmol/L)0.1 μL、正反向引物(10 μmol/L)各1 μL、模板DNA(10 ng/μL)为1 μL,Taq酶(5 U/μL)5 μL,用ddH2O补足至10 μL。PCR扩增程序:94℃预变性3 min;94℃变性1 min,52℃退火1 min,72℃延伸1 min,35个循环;最后72℃延伸5 min。采用非变性聚丙烯酰胺凝胶电泳,经过固定、银染、漂洗、显影等步骤后获得相应的指纹图谱,统计数据后通过软件进行分析。endprint
1.5数据统计分析
根据所得的指纹图谱对应的分子量统计,依次记录为数字1、2、3、…、m,统计软件采用东北农业大学研发的Genetics Statistics 3.0 (登记号为2007SR11872)、IDAnalysis 1.0,分别用于引物的多样性指数、shannon多样性指数(I)的分析和白蜡试材分子身份证的构建。
2结果与分析
2.1基因组DNA提取
由图1可以看出,DNA条带较亮,说明提取的白蜡基因组DNA纯度较高,符合试验基本要求。
2.2多态性引物的筛选
多态性高的引物可以更清晰地展示不同染色体上的信息,在46份试材中随机选取10个白蜡品种对150对引物进行筛选,得到11对条带清晰、特异性较强的引物。
2.3引物等位基因信息分析
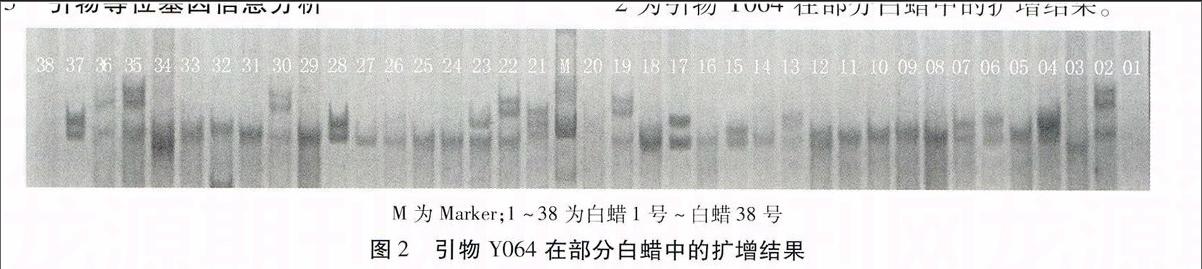
利用筛选出的11对引物对46份白蜡DNA依次进行PCR扩增,根据图谱进行数据统计。
根据扩增得到的指纹图谱分析得知:平均每对引物扩增出2.52条带和2.09条多态性带,平均多态性位点百分率为82.93%。每对引物可以检测到3~5个等位基因,引物多样性指数介于0.486~0.879之间,平均为0.606。其中,等位基因数大于平均值的引物有:Y132、Y064、Y077、Y082、Y124、Y083、Y112、Y093;多样性指数高于平均值(4.6)的引物有:Y132、Y150、Y112(见表2)。Shannon多样性指数(I)的变化范围在0.9717~1.4017,平均为1.1996,说明供试的白蜡属群体中存在较高的遗传多样性。
2.4白蜡品种的分子身份证构建
分子身份证的构建方法一般有两种,一种是以特异等位基因进行区分,另一种是以多个引物的等位基因组合区分。结果显示,利用Y132、Y064、Y077、Y082、Y124、Y123、Y150、Y083、Y112、Y093、Y120这11对引物可将供试品种进行区分(表3)。
例如,表3中构建的“白蜡1号”分子身份证为11001311441, 表示在对应的引物顺序下,第1个引物的第1个等位基因,第2个引物的第1个等位基因,第3个引物显0个等位基因, 并依此类推, 到第11个引物的第1个等位基因为止, 由这些引物扩增出的特异等位基因组成的指纹图谱就可以代表相应品种的分子身份证。引物的等位基因数越多,引物在资源鉴别中的作用就越大。引物的多样性指数越高,它能区分品种的能力就越强。
3结论与讨论
本试验从150对引物中筛选出11对,这些引物的多态性好且稳定性高。多样性指数高、特异性强的引物,可以广泛用于分子身份证的构建。许多研究者在统计时通常忽略指纹图谱中的杂合带型,采用微卫星标记扩增出的一个等位基因位点用于分子身份证的构建,而本研究参考了陈昌文等的方法,编码时只取指纹图谱中较小的谱带,通过增加引物的方法构建有效分子身份证,使白蜡种质资源的区分能力大幅度提升。目前有些研究者采用的编码方式是数字加字母的组合方式,本研究使用纯数字表示等位基因位置的方法,直接将对应引物的指纹图谱按照相应的顺序进行数字编码,由此得到的分子身份证更为简洁明了。
依据大麦系指纹图谱对亲本及其子代的SSR分析得知,SSR在不同世代之间的遗传性状具有稳定性、连续性。在同一品种中,不同个体的SSR稳定性在水稻等物种中也得以证实。因此,利用SSR构建分子身份证具有准确可靠、简单快速、易于自动化的优点,然而该方法也有其局限性。有研究者在利用SSR标记技术构建桃的分子身份证时,由于桃的亲缘关系非常接近,难以达到区分的目的。有关分子身份证的试验证实,SSR技术可以有效区分来自同一育种单位和源自同一祖先的品种,说明SSR标记可以用于构建白蜡的分子身份证。本试验所得的指纹图谱的多态性高、特异性丰富,能够达到鉴别生物个体之间差异的目的,具有高度的个体特异性和环境稳定性,说明通过指纹图谱的差异性可以为品种的鉴定提供科学依据,这与SSR扩增的目的片段多来自编码基因之间的序列有关。本试验得出的结论在某种意义上可为供试品种在分子层面上的鉴定提供一定的依据,后期白蜡品种分子身份证鉴定的普遍适用性还需进一步验证。
参考文献:
[1]张美珍,邱莲卿.中国植物志:第61卷[M].北京:科学出版社,1992:38.
[2]傅书遐,傅坤俊.中国植物志:第34卷[M].北京:科学出版社,1984:8-21.
[3]倪国祥,樊宝敏,范玉文. 硶属13种的苗期形态物候及生长特性研究[J].山东林业科技,1996(5):6-10.
[4]陈汉斌.山东植物志[M].青岛:青岛出版社,1997:855-891.
[5]刘家宜.天津植物志[M].天津:天津科学技术出版社,2004:358-393.
[6]李书心.辽宁植物志[M].沈阳:辽宁科学技术出版社,1992:315-359.
[7]郑万钧.中国树木志:第2卷[M].北京:中国林业出版社,1985:1011-1025.
[8]李延生.辽宁树木志[M].北京:中国林业出版社,1990:385-388.
[9]周以良.黑龙江树木志[M].哈尔滨:黑龙江科学技术出版社,1986:482-485.
[10]高运来,朱荣胜,刘春燕,等.黑龙江部分大豆品种分子ID的构建[J].作物学报,2009,35(2):211-218.
[11]Morgante M,Olivieri A. PCR-amplified microsatellites as markers in plant genetics[J]. The Plant Journal,1993,3(1) : 168-175.endprint
[12]Cardle L,Ramsay L,Milboume D, et al.Computational and experimental characterization of physically clustered simple sequence repeats in plants[J]. Genetics,2000,156(2):847-854.
[13]Varshney R K, Thiel T, Stein N, et al. In silico analysis on frequency and distribution of microsatellites in ESTs of some cereal species[J].Cell Mol. Biol. Lett., 2002,7(2A):537-546.
[14]辛景树,郭景伦,张软斌.几种常用分子标记技术在种子纯度和品种真实性鉴定方面的比较与分析[J].种子,2005,24(1):58-60.
[15]姚庆荣,赵长增,王文泉.海南部分荔枝种质资源亲缘关系的SSR分析[J]. 植物研究,2009,29(5):628-632.
[16]赵鹏, Wosete K E,程飞,等.美国黑核桃SSR反应体系优化[J].植物研究,2012,32(2):213-221.
[17]张飞,王炜勇,张智,等.光萼荷属植物反应体系确立与指纹图谱构建[J].植物研究,2012,32(1):115-119.
[18]Thomas M R,Scott N S.Microsatellite repeats in grapevine reveal DNA polymorphisms when analysed as sequence-tagged sites(STSs)[J].Theor. Appl. Genet., 1993,86: 985-990.
[19]Thomas M R,Cain P,Scott N S.DNA typing of grapevines: A universal methodology and database for describing cultivars and evaluating genetic relatedness[J]. Plant Mol. Biol., 1994,25: 939-949.
[20]刘闯萍,王军.SSR标记及其在葡萄上的应用[J].果树学报,2008,25(1):93-101.
[21]吴子龙,王军,沈育杰,等.山葡萄种内遗传多样性的SSR分析[J].果树学报,2008,25(6):821-827.
[22]吴子龙,王军,沈育杰,等.8 个山葡萄及山欧杂种葡萄品种的SSR分析[J].植物遗传资源学报,2008,9(1):105-109.
[23]Snchez-Escribano E M,Martin J P,Carreno J,et al. Use of sequence-tagged microsatellite site markers for characterizing table grape cultivars[J].Genome,1999,42:87-93.
[24]Martinez L E,Cavagnaro P F,Masuelli R W,et al.SSR-based assessment of genetic diversity in South American Vitis vinifera varieties[J].Plant Science,2006,170:1036-1044.
[25]Amold C,Rossetto M,Mcnally J,et al.The application of SSRs characterized for grape(Vitis vinifera) to conservation studied in Vitaceae[J].American Journal of Botany,2002,89(1):22-28.
[26]艾呈祥,张力思,魏海蓉,等.甜樱桃品种 SSR指纹图谱数据库的建立[J].中国农学通报,2007,23(5):55-58.
[27]王健兵,燕丽萍,刘翠兰,等.白蜡属SSR-PCR 反应体系优化及引物筛选[J].中国农学通报,2009,26(5):733-738.
[28]杨阳,刘振,赵洋,等.湖南省主要茶树品种分子指纹图谱的构建[J].茶叶科学,2010,30(5):367-373.
[29]刘新龙,马丽,陈学宽,等.云南甘蔗自育品种DNA指纹身份证构建[J].作物学报,2010,36(2):202-210.
[30]韩宏伟,杨敏生,徐兴兴,等.利用SSR标记鉴定主要梨栽培品种[J].中国农学通报,2006,22(12):383-386.
[31]陈昌文,曹珂,王力荣,等.中国桃主要品种资源及其野生近缘种的分子身份证构建[J].中国农业科学,2011,44(10):2081-2093.
[32]Russell J,Fuller J,Young G,et al.Discrimination between barley genotypes using microsatelite markers[J].Genome,1997,40:442-450.
[33]Akagi H,Yokozeki Y,Inagaki A,et al. Highly polyor-phic microsatellites of rice consist of AT repeats and a classification of closely related cultivars with these microsatellite loci[J].Theor.Appl.Genet.,1997,94:61-67.endprint

