肠膜明串珠菌BD1710在TSM中的产糖条件优化
韩瑨,吴正钧,游春苹,徐晓芬
(1.乳业生物技术国家重点实验室,上海200436,2.上海乳业生物工程技术研究中心,上海200436,3.光明乳业研究院,光明乳业股份有限公司,上海200436)
肠膜明串珠菌BD1710在TSM中的产糖条件优化
韩瑨1,吴正钧2,游春苹3,徐晓芬3
(1.乳业生物技术国家重点实验室,上海200436,2.上海乳业生物工程技术研究中心,上海200436,3.光明乳业研究院,光明乳业股份有限公司,上海200436)
研究了肠膜明串珠菌BD1710(L.mesenteroides BD1710,CGMCC NO.6432)以TSM为基料时,接种量、初始pH、番茄汁浓度、蔗糖浓度、发酵温度对多糖产量的影响,同时,比较了肠膜明串珠菌BD1710在最优条件下发酵TSM和CDM的多糖产量,并对所获得的多糖组成进行了分析。结果表明:肠膜明串珠菌BD1710发酵TSM产多糖的最适条件分别为接种量2.0%(体积分数)、初始pH 7.0、番茄汁浓度100%(体积分数)、蔗糖浓度15%、发酵温度28℃。在优化条件下,肠膜明串珠菌BD1710的多糖产量最高可达32.15 g/L,与在CDM中多糖的产量相当。采用乙醇沉淀的方法从BD1710发酵TSM得到的多糖碳水化合物含量为97.54%,蛋白质含量为0.72%。因此,TSM可替代CDM来应用于明串珠菌合成多糖。
肠膜明串珠菌BD1710;TSM;多糖;葡聚糖
以乳酸菌、土壤杆菌、根瘤菌等为代表的微生物代谢产生的多糖是一种微生物在生长代谢过程中分泌到细胞壁外的一类由单一或多种单糖以糖苷键聚合而成的高分子化合物,根据存在形式的不同可分为荚膜多糖和粘液多糖2种。大量研究证实,乳酸菌胞外多糖不但可以赋予发酵乳制品特殊的风味[1]、改善产品质地与口感[2],还具有一定的降血压[3]、降血脂、免疫调节和抗肿瘤等保健功能[4-5]。在食品添加剂(如增稠剂、乳化剂、稳定剂等)的安全性受到广泛关注的情况下,乳酸菌胞外多糖因其良好的安全性和卓越的生理与加工性能,将在医药、日用化妆品和食品行业得到更广泛的应用。
肠膜明串珠菌(Leuconostoc mesenteroides)是最早应用于商业化生产多糖的乳酸菌之一,可以合成主链由不同糖苷键类型构成、比例迥异的葡聚糖(Glucan,一类主链以葡萄糖为单糖组成单位,由α-(1→3)、α-(1→4)或α-(1→6)糖苷键键合而成的特殊多糖)[6],如主链仅以α-(1→6)糖苷键将葡萄糖聚合而成的dextran[7],主链由α-(1→6)和α-(1→3)交替键合而成的alternan[8]等。研究表明,由L.mesenteroides产生的各种葡聚糖不仅可以改善发酵制品的质地,而且在生物分离(SephadexRgels)、医药(代血浆)等领域被广泛应用[9]。然而,在目前制备明串珠菌来源的多糖的工艺中,发酵基料大多为化学合成培养基(Chemically defined medium,CDM)[10],其组成复杂、部分成分来源紧缺,导致发酵基料成本高昂;采用这些基料发酵后,在提取制备多糖的过程中,通常为了去除蛋白质等干扰物质而加入氯仿、正丁醇(Sevag法)[11]、三氟三氯乙烷(三氟三氯乙烷法)[12]、三氯乙酸(三氯乙酸法)[13]等有机溶剂,这些因素对商业化生产的成本、多糖的品质以及多糖在食品、医疗领域应用的安全性均存在不良影响。因此,寻找一种来源广泛、价格低廉的明串珠菌产糖介质,同时提高多糖的产率和品质,是明串珠菌多糖制备方法的关键。
前期研究发现,L.mesenteroides BD1710(CGMCC NO.6432)可在预调pH和添加蔗糖的番茄汁蔗糖培养基(tomato juice-sucrose medium,TSM)中发酵产糖,因此,本文对TSM发酵产糖的条件进行了优化,比较了L.mesenteroides BD 1710在优化条件下和在CDM培养基中多糖的产量,同时对采用乙醇沉淀法获得的多糖的组成进行了分析。
1材料与方法
1.1菌种与试验材料
菌种:L.mesenteroides BD1710(CGMCC 0847)。
试验材料:M17琼脂/液体培养基:OXOID LTD.,英国;蔗糖、蛋白胨、酵母抽提物、K2HPO4、MgSO4· 7H2O、MnSO4、NaCl、CaCl2、FeSO4、NaOH、无水乙醇:国药集团化学试剂有限公司,上海;番茄:市售。
1.2主要仪器设备
HVE-50型高压灭菌锅:HIR AYAMA公司;AVANTI J30I型高速冷冻离心机:美国BECKMAN COULTER公司;FreeZone 12型真空冷冻干燥机:美国LABCONCO公司;SQ2130Z型榨汁机:上海帅佳电子科技有限公司;PB-10型pH计:美国Sartorius公司。
1.3方法
1.3.1发酵种子液的制备
将L.mesenteroides BD1710的冻干粉以少量无菌蒸馏水溶解,用接种环挑取一环划线于M17蔗糖琼脂培养(以5.0%蔗糖取代M17培养基中0.5%的乳糖,在120℃下灭菌20 min即得)上,28℃好氧培养24 h取出,用接种环挑取单菌落接入1 mL M17蔗糖液体培养基中,采用涡旋混合仪将细胞均匀分散后,28℃、180 r/min摇床培养48 h取出,再以2%(体积分数)接种量接种于50 mL上述M17蔗糖液体培养基中,于28℃、180 r/min摇床培养48 h,即得发酵用的种子。
1.3.2发酵培养基的制备
番茄汁的制备:成熟番茄清洗、去皮,榨汁,果汁部分经多层纱布过滤后,经15 000 r/min离心10 min,取清液即得。
TSM的制备:向20%~100%(体积分数)的番茄汁中加入5.0%~20.0%的蔗糖,加热溶解并冷却后,用5.0 mol/L NaOH调节pH至5.0~10.0,在120℃下灭菌20 min即得所需蔗糖浓度和pH的无菌TSM。
CDM的制备:将蛋白胨10 g、酵母抽提物5 g、蔗糖150 g、K2HPO420 g、MgSO4·7H2O 0.2 g、MnSO40.01 g、NaCl 0.01 g、CaCl20.02 g、FeSO40.01 g与1 L蒸馏水混匀,充分溶解后,以碱调节pH至7.0,在120℃下灭菌20 min即得所需的无菌CDM。
1.3.3多糖的制备
将发酵液在沸水浴30min,冷却至室温后加入4倍(体积分数)的无菌水稀释,15 000 r/min离心10 min,取上清,加入3倍体积经过预冷的无水乙醇,静置过夜,15 000 r/min离心10 min,收集沉淀物,沉淀采用少量无水乙醇洗涤后,采用蒸馏水溶解后经真空冷冻干燥后即得多糖。
1.3.4产糖条件的优化
1.3.4.1不同接种量对L.mesenteroides BD1710多糖产量的影响
分别将L.mesenteroides BD1710种子液按0.5%、1.0%、2.0%、4.0%(体积分数)的接种量接入上述方法制备的TSM中,该TSM中含番茄汁100%(体积分数)、蔗糖15%,pH为7.0,28℃、180 r/min摇床培养,并于不同的培养时间,取发酵液按1.3.3所述方法制备多糖并称重。
1.3.4.2不同初始pH对L.mesenteroides BD1710多糖产量的影响
分别将L.mesenteroides BD1710种子液以2.0%(体积分数)的接种量分别接入初始pH为5.0、6.0、7.0、8.0、9.0、10.0的TSM中,该TSM中含番茄汁100%(体积分数),蔗糖15.0%,28℃、180 r/min摇床培养48 h后将发酵液按1.3.3所述方法制备多糖并称重。
1.3.4.3不同番茄汁浓度对L.mesenteroides BD1710多糖产量的影响
分别将L.mesenteroides BD1710种子液以2.0%(体积分数)的接种量接入番茄汁浓度为20%、40%、60%、80%、100%(体积分数)(番茄汁与蒸馏水的比例),蔗糖含量为15.0%,初始pH为7.0的TSM中,28℃、180 r/min摇床培养48 h后将发酵液按1.3.3所述方法制备多糖并称重。
1.3.4.4不同蔗糖浓度对L.mesenteroides BD1710多糖产量的影响
分别将L.mesenteroides BD1710种子液以2.0%(体积分数)的接种量接入番茄汁浓度为100%(体积分数),蔗糖含量为5.0%、10.0%、15.0%、20.0%(w/ v),pH为7.0的TSM中,28℃、180 r/min摇床培养,并于不同的培养时间,取发酵液按1.3.3所述方法制备多糖并称重。
1.3.4.5不同发酵温度对L.mesenteroides BD1710多糖产量的影响
将L.mesenteroides BD1710种子液以2.0%(体积分数)的接种量接入番茄汁浓度为100%(体积分数),蔗糖含量为15.0%(w/v)、pH为7.0的TSM中,分别置于25、28、31、34℃、转速为180 r/min的摇床培养48 h发酵结束后将发酵液按1.3.3所述方法制备多糖并称重。
1.3.4.6L.mesenteroides BD1710在TSM和CDM中的产糖能力比较
将L.mesenteroides BD1710以2.0%(体积分数)接种量接入上述方法制备的初始为pH7.0的TSM和CDM中,其中TSM含番茄汁100%(体积分数),蔗糖15%(w/v),28℃、180 r/min摇床培养54 h,取不同培养时间的发酵液按1.3.3所述方法制备多糖并称重。
1.3.5L.mesenteroides BD1710多糖的蛋白质与碳水化合物含量
将1.3.3方法制备获得的多糖样品以凯氏定氮法[14]和硫酸苯酚法[15]来测定其蛋白质与碳水化合物含量。
2结果
2.1不同接种量对L.mesenteroides BD1710多糖产量的影响
将L.mesenteroides BD1710的发酵种子液以不同接种量接入含含番茄汁100%(体积分数)、蔗糖15%,pH为7.0的培养基中,28℃、180 r/min摇床培养,不同时间获得的发酵液中多糖的含量如图1所示。
在发酵前9小时,不同接种量的发酵液中多糖含量差异不显著,说明在发酵初期,BD1710在TSM中的增殖速率缓慢或主要以积累菌体生物量为主,不同接种量对明串珠菌产糖能力影响不明显。
随着发酵时间的延长,在9 h至30 h这段时间里,不同接种量的发酵液中多糖含量均呈明显上升趋势,菌株代谢蔗糖产多糖的能力逐渐增强。从图1可以看出,在相同的取样时间点,接种量越大的发酵液中多糖含量越高,如24 h的各发酵液中多糖含量分别为:22.3 g/L(0.5%)、25.2 g/L(1.0%)、28.4 g/L(2.0%)、29.8 g/L(4.0%)。
当发酵时间大于30 h时,各发酵液中累积的多糖总量增加缓慢,主要是由于发酵液粘稠性的增加和发酵液pH的降低,影响了菌株的活性,同时,蔗糖作为明串珠菌合成葡聚糖的底物,随着葡聚糖的合成被大量消耗(数据未显示),从而阻碍发酵液中多糖的进一步积累。
比对2.0%(体积分数)和4.0%(体积分数)接种量的发酵液中多糖含量后发现,两者对L.mesenteroides BD1710的产糖量影响无显著差异(P>0.05),后续实验均采用2.0%(体积分数)接种量作为最适接种量。
2.2不同初始pH对L.mesenteroides BD1710多糖产量的影响
发酵终点处(48 h),不同初始pH的发酵液中多糖含量如图2所示。
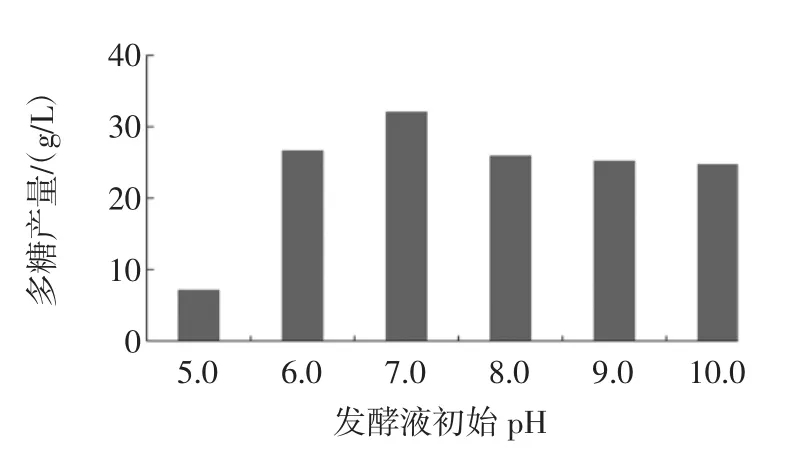
图2 发酵液初始pH对L.mesenteroides BD1710多糖产量的影响Fig.2Effect of initial medium pH on polysaccharide production by L.mesenteroides BD1710
初始pH为5.0的发酵液中多糖产量最低,仅为7.2 g/L,而多糖产量最高(32.15 g/L)的发酵液初始pH为7.0,其他初始pH条件下的多糖产量处于同一水平,为26.72 g/L(pH 6.0)、26.0 g/L(pH 8.0)、25.3 g/L(pH 9.0)和24.8 g/L(pH 10.0)。发酵液pH的高低与微生物的活力、胞壁酶的活性及其代谢产物(多糖等)产量等相关,本实验中,初始pH 7.0的发酵液中多糖得率最高,说明该pH更利于L.mesenteroides BD1710发酵产糖,因此是最适的初始pH条件。
2.3不同番茄汁浓度对L.mesenteroides BD1710多糖产量的影响
不同番茄汁浓度的发酵液中多糖含量如图3所示。
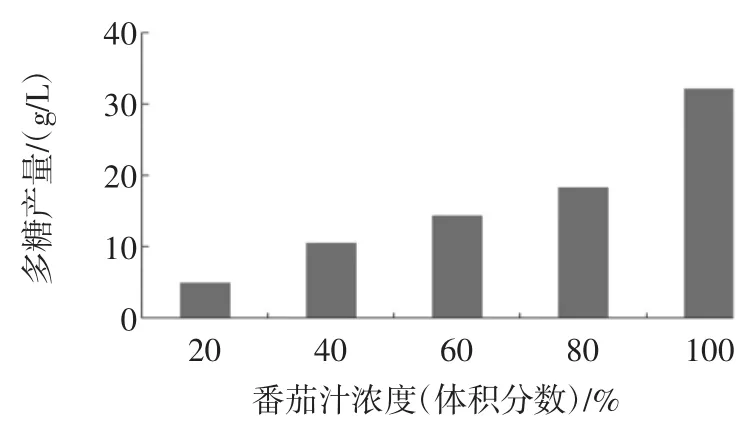
图3 番茄汁浓度对L.mesenteroides BD1710多糖产量的影响Fig.3Effect of tomato juice concentration on polysaccharide production by L.mesenteroides BD1710
随着番茄汁浓度的增加,多糖产量也相应增加,番茄汁中营养成分的浓度与多糖产量呈正相关性,其中,当各番茄汁浓度的发酵液中多糖含量分别为5.0、10.6、14.4、18.4、32.15 g/L。这是因为添加了100%(体积分数)番茄汁的培养基中所含营养成分最充足,其促进L.mesenteroides BD1710合成多糖的因子比其他添加量的培养基更充沛,因此,100%(体积分数)番茄汁是该培养基的最适添加量。
2.4不同蔗糖浓度对L.mesenteroides BD1710多糖产量的影响
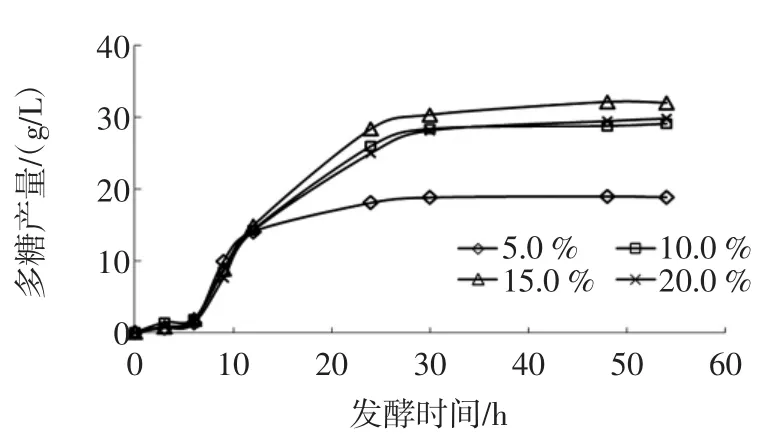
图4 蔗糖浓度对L.mesenteroides BD1710多糖产量的影响Fig.4Effect of sucrose concentration on polysaccharide production by L.mesenteroides BD1710
作为多糖合成代谢作用的直接底物,蔗糖的浓度与L.mesenteroides BD1710多糖产量的影响息息相关,尤其与培养基中代谢底物充分度和渗透压大小的有直接关联。过低的蔗糖浓度会因代谢底物不充足而使多糖产量缩减,过高的蔗糖浓度则会因渗透压过高而降低细菌细胞膜的通透性,从而降低了菌株的活力,同样会影响目标产物的合成。从图4中可知,L. mesenteroides BD1710在蔗糖浓度15%的TSM中代谢蔗糖产生的多糖含量最高,为32.15 g/L,说明蔗糖浓度15%(w/v)的培养基对L.mesenteroides BD1710而言代谢底物充沛、渗透压力适中,是L.mesenteroides BD1710发酵产多糖的最佳蔗糖浓度。
2.5发酵温度对L.mesenteroides BD1710多糖产量的影响
发酵温度对L.mesenteroides BD1710多糖产量的影响见图5。
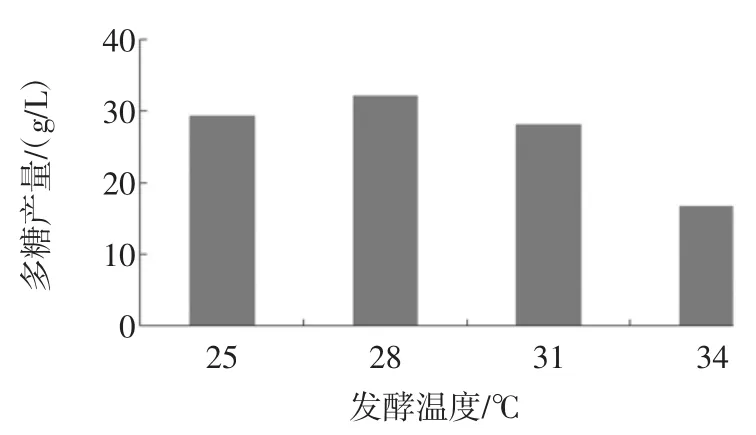
图5 发酵温度对L.mesenteroides BD1710多糖产量的影响Fig.5Effect of fermentation temperature on polysaccharide production by L.mesenteroides BD1710
如图5所示,在相同浓度的TSM中,L.mesenteroides BD1710在28℃培养时多糖的产量最高,表明28℃利于BD1710利用蔗糖合成与积累葡聚糖。因此,选择28℃作为L.mesenteroides BD1710产糖的最优发酵温度。
2.6L.mesenteroides BD1710在TSM和CDM中的产糖能力比较

图6 L.mesenteroides BD1710在TSM和CDM中的产糖能力Fig.6Polysaccharide-production of L.mesenteroides BD1710 fermenting in TSM and CDM
如图6所示,L.mesenteroides BD1710在2种培养基中的发酵产糖趋势相似,2种发酵液中的多糖含量均在接种后6 h内缓慢积累,6 h~24 h快速增长,24 h后趋于稳定。从多糖产量来看,L.mesenteroides BD1710在CDM中多糖最高产率为29.6 g/L,而在TSM中最高可达32.15 g/L,这可能是两者组分差异造成的。CDM虽然添加了蛋白胨、酵母抽提物等营养成分以及一些无机盐来调控和促进菌体细胞的生长与代谢作用[16-17],但相对于TSM而言,营养组成不够全面,有报道指出,番茄汁中含有植物纤维、番茄红素、β-胡萝卜素、维生素C和一些微量元素(硒、锰、锌等)[18],对L.acidophilus、L.bulgaricus、L.plantarum等乳酸菌均有一定的生长刺激效果[19-22]。因此,TSM对L.mesenteroides BD1710促生长作用更强,其产糖量也随着菌株的迅速繁殖而大大增强。
2.7L.mesenteroides BD1710多糖组成分析
采用乙醇沉淀的方法从L.mesenteroides BD1710发酵TSM获得的多糖,采用凯氏定氮和硫酸苯酚法测定后,所获得的多糖碳水化合物含量(以葡萄糖计)和蛋白质与碳水化合物含量分别为97.54%和0.72%。
同时所获得的多糖经过进一步去蛋白纯化后,经过单糖组成、傅利叶变形红外分析(FT-IR)、核磁共振(NMR)等分析后,为含有少量分支的右旋糖苷(数据未公开)。
3讨论
从上世纪40、50年代开始,有关L.mesenteroides的研究主要围绕着菌株的分类、筛选与计数方法[23-24]、培养基的优化[10,16]、代谢产物(多糖[25]、甘露醇[26]、维生素[27]、生物膜[28])的分析等方面展开。直到本世纪初期,对L.mesenteroides的报导开始侧重于利用突变株、培养条件优化以及改变相关产糖酶表达途径等方式来提高多糖产量。Singh A等发现,通过紫外照射后的L. mesenteroides NRRL B-1146突变株多糖产量最多可提高5倍以上[29]。Claire M等将L.mesenteroides NRRL B-512F中编码右旋糖苷蔗糖酶(Dextransucrase,EC 2.4.1.5)的dsrS进行重组并异源表达于Escherichia coli,以此法获得的右旋糖苷蔗糖酶活性比出发株提高了30倍[30]。借助响应面的方法,Avishek M等先后确定了L.mesenteroides NRRL B-1146产葡聚糖蔗糖酶的最适培养基浓度,L.mesenteroides NRRL B-1146和B-640产葡聚糖的优选培养基浓度[31-32]。尽管以提高多糖产量为目的,科研人员进行了各方面的尝试与努力,但发酵产糖过程却始终在CDM中完成,这些培养基成分复杂,部分组成来源紧缺,导致发酵基料成本高昂,而且,采用这些基料发酵的多糖在纯化过程中通常会伴有有机溶剂残留的问题,这会直接影响多糖的商业化生产成本,及其在食品、医疗领域的广泛应用。因此,寻找一种来源天然,应用安全的明串珠菌产糖培养基,同时提高多糖的提纯效率与品质将是未来多糖制备工业的主要趋势之一。
本研究在前期L.mesenteroides BD1710发酵TSM产糖性能初步明确的基础上,首先对TSM发酵产糖的条件进行了优化,发现接种量2.0%(体积分数)、初始pH 7.0、番茄汁浓度100%(体积分数)、蔗糖浓度15%(w/v)、发酵温度28℃为L.mesenteroides BD1710发酵TSM产多糖的最优条件。随后,比较了优化条件下L. mesenteroides BD1710发酵TSM和CDM培养基中的多糖产量,结果显示前者的多糖得率高于后者10%左右。最后测定了L.mesenteroides BD1710多糖的蛋白质与碳水化合物含量,分别为0.72%(质量分数)和97.54%(质量分数)。
得益于番茄汁本身蛋白质含量低的特点[18],以TSM为发酵基料获得的多糖蛋白质含量低,碳水化合物浓度高,表明以此法制备多糖在简化生产步骤、降低生产成本提高生产效率的同时,更增强了产品的安全性,因此,TSM可作为一种天然发酵基料用于大规模制备L.mesenteroides葡聚糖。
4结论
1)L.mesenteroides BD1710代谢TSM产生多糖的最适发酵条件为接种量2.0%(体积分数)、初始pH 7.0、番茄汁浓度100%(体积分数)、蔗糖浓度15%、发酵温度28℃。
2)L.mesenteroides BD1710在TSM中的多糖产率略高于CDM,可以作为一种大规模制备明串珠菌葡聚糖的培养介质。
3)采用乙醇沉淀法从L.mesenteroides BD1710发酵TSM获得的多糖碳水化合物含量与蛋白含量分别为97.54%和0.72%。
[1]VEDAMUTHU E R.The Dairy Leuconostoc:Use in Dairy Products[J].Journal of Dairy Science,1994,77(9):2725-2737
[2]KORAKLI M,VOGEL R F.Structure/function relationship of homopolysaccharide producing glycansucrases and therapeutic poten-tialoftheirsynthesisedglycans[J].AppliedMicrobiologyandBiotechnology,2006,71(6):790-803
[3]AI L-Z,GUO B-H,ZHANG H,et al.Isolation and antihypertensive effect of exopolysaccharides from Lactobacillus casei LC2W[J]. Milchwissenschaft-Milk Science International,2008,63(1):3-6
[4]DE VUYST L,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177
[5]RUAS-MADIEDO P,HUGENHOLTZ J,ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].International Dairy Journal,2002,12(2/3):163-171
[6]MONCHOIS V,WILLEMOT R-M,MONSAN P.Glucansucrases:Mechanism of action and structure-function relationships[J].FEMS Microbiology Reviews,1999,23(2):131-151
[7]MONCHOIS V,REMAUDSIMEON M,RUSSELL R R B,et al. Characterization of Leuconostoc mesenteroides NRRL B-512F dextransucrase(DSRS)and identification of amino-acid residues playing a key role in enzyme activity[J].Applied Microbiology and Biotechnology,1997,48(4):465-472
[8]ARGUELLO-MORALES M A,REMAUD-SIMEON M,PIZZUT S,et al.Sequence analysis of the gene encoding alternansucrase,a sucrose glucosyltransferase from Leuconostoc mesenteroides NRRL B-1355[J].Fems Microbiology Letters,2000,182(1):81-85
[9]NAESSENS M,CERDOBBEL A,SOETAERT W,et al.Leuconostoc dextransucrase and dextran:production,properties and applications[J].J Chem Technol Biotechnol,2005,80(8):845-860
[10]KIM Y J,EOM H-J,SEO E-Y,et al.Development of a Chemically Defined Minimal Medium for the Exponential Growth of Leuconostoc mesenteroides ATCC8293[J].Journal of Microbiology and Biotechnology,2012,22(11):1518-1522
[11]SEVAG M,LACKMAN D B,SMOLENS J.The isolation of the components of streptococcal nucleoproteins in serologically active form[J].Journal of biological chemistry,1938,124(2):425-436
[12]MARKOWITZ A,LANGE C.Removal of proteins with trifluorotrichloroethane[J].Methods in Carbohydrate Chemistry,5:6-8
[13]MEULEMANS O.Determination of total protein in spinal fluid with sulphosalicylic acid and trichloroacetic acid[J].Clinica chimica acta;international journal of clinical chemistry,1960,5:757-761
[14]MCKENZIE H,WALLACE H S.The Kjeldahl determination of nitrogen:a critical study of digestion conditions-temperature,catalyst,and oxidizing agent[J].Australian Journal of Chemistry,1954,7(1):55-70
[15]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical chemistry,1956,28(3):350-356
[16]FOUCAUD C,FRANCOIS A,RICHARD J.Development of a chemically defined medium for the growth of Leuconostoc mesenteroides[J].Applied and Environmental Microbiology,1997,63(1):301-304
[17]KIM H,EOM H J,LEE J,et al.Statistical optimization of medium composition for growth of Leuconostoc citreum[J].Biotechnology and Bioprocess Engineering,2004,9(4):278-284
[18]ABDEL-RAHMAN A-H Y.Nutritional value of some canned tomato juice and concentrates[J].Food chemistry,1982,9(4):303-306
[19]GARVIE E I,MABBITT L A.Stimulation of the growth of Leuconostoc oenos by tomato juice[J].Archiv fur Mikrobiologie,1967,55(4):398-407
[20]BABU V,MITAL B,GARG S.Effect of tomato juice addition on the growthandactivityofLactobacillusacidophilus[J].Internationaljournal of food microbiology,1992,17(1):67-70
[21]COGAN T,GILLILAND S,SPECK M.Identification of stimulants for Lactobacillus bulgaricus in tomato juice[J].Applied microbiology,1968,16(8):1215-1219
[22]YOON K Y,WOODAMS E E,HANG Y D.Probiotication of tomato juice by lactic acid bacteria[J].Journal of Microbiology,2004,42(4):315-318
[23]BENKERROUM N,MISBAH M,SANDINE W E,et al.Development and use of a selective medium for isolation of Leuconostoc spp. from vegetables and dairy products[J].Applied and environmental microbiology,1993,59(2):607-609
[24]SINGH G,SHARMA R R.Dominating species of Lactobacilli and Leuconostocs present among the lactic acid bacteria of milk of different cattle’s[J].Asian J Exp Sci,2009,23(1):173-179
[25]BOUNAIX M-S,GABRIEL V,ROBERT H,et al.Characterization of glucan-producing Leuconostoc strains isolated from sourdough[J].International Journal of Food Microbiology,2010,144(1):1-9
[26]VON WEYMARN N,KIVIHARJU K,LEISOLA M.High-level production of D-mannitol with membrane cell-recycle bioreactor[J]. Journal of Industrial Microbiology&Biotechnology,2002,29(1):44-49
[27]MORISHITA T,TAMURA N,MAKINO T,et al.Production of menaquinones by lactic acid bacteria[J].Journal of Dairy Science,1999,82(9):1897-1903
[28]LEATHERS T D,BISCHOFF K M.Biofilm formation by strains of Leuconostoc citreum and L.mesenteroides[J].Biotechnology Letters,2011,33(3):517-523
[29]SINGH A,MAJUMDER A,GOYAL A.Mutagenesis of Leuconostoc dextranicum NRRL B-1146 for higher glucan production[J].Inter J Microbiol,2009,7(1):1-7
[30]MOULIS C,ARCACHE A,ESCALIER P-C,et al.High-level production and purification of a fully active recombinant dextransucrase from Leuconostoc mesenteroides NRRL B-512F[J].Fems Microbiology Letters,2006,261(2):203-210
[31]MAJUMDER A,SINGH A,GOYAL A.Application of response surface methodology for glucan production from Leuconostoc dextranicum and its structural characterization[J].Carbohydr Polym,2009,75(1):150-156
[32]MAJUMDER A,BHANDARI S,PURAMA R K,et al.Enhanced production of a novel dextran from Leuconostoc mesenteroides NRRL B-640 by Response Surface Methodology[J].Annals of Microbiology,2009,59(2):309-315
Optimization of the Condition for Leuconostoc mesenteroides BD1710 to Biosynthesis Glycan in Tomato Juice-sucrose Medium
HAN Jin1,WU Zheng-jun2,YOU Chun-ping3,XU Xiao-fen3
(1.State Key Laboratory of Dairy Biotechnology,Shanghai 200436,China,2.Shanghai Engineering Research Center of Dairy Biotechnology,Shanghai 200436,China,3.Dairy Research Institute,Bright Dairy&Foods Co.,Ltd.,Shanghai 200436,China)
The condition for Leuconostoc mesenteroides BD1710 to biosynthesis glycan in tomato juice-sucrose medium was optimizized,which was a combination of a medium composed of pure tomato juice supplemented with 15%sucrose,with the initial pH value of the medium adjusted to 7.0,and the fermentation undertaken at 28℃with an inoculation ratio of 2.0%.Under the optimized conditions,the glycan synthesized by L. mesenteroides BD1710 in the tomato juice-sucrose medium could reached 32.15 g/L,at the same level or a little higher than the yield of glycan by the same bacterial strain in a reported chemically defined medium suitable for Leuconostoc mesenteroides to express polysaccharides.The polymers obtained from the fermented tomato juice-sucrose medium by L.mesenteroides BD1710 via alchol participation was composed of 97.54% carbohydrate and 0.72%protein,respectively.Therefore,tomato juice-sucrose medium could be an alternative of chemically defined medium for L.mesenteroides strains to biosynthesis glycan.
Leuconostoc mesenteroides BD1710;tomato juice-sucrose medium;exopolysaccharide;glycan
10.3969/j.issn.1005-6521.2015.10.032
2013-11-21
韩瑨(1980—),男(汉),工程师,硕士,研究方向:乳品科学。

