响应面法优化丁香叶总酚酸提取工艺
吴 燕,盛尊来,高凌飞,陈俭清,李艳华(东北农业大学动物医学学院,黑龙江哈尔滨150030)
响应面法优化丁香叶总酚酸提取工艺
吴燕,盛尊来,高凌飞,陈俭清,李艳华*
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
采用响应面法对丁香叶总酚酸的乙醇提取工艺进行优化。以总酚酸提取率为考察指标,在单因素实验基础上,采用响应面分析法对乙醇浓度、提取温度、提取时间和液料比等提取条件进行了优化。结果表明,乙醇回流提取总酚酸的最佳工艺条件为:乙醇浓度44%、提取温度90℃、提取时间96min、液料比25.2∶1(mL/g)、提取次数为2次,在此条件下提取率为(1.642±0.23)mg/g。响应面优化得到的提取工艺稳定合理,准确可靠,是提取丁香叶总酚酸的可行方法。
丁香叶,总酚酸,响应面,提取工艺
紫丁香叶为木樨科(Oleaceae)丁香属(Syringa)丁香的干燥叶,味苦、性寒,其所含主要化学成分有有机酸类、苷类、挥发油等成分[1]。其中,总酚酸类化合物所具有的保健功能主要表现在清除体内自由基、舒张血管、抗癌、抗病毒、抗菌消炎、抗过敏等方面[2]。其较强抗氧化活性与其所含的酚酸类成分有关[3-4],丁香叶中的水溶性酚酸类成分(丹酚酸、迷迭香酸、原儿茶酸、咖啡酸、丹参素等)具有很强的抗脂质过氧化和清除自由基作用[5-6]。
目前,总酚酸类化合物具有抗氧化和清除自由基的活性受到了广泛的关注,但国内对丁香叶中有效成分的提取研究主要集中在黄酮类化合物[7]、总皂苷[8]、丁香酚[9]等方面,对丁香叶中酚酸类成分提取工艺研究较少。为了使丁香叶更广泛的应用于食品添加剂和功能性食品开发领域中,本研究采用响应面(response surface methodology,RSM)分析法对丁香叶总酚酸的提取工艺进行优化,并对丁香叶总酚酸提取物的抗氧化活性进行了初步研究,旨为丁香叶的综合开发利用提供一定理论参考。
1 材料与方法
1.1材料与仪器
丁香叶采自东北农业大学校园内,采收期为2013年9月;原儿茶酸标准品中国药品生物制品检定所生产(批号:20120325,纯度≥98%);乙醇、钼酸钠、亚硝酸钠、氢氧化钠、盐酸等均为分析纯试剂。
UV-8000A紫外分光光度计上海市元析仪器有限公司;DH6000A电热恒温水浴锅天津市泰斯特仪器有限公司;DHG-9070型电热恒温鼓风干燥箱上海恒科学仪器有限公司;BT224S分析天平赛多利斯科学仪器(北京)有限公司。
1.2实验方法
1.2.1丁香叶总酚酸提取精密称量丁香叶粗粉5.00g,置250mL圆底烧瓶中,乙醇回流法在不同的提取条件下提取,提取液抽滤后,用蒸馏水定容至500mL,并精密吸取50mL,加入1mol/L的盐酸溶液10mL,加蒸馏水定容至100mL,备用[10]。
1.2.2标准曲线的制备采用紫外分光光度计法,以原儿茶酸为考察指标测定总酚酸含量[11]。精密称取原儿茶酸对照品(原儿茶酸对照品,在105℃干燥至恒重)12.8mg,加乙醇5mL使溶解,加盐酸液(1mol/L)5mL,用蒸馏水定容至50mL,得浓度为0.0256mg/mL的原儿茶酸标准液,分别精密吸取原儿茶酸标准液0.2、0.4、0.8、1.0、1.2、1.4mL于25mL棕色容量瓶中,精密加入盐酸溶液(6mol/L)0.4mL,亚硝酸钠-钼酸钠溶液(亚硝酸钠10g,钼酸钠15g,加水溶解使成100mL)1mL,摇匀,放置5min,加氢氧化钠液(1mol/L)5mL,摇匀,分别加水稀释至刻度,摇匀;另取相应含量的标准液,除不加亚硝酸钠-钼酸钠溶液外,分别用同一方法处理后,作为空白,于503nm处测定吸光度值。以原儿茶酸浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,得到回归方程y=64.886x-0.0106(r2=0.9999)。总酚酸以原儿茶酸计在0.02048~0.01229mg/mL线性关系良好。
1.2.3丁香叶总酚酸提取单因素实验分别考察乙醇浓度、提取温度、提取时间、液料比和提取次数5个因素对丁香叶总酚酸提取率的影响,以丁香叶总酚酸提取率为考察指标进行评价和分析,以确定最佳参数。精密吸取供试品溶液1mL,按1.2.2项下方法操作并测定吸光度,每个实验重复三次。按以下公式计算提取率:式中:c为稀释的提取液中丁香叶总酚酸的浓度,单位为mg/mL;25为吸取丁香叶总酚酸提取物最终定容至25mL;1000为稀释倍数;m为丁香叶粉质量,单位为g。
因此,理想的社区治理格局是在基层社区党组织的领导下,基层政府及派出机构和社区自治组织以社区为载体,搭建基层公共事务运行平台、社会组织运作平台以及居民参与社会事务的运转平台[8]。这是结果导向的理想式社区治理模式架构,但这一架构仅是社区治理的运行结果状态,并不是路径选择。要达到这种理想化的运行结果,对现实的改造和重塑是不可或缺的环节。

1.2.3.1乙醇浓度对丁香叶总酚酸提取率的影响当提取温度80℃、时间1h、液料比20∶1(mL/g)、提取次数为1次时,考察0%、20%、40%、60%、80%、100%的乙醇溶液对丁香叶总酚酸提取率的影响。
1.2.3.2提取温度对丁香叶总酚酸提取率的影响当乙醇浓度40%、时间1h、液料比20∶1、提取次数为1次时,考察50、60、70、80、90、100℃的温度对丁香叶总酚酸提取率的影响。
1.2.3.3提取时间对丁香叶总酚酸提取率的影响当乙醇浓度40%、温度90℃、液料比20∶1、提取次数为1次时,考察40、60、80、100、120min对丁香叶总酚酸提取率的影响。
1.2.3.4液料比对丁香叶总酚酸提取率的影响当乙醇浓度40%、提取时间100min、温度90℃、提取次数为1次时,考察15∶1、20∶1、25∶1、30∶1、40∶1(mL/g)的液料比对丁香叶总酚酸提取率的影响。
1.2.3.5提取次数对丁香叶总酚酸提取率的影响当乙醇浓度40%、提取时间100min、温度90℃,液料比25∶1时,考察提取次数1、2、3、4次对丁香叶总酚酸提取率的影响。
1.2.4响应面优化工艺条件当提取次数为2次时,总酚酸提取率基本就不再改变,因此在本研究中确定提取次数为两次前提下,采用统计分析软件Design-Expert 8.0.6,根据Box-Behnken的中心组合实验设计原理,基于单因素实验结果,以乙醇体积分数(A)、提取温度(B)、提取时间(C)、液料比(D)为自变量,丁香叶总酚酸提取率(Y)为响应值,采用四因素三水平的响应面分析法进行实验设计,因素水平设计见表1。

表1 丁香叶总酚酸提取响应面分析实验设计因素与水平表Table 1 Variables and levels in response surface design
1.2.5数据处理所有数据均为3次重复实验的平均值,单因素实验数据运用Origin7.5软件绘制趋势曲线图;响应面实验采用Design-Expert 8.0.6软件进行方差分析,并优化出最佳提取工艺。
2 结果与分析
2.1.1乙醇浓度对丁香叶总酚酸提取率的影响从图1可看出,随乙醇浓度的升高,总酚酸提取率呈先上升后下降趋势,当乙醇浓度为40%时提取率值最高。说明40%的乙醇溶液有利于总酚酸类物质的溶出,而当乙醇浓度升高时,提取率降低,这是由于一些脂溶性成分、醇溶性杂质降低了组织的通透性,从而使总酚酸的提取率下降[12]。因此40%乙醇为优化的中心点。
2.1.2提取温度对丁香叶总酚酸提取率的影响从图2可看出,随着温度升高,总酚酸提取率逐渐升高,这是由于温度升高有助于传质过程,使分子扩散运动激烈,加快溶质的扩散和溶剂的渗透,有利于总酚酸类物质的溶出,在90℃时提取率最高,100℃时略有下降,这是由于温度过高,总酚酸中可能有一些成分结构不稳定而被破坏,活性降低[13],鉴于总酚酸的热稳定性,将90℃定为优化的中心点。
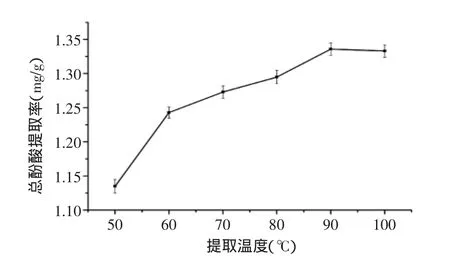
图2 提取温度对总酚酸提取率的影响Fig.2 Effect of extraction temperature on total phenolic acids extraction rate
2.1.3提取时间对丁香叶总酚酸提取率的影响从图3可看出,随提取时间延长,总酚酸提取率迅速升高后,60~80min内总酚酸含量趋于平稳后再升高,这段时间总酚酸的溶出达到饱和,溶出速率趋于平衡。当提取时间为100min时,提取率达到最高,随着提取时间继续延长,提取率开始下降。这可能是由于总酚酸类物质溶出的时间不一致,随着时间的延长,有些酚酸发生缩合、降解、氧化等化学反应,从而使总酚酸含量下降[14]。因此100min为优化的中心点。
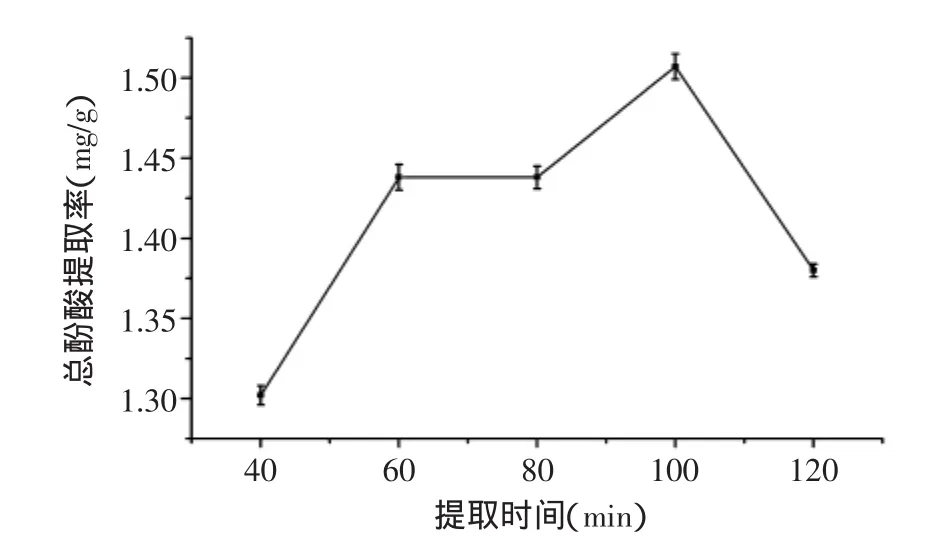
图3 提取时间对总酚酸提取率的影响Fig.3 Effect of extraction time on total phenolic acids extraction rate
2.1.4液料比对丁香叶总酚酸提取率的影响从图4可看出,随液料比增加,总酚酸取率呈先升后降趋势,当液料比为25∶1时达峰值。溶剂量的增加使物料与溶剂接触面积、溶液传质推动力均增大,浓度梯度变大,有利于总酚酸的溶出,从而使其溶出速度和提取率变大,当液料比一定时,提取率最高,随着液料比的继续增加,溶剂体积增加使得物料吸附溶剂的量也逐渐变大,从而导致总酚酸被物料吸附而不易溶出[15]。因此25∶1为优化的中心点。
2.1.5提取次数对丁香叶总酚酸提取率的影响从图5可看出,当提取次数大于2次时,总酚酸提取率没有发生明显的改变,且提取次数越多,提取液的体积越大,将给后续的浓缩带来影响,并造成大量的动力损耗,因此提取次数为2次时为该工艺的最佳提取次数。
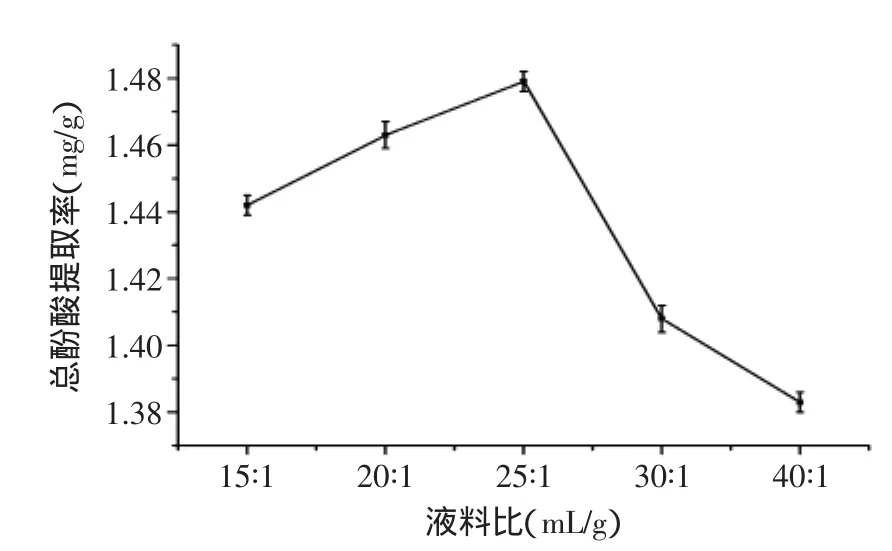
图4 液料比对总酚酸提取率的影响Fig.4 Effect of liquid/material ratio on total phenolic acids extraction rate
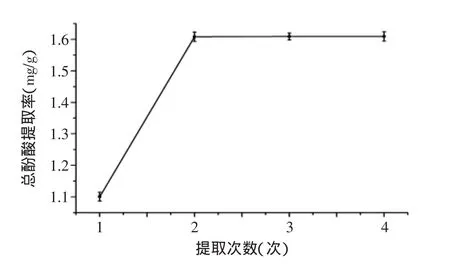
图5 提取次数比对总酚酸提取率的影响Fig.5 Effect of extraction times on total phenolic acids extraction rate
2.2丁香叶总酚酸提取工艺优化
2.2.1数学模型的建立与检验基于单因素实验,采用响应面法对丁香叶总酚酸的提取工艺进行优化,以乙醇浓度(A)、提取温度(B)、提取时间(C)、液料比(D)为自变量,丁香叶总酚酸提取率(Y)为响应值,根据Box-Behnken的实验设计原理,得出丁香叶总酚酸提取率的四因素三水平的实验设计及结果(见表2)。
采用Design expert 8.0.6统计软件,以丁香叶总酚酸提取率为响应值,对表2数据进行多元回归拟合,各影响因子对响应值的影响可得出下列函数关系:

对该模型进行显著性检验,得方差分析表(表3)由表3可知,方程总模型和方程的二次项p=0.0172,表明该模型显著;回归失拟项p>0.05,表明未知因素对该实验的影响较少。总模型和方程的二次项对丁香叶总酚酸提取率的影响是显著性较好。方程的一次项因素C是显著的,A、B、D的p>0.05,表明其对总黄酮提取率的影响不显著,可忽略[16-18]。各因素的F值可以反映出其对实验指标的重要性,F值越大,表明对实验结果的影响越大,即重要性越大。各因素对丁香叶提取率的影响排序为:提取时间>乙醇浓度>液料比>提取温度。
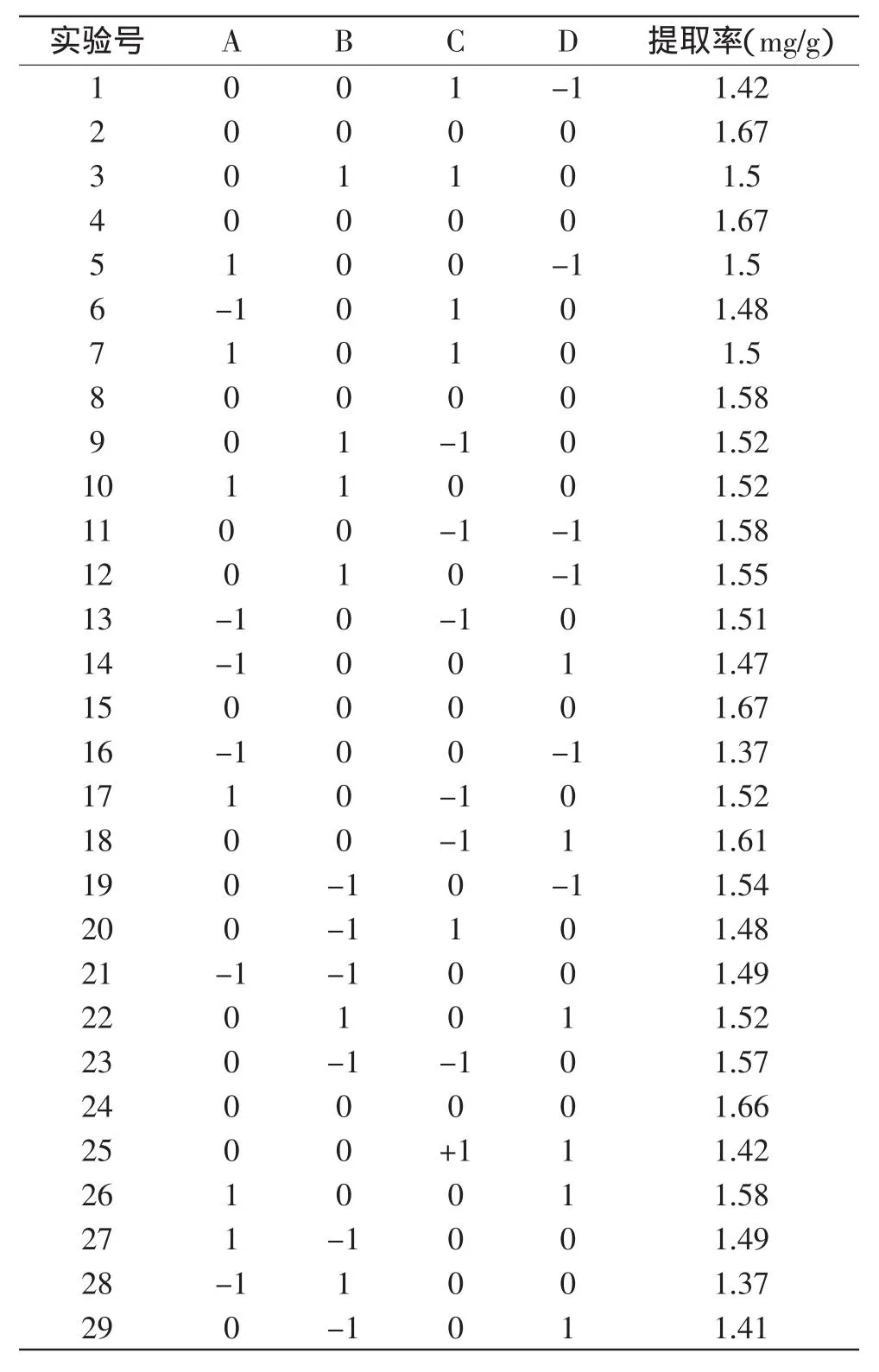
表2 丁香叶总酚酸提取响应面实验设计及结果Table 2 Process variables and levels in response surface Design arrangement and experimental response values

表3 方差分析结果Table 3 Analysis of variance for quadric regression model
2.2.2丁香叶总酚酸提取率的响应面分析响应面图是响应值对各实验因素所构成的三维空间曲面图,可直观的反映各实验因素的交互作用[19-21]。对响应值进行统计分析,研究表明,等高线的形状反映出交互效应的强弱,越趋向椭圆表明交互作用越强,越趋向圆形则相反,表明交互作用越弱[22]。本实验中各因素的交互作用均不显著。
2.2.3丁香叶总酚酸提取工艺条件的优化由该软件分析后得最佳工艺条件乙醇浓度为43.55%,提取温度为90.09℃,提取时间为96.35min,液料比25.2∶1(mL/g),提取次数为2次。为了能让丁香叶总酚酸的提取更加便捷,可取最优条件为乙醇浓度44%,提取温度为90℃,提取时间为96min,液料比25.2∶1(mL/g)。在此条件下经过验证得到总酚酸的实际平均提取率为(1.642±0.23)mg/g,与理论预测值1.66mg/g接近,表明该工艺优化合理。
3 结论
将响应面分析法用于丁香叶总酚酸提取工艺参数的优化,确定的最佳提取工艺为乙醇浓度44%、提取温度90℃、提取时间96min、液料比25.2∶1(mL/g)、提取次数为2次。在此条件下丁香叶总酚酸提取率为(1.642±0.23)mg/g,优化得到的最佳提取工艺是提取丁香叶总酚酸化合物的有效途径,为进一步开发食品添加剂和功能性食品提供了可靠依据。
[1]李博,朱俊访.丁香叶中所含有效成分的种类及药理作用研究进展[J].黑龙江医药,2009,22(4):510-511.
[2]Blasa M,Candiracci M,Accorsi A,et al.Honey flavonoids as protection agents against oxidative damage to human red bloodcells[J].Food Chemistry,2007,104(4):1635-1640.
[3]杭亮,王俊儒,杨东风,等.紫花丹参和白花丹参不同部位有效成分的分布特征[J].西北农林科技大学学报,2008,36(12):218-221.
[4]Zhang Y,Li X,Wang ZZ.Antioxidant activities of leaf extract of Salvia miltiorrhiza Bunge and related phenolic constituents[J]. Food and Chemical Toxicology,2010,48(10):2656-2662.
[5]Peter M,Simmonds MS.Rosmarinic acid[J].Phytochemistry,2003,62(2):121-125.
[6]黄诒森,张均田.丹参中3种水溶性成分的体外抗氧化作用[J].药学学报,1992,27(2):96-100.
[7]孙强,郭永霞.丁香叶中总黄酮提取工艺及数学模拟[J].中国医院药学杂志,2013,33(14):1145-1149.
[8]郝婷婷,严铭铭,郭婷婷,等.紫丁香叶中总皂苷提取工艺的研究[J].时珍国医国药,2008,19(6):1424-1425.
[9]兰掀,王昶,朱广伟.丁香叶中丁香酚提取方法的比较[J].黑龙江医药,2006,19(1):19-20.
[10]米宝丽.中药丁香叶的质量及应用研究[D].沈阳:辽宁中医药大学,2008.
[11]卫生部药品标准中药成方制剂第九册[S].1998:100.
[12]李富华,夏春燕,刘燕妮,等.响应面法优化蜂胶黄酮提取工艺及其抗氧化活性研究[J].食品工业科技,2012,33(20):226-230.
[13]刘朝霞,邹坤,周媛,等.酶法预处理苎麻叶提取总酚酸的工艺优化[J].湖北农业科学,2011,50(10):2105-2107.
[14]张百霞,郭庆梅,王真真,等.响应曲面法优化金银花总酚酸提取工艺[J].中成药,2013,35(10):2144-2148.
[15]刘荣华,陈石生,任刚,等.星点设计-效应面法优化白茅根总酚酸提取工艺[J].中成药,2011,33(7):1149-1153.
[16]任凤莲,谷芳芳,吴梅林,等.利用响应面分析法优化山楂中总黄酮提取条件[J].天然产物研究与开发,2006,18(1):126.
[17]Lee WC,Yusof S,Hamid NSA,et al.Optimizing conditions forhotwater extraction ofbanana juice using response surface methodology(RSM)[J].Journal of Food Engineering,2006,75(4):473-479.
[18]Sin HN,Yusof S,Sheikh AN,et al.Optimization of hot water extraction for sapodilla juice using response surface methodology[J].Journal of Food Engineering,2006,75(3):352-358.
[19]Wang XS,Wu Q,Wu YF,et al.Response surface optimized ultrasonic-assisted extraction of flavonoids from sparganii rhizoma and evaluation of their in vitro antioxidant activities[J].Molecules,2012,17(6):6769-6783.
[20]Pan GY,Yu GY,Zhu CH,et al.Optimization of ultrasoundassisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS)[J].Ultrasonics Sonochemistry,2012,19(3):486-490.
[21]胡国华,陈明.亚麻籽胶的特性及其在冰淇淋中的应用研究[J].食品科学,2003,24(11):90-93.
[22]国蓉,李剑君,国亮,等.采用响应曲面法优化甘草饮片中甘草酸的超声提取工艺[J].西北农林科技大学学报:自然科学版,2006,34(9):187-192.
Optimization of extraction process of total phenolic acids from Syringa oblate Lindl.leaves by response surface methodology
WU Yan,SHENG Zun-lai,GAO Ling-fei,CHEN Jian-qing,LI Yan-hua*
(College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
Total phenolic acids extraction from Syringa oblate Lindl.leaves was performed using the ethanol reflux extraction.Response surface methodology(RSM),based on a three level,four variable Box-Behnken design(BBD),was employed to obtain the best possible combination of ethanol concentration,extraction temperature,extraction time,and water to the raw material ratio for maximum total phenolic acids extraction. The optimum extraction conditions were as follows:ethanol concentration of 44%,extraction time of 96min,extraction temperature of 90℃,and the ratio of water to raw material of 25.2∶1(mL/g),extraction times of 2. Under these conditions,the experimental yield was(1.642±0.23)mg/g.The extraction process obtained by response surface methodology was stable and reasonable,accurate and reliable.It was a feasible method to extract the total phenolic acids from Syringa oblate Lindl.Leaves.
Syringa oblate Lindl.leaves;total phenolic acids;response surface methodology(RSM);extraction process
TS201.1
B
1002-0306(2015)02-0286-05
10.13386/j.issn1002-0306.2015.02.053
2014-04-14
吴燕(1991-),女,硕士研究生,研究方向:动物药学。
李艳华(1972-),女,博士研究生,教授,主要从事病原微生物耐药性及新兽药研发。
黑龙江省留学归国基金(LC2013C05)。

