大孔树脂法分离纯化荚果蕨总三萜
杨晓艳,马 骥,彭 飞,陆 洋,马吉福,习伟佳,张 婷(陕西师范大学生命科学学院,教育部药用植物资源及天然药物化学重点实验室,陕西西安710062)
大孔树脂法分离纯化荚果蕨总三萜
杨晓艳,马骥*,彭飞,陆洋,马吉福,习伟佳,张婷
(陕西师范大学生命科学学院,教育部药用植物资源及天然药物化学重点实验室,陕西西安710062)
目的:筛选出分离纯化荚果蕨总三萜的最佳大孔树脂型号及工艺条件。方法:以荚果蕨总三萜浓度为指标,通过静态和动态实验,筛选最佳大孔吸附树脂并初步确定总三萜纯化工艺。结果:AB-8型大孔树脂吸附解析效果最好,吸附条件:溶液浓度1.96mg/mL,pH为6,流速1.5mL/min,吸附体积5BV;洗脱条件:60%乙醇,流速2.0mL/min,洗脱体积4BV,其回收率为86.27%,纯度82.32%,精制倍数为2.88。结论:AB-8大孔树脂较适合分离纯化荚果蕨总三萜。该工艺简单可行,纯化效果好,可为工业生产中分离纯化荚果蕨总三萜提供理论指导和参考依据。
荚果蕨,总三萜,大孔吸附树脂,分离,纯化
荚果蕨[Matteuccia struthiopteris(L.)Todaro]是球子蕨科(Onocleaceae)荚果蕨属(MatteucciaTodaro)多年生草本植物,含有多种药用成分,如:黄酮类、甾酮类、多糖、萜类等有效成分,为我国主要的五种贯众之一,可全草入药,具有清热解毒、杀虫、止血等功效[1]。近年来作为营养价值极高的绿色山野菜出口,是药食两用的蕨类植物[2]。三萜类化合物为荚果蕨的主要有效成分之一[3],三萜类化合物在抗癌[4]、保肝、降血糖、抗肿瘤、抗病毒[5-7]等方面已有文献报道。
荚果蕨总三萜的提取液中有较多杂质,需要进行选择性分离,以提高总三萜的纯度。大孔吸附树脂具有稳定性高、吸附选择性独特、吸附解析条件温和快捷、再生能力强、使用周期长等诸多优点,广泛应用于食品、医药、环保等方面,同时用于生化物质的分离纯化,尤其适用于中草药有效成分如皂苷类、黄酮类、多酚等的分离纯化及工业化生产[8-11]。目前荚果蕨总三萜的研究还处于提取阶段,缺乏对其分离纯化的系统研究,本实验以荚果蕨总三萜为材料进行纯化研究,考察不同树脂对总三萜的吸附解析性能,为荚果蕨的进一步开发利用提供参考。
1 材料与方法
1.1材料与仪器
荚果蕨采自陕西省宁陕县旬阳坝镇,经陕西师范大学生命科学学院马骥副教授鉴定;齐墩果酸标准品,中国药品生物制品检定所;无水乙醇、冰乙酸、高氯酸均为分析纯;实验用水超纯水;HPD-100、HPD-300、S-8、D101、AB-8均购自西安蓝深特种树脂有限责任公司。
HL-2电脑数显恒流泵上海沪西有限公司;HH-6B数显恒温水浴锅江苏常州国华电器有限公司;KQ-300DE型数控超声波清洗器昆山超声仪器有限公司;SHB-循环水式多用真空泵、RE-52AA旋转蒸发器上海亚荣生化仪器厂;MicroBench PH600TRANS-WIGGENS;超微量微孔板分光光度计美国BioTek。
1.2实验方法
1.2.1总三萜粗提液的制备将荚果蕨粉碎,过60目筛,称2g材料,30mL石油醚脱脂两次,以60%乙醇,料液比1∶30,在300W,63℃的水浴中超声39min,提取两次合并提取液旋蒸挥去乙醇,冷冻干燥成粉末,放于冰箱中储存备用[12]。
1.2.2标准曲线的绘制准确称取干燥恒质量的齐墩果酸标准品2mg置于10mL的容量瓶中,加入无水乙醇定容,制得0.2mg/mL的标准溶液。吸取系列梯度的标品溶液置于10mL的具塞试管中,在60℃恒温水浴锅中挥干,流水冷却后加5%的香草醛-冰乙酸0.2mL,高氯酸0.8mL,摇匀,60℃水浴锅加热15min,流水冷却,加5mL冰乙酸,摇匀后在550nm处测定吸光值[13-14]。以齐墩果酸质量为横坐标,吸光值为纵坐标,绘制标准曲线。得回归方程为:Y=8.1738x-0.0174,相关系数R2=0.9995。
1.2.3总三萜含量测定准确称取1.2.1中样品粉末1g于试管中,加入蒸馏水10mL溶解,再按1.2.2中方法显色,测吸光值,根据标准曲线计算荚果蕨总三萜含量。
1.2.4树脂的预处理[15]称取一定不同型号大孔吸附树脂,用2BV的无水乙醇浸泡树脂并搅拌,待充分溶胀24h后,继续用乙醇洗涤,洗至洗出液无白色浑浊,再用蒸馏水洗尽乙醇,至无醇味。进行酸碱处理,用2BV的5%HCl溶液浸泡3h后,用蒸馏水冲洗至中性;用2BV的5%NaOH溶液浸泡3h,而后用蒸馏水洗至中性,蒸馏水浸泡备用。
1.2.5树脂的筛选[16-17]根据荚果蕨总三萜的理化特性和大孔树脂的吸附性能,选用AB-8、HPD-100、HPD-300、D101、S-85种型号树脂进行实验,以大孔树脂对荚果蕨总三萜的静态吸附量、吸附率、解析量、解析率指标评价树脂。称取2g预处理好的树脂(湿重),置于100mL的三角瓶中,分别加入1.52mg/mL的溶液20mL,各三个重复。于25℃,1200r/min的摇床中振荡10h,测定吸附前后的总三萜质量浓度的变化,按下列公式(1)、(2)计算各树脂的静态吸附量和吸附率。同理,将吸附饱和的树脂用蒸馏水冲洗,加入20mL 70%的乙醇洗脱,放入同样条件的摇床中解吸10h,按公式(3)、(4)计算解析量和解析率。

式中:E:吸附量(mg/g);Q:吸附率(%);C0:初始浓度(mg/mL);Ce:吸附后的浓度(mg/mL);V:初始溶液体积(mL);W:湿态树脂质量(g)。

式中:M:解析量(mg/g);N:解析率(%);V1:解析液的体积(mL);C1:解析后的浓度(mg/mL)。
1.2.6AB-8大孔树脂静态吸附与解析
1.2.6.1静态吸附动力学曲线准确称取2g树脂(湿重)置于100mL三角瓶中,加20mL总三萜溶液静态吸附。分别在0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0、6.0h取80μL溶液于60℃水浴挥干。以时间为横坐标,吸附量为纵坐标绘制吸附曲线。
1.2.6.2静态解析动力学曲线准确称取2g吸附饱和的树脂置于100mL的锥形瓶中,加入70%的乙醇20mL洗脱,分别在0.5、1.0、1.5、2.0、3.0、4.0h取80μL于60℃水浴挥干。以时间为横坐标,解析量为纵坐标绘制解析曲线。
1.2.7AB-8大孔树脂的动态吸附与解析
1.2.7.1上样浓度将不同浓度的总三萜溶液以2mL/min流速,提取液的初始pH为5.77(pH计测定)上样,吸附3h后,分别取吸附后的溶液测吸附率,以确定最佳浓度。
1.2.7.2上样流速用浓度为1.96mg/mL,pH为5.77的样品溶液以不同流速各上样20mL。吸附3h后取吸附后的溶液测吸附率,确定最佳上样流速。
1.2.7.3样液pH用浓度1.96mg/mL,流速1.5mL/min,分别用NaOH、HCl溶液将样液调至不同的pH上柱。3h后取吸附液测总三萜含量,确定最佳上样pH。
1.2.7.4洗脱曲线的绘制取20g树脂装柱,以浓度1.96mg/mL、流速1.5mL/min、pH为5.77的样液上样,每隔10mL收集一管,测流出液中总三萜浓度,一般当流出液的浓度达到上样液浓度的1/10时,认为此处是总三萜的泄漏点,以流出液体积为横坐标,流出液中总三萜含量为纵坐标绘制洗脱曲线,计算饱和动态吸附量。
1.2.7.5洗脱剂浓度的选择考虑到洗脱剂的毒性大小及回收和后处理等因素,选择乙醇为洗脱剂。树脂吸附饱和后,先用3BV蒸馏水将多糖等水溶性杂质洗脱,再分别用30%、40%、50%、60%、70%、80%的乙醇以2mL/min的流速进行梯度洗脱3BV,分别测定各洗脱液的解析量,以确定最佳的洗脱剂的体积分数。
1.2.7.6洗脱流速将吸附饱和的树脂用蒸馏水洗脱3BV,再用60%的乙醇以不同的流速洗脱3BV,测洗脱液的解析量,确定最佳洗脱流速。
1.2.7.7洗脱体积将吸附饱和的树脂用蒸馏水洗脱3BV,再用60%以2mL/min进行洗脱,每10mL收集一管洗脱液,共收集100mL溶液。测各管洗脱液总三萜浓度,确定最合适的洗脱体积。
1.2.7.8荚果蕨总三萜的纯度与回收率测定[18]
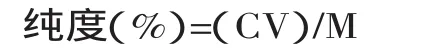
式中:C:样液中总三萜的浓度(mg/mL);V:样液的体积(mL);M:总三萜粉末的干重(mg)。

式中:Ca:纯化前的浓度(mg/mL);Cb:纯化后的浓度(mg/mL);Va:上柱的溶液体积(mL);Vb:纯化后洗脱液的体积(mL)。
1.2.8数据处理采用SPSS 16.0软件对实验数据分析处理。
2 结果与分析
2.1大孔树脂的筛选
在相同实验条件下,各树脂的静态吸附解析结果如表1所示,从表1中可看出,与其他型号树脂相比,AB-8型树脂对荚果蕨总三萜具有较好的吸附和解析效果。影响大孔树脂吸附解析性能的因素很多,如:树脂的颗粒孔径、表面积、极性、被吸附物质的极性等。因此不同型号的树脂对总三萜的吸附解析性能各有差异,实验结果表明,吸附量较大的多为非极性或弱极性树脂,如AB-8、HPD-100、D101。五种树脂中,综合考虑以上4个指标,AB-8树脂的吸附解析效果最好,本实验选择AB-8作为荚果蕨总三萜的分离纯化树脂。
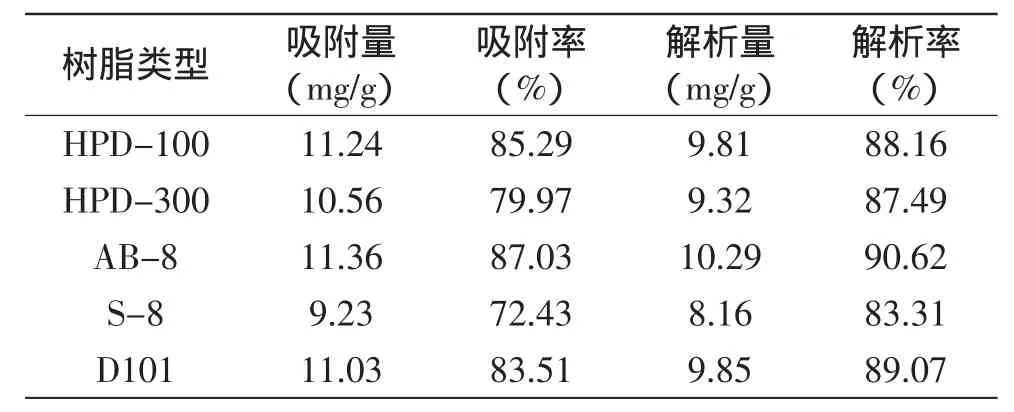
表1 不同树脂对总三萜的吸附解析结果Table 1 Adsorption and desorption performance ofdifferent resins towards triterpenes
2.2AB-8大孔树脂的静态吸附解析曲线
2.2.1静态吸附动力学曲线由图1可知,0~3h之间树脂吸附速率较快,吸附量随时间延长增大,至3h后吸附量基本趋于饱和,变化平缓,说明AB-8大孔树脂对荚果蕨总三萜的吸附为快速平衡型[19],省时高效,具有良好的静态吸附特性,适用于工业生产中的分离纯化。
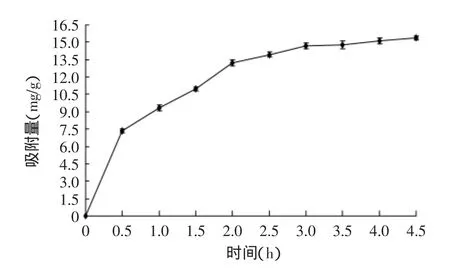
图1 总三萜静态吸附动力学曲线Fig.1 The static adsorption kinetic curve of total triterpenes
2.2.2静态解析动力学曲线由图2可知,在0.5h解析时间内,总三萜的解析速率较快,解析量随之增大,超过1h后,随着时间的延长,解析量达到平衡。即当静态解析时间达1h时就基本解析完全,表明吸附饱和的树脂解析时间较短,可降低成本,更适于工业化生产。
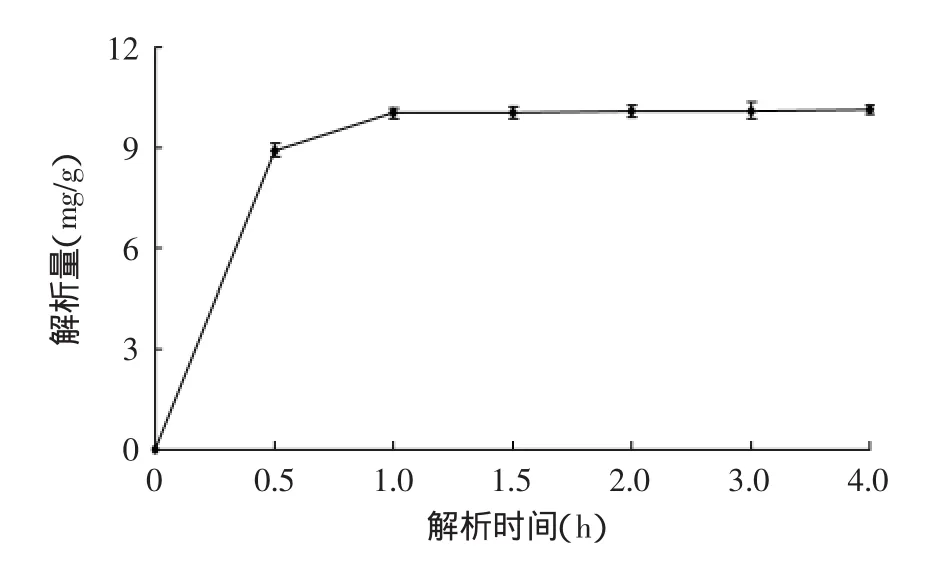
图2 总三萜静态解吸时间动力学曲线Fig.2 The static desorption kinetic curve of total triterpenes
2.3AB-8树脂对荚果蕨总三萜的动态吸附
2.3.1上样浓度对树脂的吸附效果的影响由图3可知:以不同浓度的总三萜溶液上样,AB-8树脂的吸附率随浓度先递增后趋于平衡。若总三萜浓度较小,树脂不能被充分利用而造成浪费;若浓度太大,溶质不易溶解且吸附率趋于饱和,会使树脂堵塞,为后续的解析及树脂再生造成困难[20],综合考虑各因素,选择最佳上样浓度为1.96mg/mL。
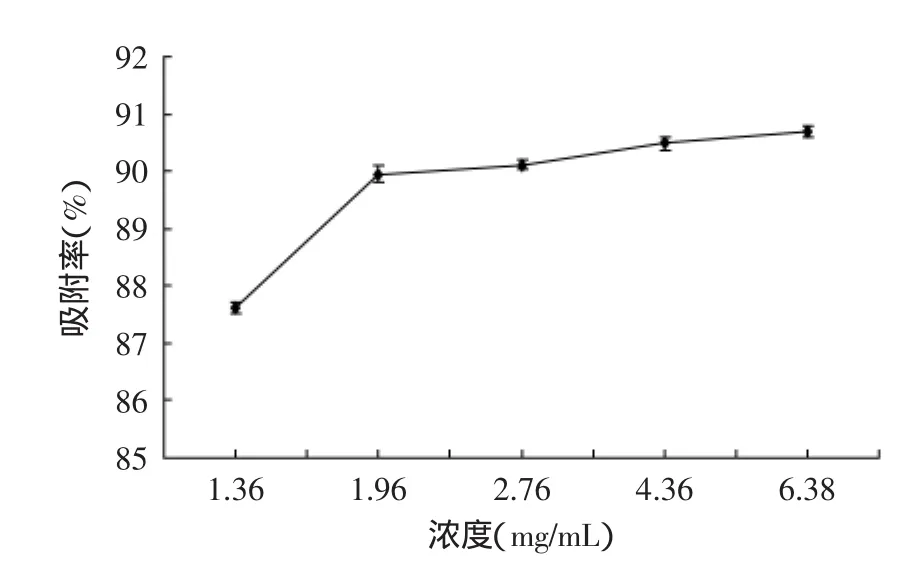
图3 浓度对吸附率的影响Fig.3 The effect of concentration of triterpenes on adsorption
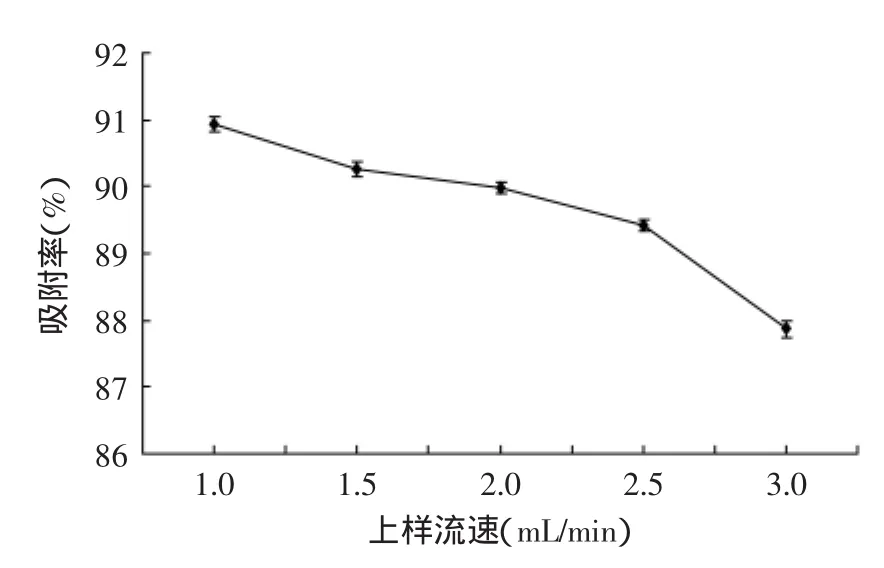
图4 流速对吸附率的影响Fig.4 The effect of the sample flow velocity on adsorption
2.3.2上样流速对树脂吸附效果的影响由图4知,吸附率随上样速度的增大而降低,其原因是流速越慢,总三萜在树脂中停留的时间越久,利于二者的吸附;反之,流速较大时,停留时间变短不利于互相吸附,从而降低了吸附率。但流速太小会使操作周期延长,生产效率降低,不利于工业中大批量纯化,综合吸附率和工作效率,1.5mL/min的流速上样最佳。
2.3.3样液pH对树脂吸附效果的影响由图5可知,样液的不同pH对吸附率的影响较大。pH对大孔树脂的吸附效果与被吸附物质的酸碱性有关,酸性物质在酸性溶液中易吸附,碱性化合物在碱性溶液中易吸附[21]。图5可见荚果蕨总三萜溶液在pH为6左右时吸附最好,因为总三萜提取液呈弱酸性(pH= 5.77)时,三萜皂苷以分子形势存在,利于树脂的吸附,在中性或碱性溶剂中则吸附降低,因此选择pH为6适宜。

图5pH对吸附率的影响Fig.5 The effect of pH value of triterpenes on adsorption
2.3.4洗脱曲线的绘制由图6可知,以1.96mg/mL上样,树脂的吸附效果随上样体积的增加而降低。在50mL之前,吸附效果较好,流出液的总三萜浓度很小。100mL时流出液的浓度为0.195mg/mL,达到初始浓度的1/10,即此处为泄漏点,表明该树脂吸附性能较好,最多可上样100mL(5BV)溶液。
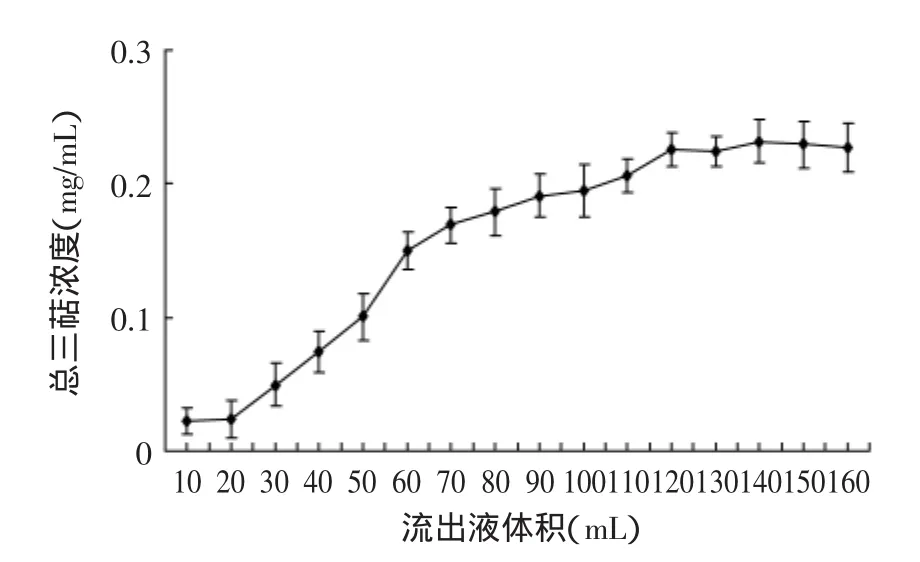
图6 吸附洗脱曲线Fig.6 The curve of adsorption leak of triterpenes
2.4AB-8树脂的动态解析效果
2.4.1乙醇浓度对解析效果的影响由图7所示,不同体积分数的乙醇解析效果不同,体积分数在30%~60%之间时,解析量不断增加,而高于60%时,解析量随之逐渐降低。根据相似相溶原理,60%乙醇能充分溶解总三萜或该极性可更好的减弱总三萜与树脂间的吸附力,使解析效果最佳。
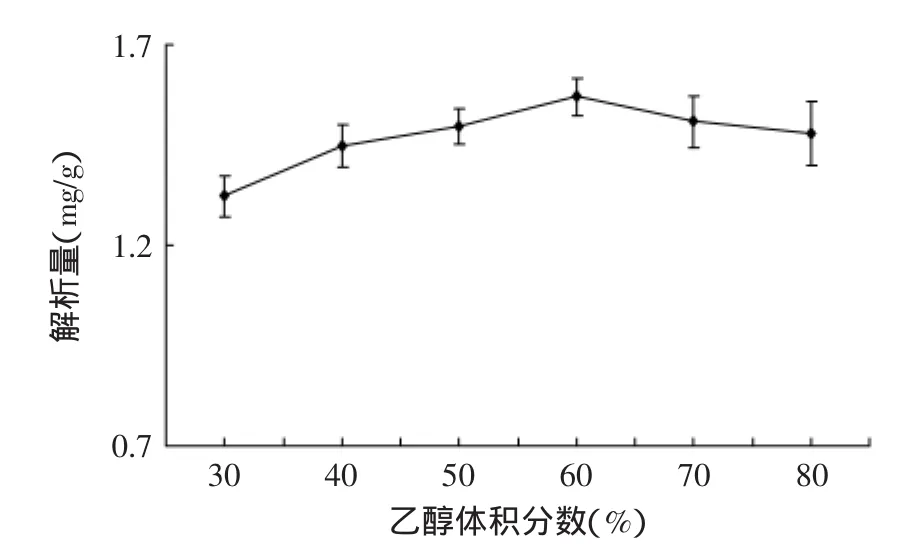
图7 乙醇体积分数对解析量的影响Fig.7 The effect of ethanol concentrations on desorption of macroporous resin
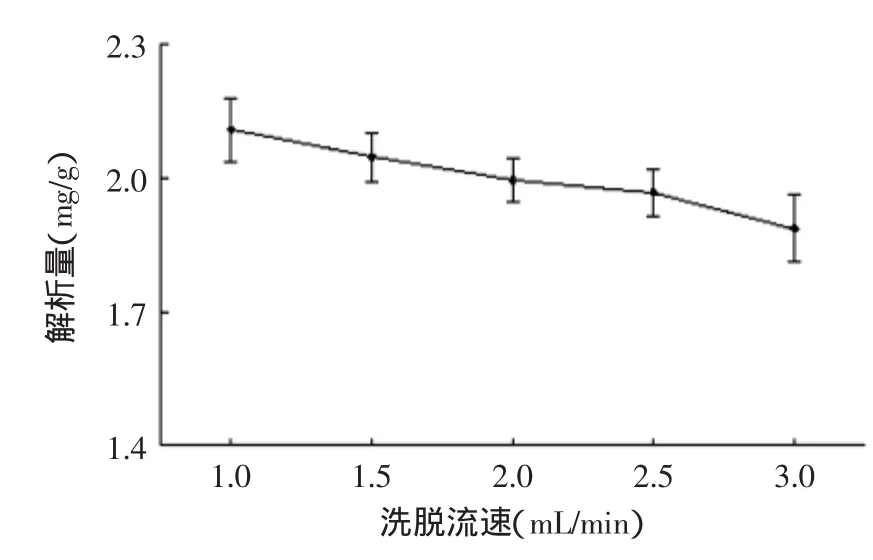
图8 洗脱流速对解析量的影响Fig.8 The effect of elution velocity on desorption of macroporous resin
2.4.2洗脱流速对解析效果的影响分别以不同流速的蒸馏水和60%乙醇进行动态洗脱,在图8中可知,随着洗脱流速的增大,解析量呈降低的趋势。解析流速过大,乙醇不能与被吸附的总三萜充分接触而将其从树脂上洗脱下来,使解析效果不佳。流速过小,解析完全但工作周期太长,因此兼顾较高的解析量和较短的实验周期,选择2.0mL/min的速度洗脱最好。
2.4.3洗脱剂用量考察由图9所示,解析峰非常集中,峰型较窄且无明显的拖尾现象。经测定,当洗脱体积达2BV时,所需的大部分目标物已被洗脱下来,当洗脱液为80mL(4BV)时,洗脱液中总三萜浓度几乎为零,说明4BV的洗脱液已经将总三萜洗脱完全,故确定最佳洗脱剂用量为4BV。

图9 洗脱曲线Fig.9 The curve of desorption of triterpenes
3 结论
本实验对5种不同型号的大孔树脂进行筛选,分离纯化荚果蕨总三萜的理想大孔吸附树脂是AB-8。通过考察不同因素对纯化效果的影响,初步确定最佳吸附条件:上样浓度1.96mg/mL,上样流速1.5mL/min,样液pH6,最大上样量达5BV;最佳洗脱条件:60%乙醇,2.0mL/min洗脱速度,4BV洗脱体积。其回收率为86.27%,纯度从28.61%提高到82.32%,精制倍数达2.88,说明AB-8大孔吸附树脂对荚果蕨总三萜具有较好的纯化精制效果,选择性好,吸附解析率高,操作简单易行且无毒害作用。
与其他三萜类物质的分离纯化研究[22-23]相较而言,本文所用的乙醇浓度低、用量少、节约成本,其纯度和回收率也有一定的提高,因此该方法在分离纯化药材中三萜类物质方面具有一定推广价值,可为工业生产中荚果蕨总三萜的分离纯化及单体的鉴定等方面提供可靠的理论和参考依据。
[1]李晓,杨利民,王少江.不同采收时期荚果蕨营养叶中总黄酮含量测定[J].林业科技,2011,36(3):29-31.
[2]朱立新.中国野菜开发与利用[M].北京:金盾出版社,2000:90-98.
[3]Nakata T,Yamada T,Taji S,et al.Structure determination of inonotsuoxides A and B and in vivo anti-tumor promoting activity of inotodiol from the sclerotia of Inontus obliquus[J]. Bioorganic Medicinal Chemistry,2007,15(1):257-264.
[4]Li J,Guo WJ,Yang QY.Effects of ursolic acid and oleanolic acid on human colon cancinoma cell line HCT15[J].Word J Gradtroenterol,2002,8(3):493-495.
[5]Singh B,Sahu P M,Lohiya R K,et al.An-ti-inflammatory activityofalkanoidsandtriter-penoidsfromtrichodesma amplexicaule roth[J].Phytomedicine,2006,13(3):152-156.
[6]Angeh J E,Huang X,Sattler I,et al.Antimicrobial and antiinflammatory activity of four known and one new triterpenoid from com-bretum imberbe(combretaceae)[J].Ethnopharmacol,2007,15(1):257-264.
[7]杨庆新,黄建安,刘仲华,等.枇杷叶中三萜酸的研究进展[J].食品工业科技,2008,29(3):282-285.
[8]Zhang GW,Hu MM.Optimized ultrasonic-assisted extraction of flavonoids from Prunella vulgaris L.and evaluation of antioxidant activities in vitro[J].Innovative Food Sci Emerging Technol,2011,12(1):18-25.
[9]Li J,Chen ZB,Di DL.Preparative separation and purification of rebaudioside A from Stevia rebaudiana Bertoni crude extracts by mixed bed of macroporous adsorption resins[J].Food Chemistry,2012,132(1):268-276.
[10]李颖畅,李冰心,吕艳芳,等.AB-8型大孔树脂纯化蓝莓叶多酚的工艺研究[J].食品工业科技,2012,33(20):258-261.
[11]Li C,Wang NX,Zhang Y,et al.Using AB-8 macroporous adsorption resin for separation and purification of total flavonoids from Stenoloma chusana(L.)Ching[J].Food Sci,2011,32(16):31-35.
[12]杨晓艳,彭飞,陆洋,等.响应面法优化荚果蕨总三萜超声提取工艺[J].食品工业科技,2014,35(15):200-209.
[13]李斌,李元甦,孟宪军,等.响应曲面法优化北五味子总三萜的提取工艺[J].食品科学,2010,31(16):106-108.
[14]Chen Yi,Xie Mingyong,Gong Xiaofeng.Microwave-assisted extraction used for the isolation of total triterpenoid saponins from Ganoderma atrum[J].Journal of Food Engineering,2007,81(1):162-170.
[15]宋倩,赵声兰,刘芳,等.大孔吸附树脂分离纯化核桃壳总黄酮[J].食品与发酵工业,2012,38(12):180-183.
[16]赵芳春,赵兵,黄云祥.大孔吸附树脂纯化芦笋皂苷工艺研究[J].食品工业科技,2012,33(18):248-252.
[17]许怀德,陈佳,包蓉,等.大孔吸附树脂分离纯化洋葱皮黄酮的研究[J].食品科学,2011,32(12):133-137.
[18]张智,于震,王振宇,等.落叶松树皮多酚纯化工艺研究[J].食品工业科技,2014,35(5):187-191.
[19]王清亭,王晓东,赵兵.大孔树脂分离纯化文冠果种仁总皂苷[J].食品工业科技,2013,34(10):219-223.
[20]许亮,师俊玲,陈志娜,等.大孔树脂分离纯化宁夏枸杞总黄酮的研究[J].离子交换与吸附,2011,27(3):202-211.
[21]李洋,曹珊珊,张媛,等.大孔树脂分离纯化褚果总黄酮优化工艺研究[J].离子交换与吸附,2013,29(4):323-333.
[22]尹忠平,上官新晨,张月红,等.大孔树脂吸附纯化青钱柳叶三萜化合物[J].食品科学,2011,32(6):61-65.
[23]冯素香,苗明三,苗晋鑫,等.AB-8大孔吸附树脂同时分离纯化毛冬青总黄酮、总皂苷工艺[J].中国实验方剂学杂志,2012,18(3):5-7.
Separation and purification of triterpenes from Matteuccia struthiopteris with macroporous resin
YANG Xiao-yan,MA Ji*,PENG Fei,LU Yang,MA Ji-fu,XI Wei-jia,ZHANG Ting
(Life Science College,Shaanxi Normal University,Key Laboratory of Minisitry of Education for Madicinal Plant Resource and Natural Pharmaceutical Chemistry,Xi’an 710062,China)
Objective:An optimal macroporous resin and process that to separate and purify triterpenes from Matteuccia struthiopteris was reasearched.Methods:The optimal resin and purificating technology were preliminary selected through the static and dynamic test,taking the concentration of triterpenes as the main index.Results:The best macroporous resin was AB-8,the adsorption conditions were described as follows:the pH and concentration of sample was 6 and 1.96mg/mL,the maximum injection volume was 5BV,the flow velocity was 1.5mL/min.The desorption process was determined as follows:60%ethanol was used as eluent at the flow rate of 2.0mL/min with 4BV,the recovery rate reached up to 86.27%,the purity was 82.32%,the purified multiples of triterpenes was 2.88.Conlusion:These data demonstrated the AB-8 macroporous resin in purifying triterpenes from Matteuccia struthiopteris was well.This method was easy to operate and displayed a good purification effect,the certain reference and theoretical guidance for separation and purification of triterpenes in industrial application could be provided.
Matteuccia struthiopteris;triterpenes;macroporous resin;separation;purification
TS201.1
B
1002-0306(2015)02-0238-05
10.13386/j.issn1002-0306.2015.02.043
2014-05-22
杨晓艳(1989-),女,硕士研究生,研究方向:药用植物资源。
马骥(1964-),男,硕士研究生,副教授,研究方向:药用植物资源。
国家“十二五”科技支撑计划课题(2011BAI06B05);国家大学生创新实验项目(201310718050)。

