莲房多酚提取工艺优化及其抗氧化活性研究
钟怡平,夏道宗,黄 岚,王思为,方月娟
(浙江中医药大学药学院,浙江杭州310053)
莲房多酚提取工艺优化及其抗氧化活性研究
钟怡平,夏道宗*,黄岚,王思为,方月娟
(浙江中医药大学药学院,浙江杭州310053)
在单因素实验的基础上,通过正交实验优化了热回流提取莲房多酚的工艺,并通过测定其清除ABTS+自由基、DPPH自由基、OH自由基的能力,还原力,亚铁离子螯合活性及对大鼠脑匀浆脂质过氧化的影响,对莲房多酚的抗氧化活性进行综合研究。结果表明,热回流提取莲房多酚的最佳工艺参数为:乙醇浓度50%,料液比1∶25,提取温度80℃,提取时间为2h,最优条件下的得率是5.23%。莲房多酚的体外抗氧化实验表明莲房多酚对DPPH自由基、ABTS+自由基、OH自由基有很强的清除能力,对亚铁离子的螯合活性和还原力均较强,并能显著抑制大鼠脑匀浆脂质过氧化。本研究表明在该优化工艺下提取的莲房多酚具有较强的抗氧化活性。
莲房,多酚,提取,抗氧化
莲为睡莲科莲属多年生水生草本植物,是一种常见的药食两用经济作物[1]。莲类药材(荷叶、莲房、莲子、莲子心、藕节等)均可作为药物用来治疗多种疾病[2-3]。我国莲资源充足,而作为莲非可食部分的莲房却一直被视为废弃物丢弃,利用价值不高。目前关于莲房的研究还处于起步阶段,开发莲房不仅具有一定的科学价值,还会带来不错的经济效益。有报道称,莲房中富含多酚,对莲房多酚的开发研究空间很大,值得深入考察[4-6]。此外,华中农业大学在莲源花青素领域的研究也成果颇丰。植物多酚可以通过减少自由基的产生而削弱自由基对机体的损伤,因此该类化合物在医药和保健方面必将有广泛的应用[7-8]。本文采用正交实验优化了热回流提取莲房多酚的工艺,并通过测定其清除ABTS+自由基、DPPH自由基和OH自由基的能力,结合亚铁离子螯合活性和还原力测定,以及对大鼠脑匀浆脂质过氧化的影响,从化学、生物学角度对莲房多酚的抗氧化活性进行综合研究,为进一步利用和研究莲房提供实验依据。
1 材料与方法
1.1材料与仪器
莲房采自浙江中医药大学中药饮片有限公司,产地湖南;1,1-二苯基-2-苦基苯肼(DPPH)、二铵盐自由基(ABTS)、2,4,6-Tris(2-pyridyl)-s-triazine(TPTZ) 美国Sigma-A ldrich公司;乙醇、福林酚试剂、无水碳酸钠、没食子酸、抗坏血酸、无水乙酸钠、冰乙酸、盐酸、FeCl3、FeSO4、H2O2、KH2PO4、三氯乙酸、硫代巴比妥酸、Ferrozine、D-脱氧核糖、EDTA-2Na等。
FA2004电子分析天平上海菁海仪器有限公司;R201旋转蒸发仪上海申胜生物技术有限公司;低温冷却液循环泵郑州长城科工贸有限公司;UV-2600紫外可见分光光度计上海尤尼柯仪器有限公司;GZX-9140 MBE恒温干燥箱上海博讯实业有限公司医疗设备厂。
1.2实验方法
1.2.1多酚含量的测定没食子酸标准曲线的绘制:准确吸取浓度为100μg/m L的没食子酸标准溶液0、0.1、0.2、0.4、0.6、0.8m L于10m L比色管中,加入5m L福林酚试剂、4m L 75g/L的Na2CO3溶液。旋涡混匀15s后,用蒸馏水定容至刻度,40℃放置30m in,显色。用分光光度计测定775nm的吸光值,绘制标准曲线,计算回归方程。
莲房多酚含量测定:准确称取已过20目筛的莲房粉末2g,加入一定量一定浓度乙醇,于一定温度下提取,提取一定时间后进行抽滤,旋转蒸发,蒸馏水定容至50m L,取1m L定容至100m L,取1m L待测液,按照标准曲线的方法测定总酚含量。
莲房多酚得率(%)=(样液中多酚含量(mg/L)×样液体积(L)×稀释倍数)÷莲房质量(mg)×100
1.2.2单因素提取实验为研究乙醇浓度、料液比、提取时间、提取温度四个因素对莲房多酚得率的影响,分别进行单因素实验。
1.2.2.1乙醇浓度对莲房多酚提取效果的影响采用0、30%、40%、50%、60%、70%、80%、100%八个水平,料液比1∶20,在水浴温度60℃条件下提取1h。
1.2.2.2提取温度对莲房多酚提取效果的影响采用40、50、60、70、80、90℃六个水平。以60%乙醇溶液为溶剂,料液比1∶20提取1h。
1.2.2.3提取时间对莲房多酚提取效果的影响采用0.5、1、1.5、2、2.5、3h六个水平,以60%乙醇溶液为溶剂,料液比1∶20,在水浴温度80℃条件下提取。
1.2.2.4料液比对莲房多酚提取效果的影响采用1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40七个水平,以60%乙醇溶液为溶剂,在水浴温度80℃条件下提取1h。
1.2.3正交实验根据单因素实验的结果,以乙醇浓度、料液比、提取时间、提取温度作为正交实验的四个因素,每个因素取三个水平进行优化,因素水平表见表1。
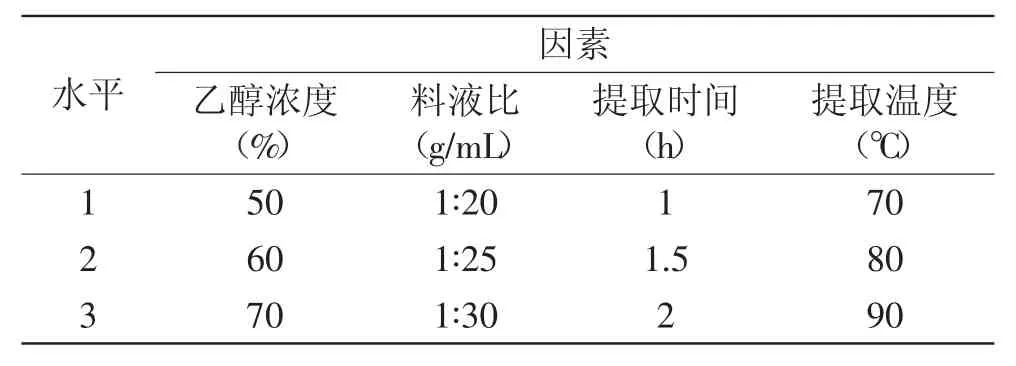
表1 正交实验因素水平表Table 1 Factors and levels design of orthogonal experiment
1.2.4体外抗氧化实验将莲房多酚配制成八个浓度500、250、100、50、25、10、5、2.5μg/m L。配制阳性对照抗坏血酸(1mg/m L):称取10.0mg抗坏血酸,用蒸馏水定容至10m L。即1000μg/m L,然后稀释成500、250、 100、50、25、10、5μg/m L系列浓度。
1.2.4.1清除DPPH自由基能力的测定[9-10]准确称取20mg DPPH自由基,用无水乙醇溶解配制成2× 10-4mol/L的溶液(253.6m L)。取等体积(2m L)待测液及2×10-4mol/L DPPH溶液加入同一具塞试管中,摇匀。室温下避光放置30m in后用无水乙醇做参比在517nm下测定其吸光度Ai,同时测定2×10-4mol/L DPPH溶液与等体积无水乙醇(2m L)混合液的吸光度Ac,以及待测液(2m L)与等体积无水乙醇混合液的吸光度Aj。根据式(1)计算样品对DPPH自由基的清除率,求取试样清除DPPH自由基的IC50。
DPPH自由基清除率(%)=[1-(Ai-Aj)]/Ac×100
1.2.4.2清除ABTS+自由基的能力测定[11]取0.4m L不同浓度的样品溶液,加入3.6m L 0.0875mmol/L ABTS溶液,漩涡混合后于暗处静置10m in,测定734nm的吸光值。对照管以0.4m L 70%乙醇替代样品。根据式(2)计算清除率,并求取试样清除ABTS+自由基的IC50。
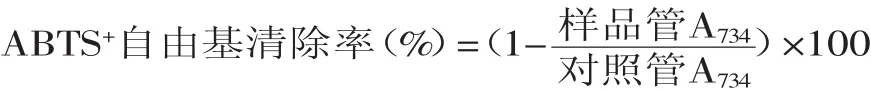
1.2.4.3还原力的测定—铁离子还原法[12]吸取系列浓度FeSO4溶液绘制标准曲线。吸取100μL待测样品,与3m L FRAP溶液混合,再加300μL体积蒸馏水,在37℃水浴中反应4m in,于593nm波长下读取吸光值,并在标准曲线上获得待测样品相应的FeSO4浓度,定义为当量浓度(FRAP值)。结果表示为每mg样品中相当于的FeSO4的量。
1.2.4.4清除OH自由基能力的测定[13]取0.1m L不同浓度的样品水溶液,加入0.690m L 20mmol/L pH7.4的KH2PO4-KOH缓冲液(含2.5mmol/L 2-脱氧核糖),然后加入0.1m L预先混合的1.0mmol/L硫酸亚铁和1.04mmol/L EDTA(1∶1体积混合)。(反应液保持37℃温浴,常温放置)加入0.1m L 1.0mmol/L的抗坏血酸和0.01m L 0.1mol/L H2O2启动反应,37℃下温浴30m in。取出后加入1%硫代巴比妥酸1m L和2.8%三氯乙酸1.0m L,95℃下反应15m in以产生颜色。取出立即冷却,532nm测吸光值。对照管以0.1m L蒸馏水代替样品。
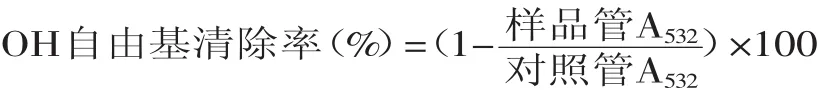
1.2.4.5亚铁离子螯合活性测定[12]0.2m L不同浓度的样品溶液中加入0.2m L 50μmol/L FeSO4和1.4m L 0.15mol/L NaCl溶液,加入0.2m L 300μmol/L菲咯嗪启动反应,剧烈振摇后(漩涡混合5s),室温下放置10m in。测定562nm的吸光值,若吸光值越低,表示对铁离子的螯合能力越强。空白管用0.2m L 0.15mol/LNaCl代替菲咯嗪。

1.2.4.6对大鼠脑匀浆脂质过氧化的影响(丙二醛含量及抑制率的测定)[13]大鼠处死后,在冰台上快速取脑,称重,加10倍量生理盐水匀浆,制备10%脑匀浆液。取10%新鲜脑匀浆0.6m L,加0.4m L生理盐水,漩涡混匀,加入0.3m L不同浓度的样品溶液,加入0.3m L 1mmol/L Fe2SO4,加入0.3m L 10mmol/L H2O2,在37℃下水浴1h后,加入1m L 15%三氯乙酸(TCA)终止反应,3000r/m in离心15m in,得上清液,取1.5m L上清液,加入1.0m L 1%的硫代巴比妥酸,100℃反应15m in。冷却(固定冷却时间),用分光光度计测定532nm的吸光值。对照管以0.3m L蒸馏水代替样品。根据TBA-MDA产物(TBARS)的摩尔消光系数1.56× 105(mol/L)-1·cm-1计算MDA的浓度。

1.2.4.7数据处理所有数据均测定三次,取平均值;采用SPSS 13.0软件进行数据处理。
2 结果与分析
2.1回归方程确立
以没食子酸标准溶液浓度为横坐标,以其吸光度为纵坐标,绘制标准曲线,计算得没食子酸标准曲线回归方程为:Y=0.0147X+0.0190(R2=0.9993)
2.2单因素实验结果与分析
2.2.1乙醇浓度对莲房多酚提取效果的影响由图1可见,随着乙醇浓度增大,莲房多酚得率呈先上升后下降趋势,这可能是因为莲房多酚结构复杂,极性跨度范围较大,溶剂极性过大或过小对总多酚提取均有一定的影响,从本实验结果来看,当乙醇浓度为60%左右时,提取率达最大值。
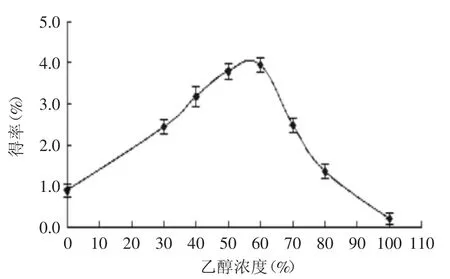
图1 不同乙醇浓度对莲房多酚得率的影响Fig.1 Effect of ethanol concentration on extraction yield
2.2.2温度对莲房多酚提取效果的影响由图2可见,随着温度升高,莲房多酚得率升高,当提取温度为80℃时,莲房多酚得率最高,温度升高加快分子运动速度,有利于细胞中多酚物质的溶出。但当温度再度升高,得率反而下降,这可能是由于高温导致了部分莲房多酚的氧化。

图2 不同提取温度对莲房多酚得率的影响Fig.2 Effectof extraction temperature on extraction yield
2.2.3提取时间对莲房多酚提取效果的影响由图3可见,提取时间越长,莲房多酚提取越充分,效率越高,但时间过长可能会导致多酚的氧化损耗,最佳提取时间在1h左右。
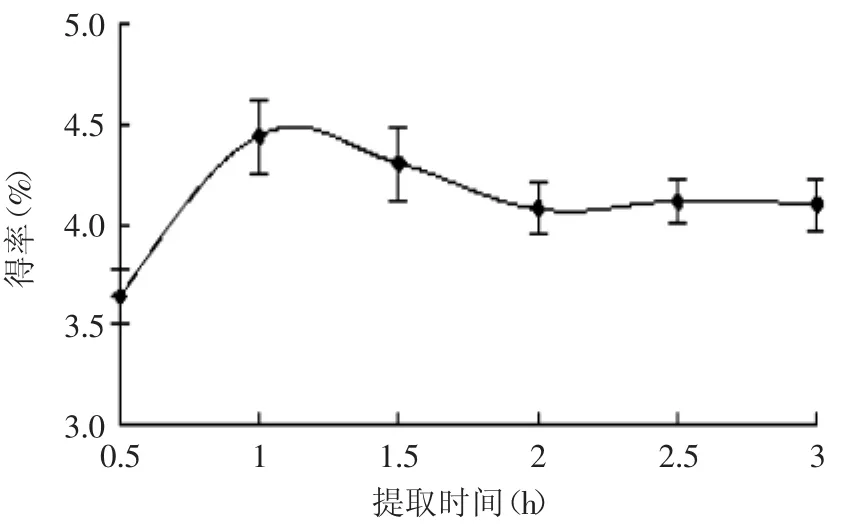
图3 不同提取时间对莲房多酚得率的影响Fig.3 Effectof extraction time on extraction yield
2.2.4料液比对莲房多酚提取效果的影响由图4可见,多酚得率随着料液比加大而增大,当料液比达1∶25时,趋势不再显著,趋于稳定,这可能是因为料液比达到1∶25时,溶剂对多酚的溶解基本达到饱和,考虑到成本,可选1∶25为最佳料液比。
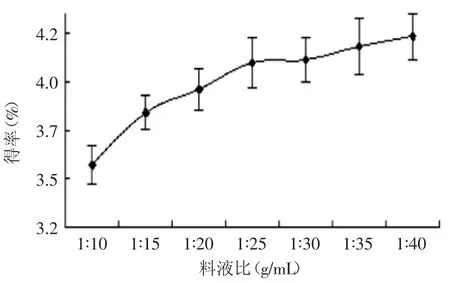
图4 不同料液比对莲房多酚得率的影响Fig.4 Effectof solid-liquid ratio on extraction yield
2.3正交实验结果
根据单因素实验的结果,以乙醇浓度、液料比、提取时间、提取温度四个因素,每个因素取三个水平进行优化。
由表可知,四个因素对莲房多酚物质得率的影响顺序为:乙醇浓度>温度>料液比>时间,由于因素B料液比的第2、3个水平的k值相等,考虑到经济性,故选择B2作为其优水平。因此,最佳提取工艺为A1B2C3D2,即用50%的乙醇,以1∶25的料液比于80℃提取2h,所得莲房多酚的得率最高,为5.23%。
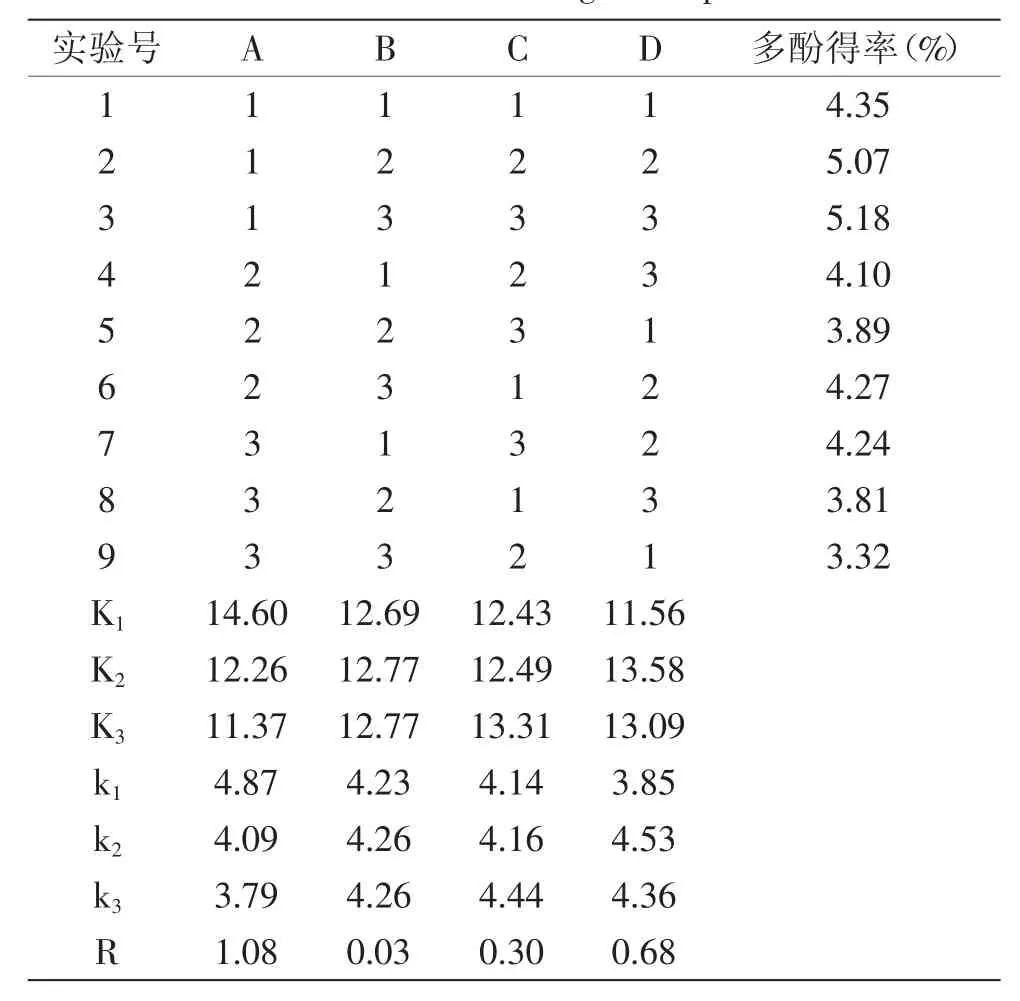
表2 正交实验结果Table 2 Results of orthogonal experiment
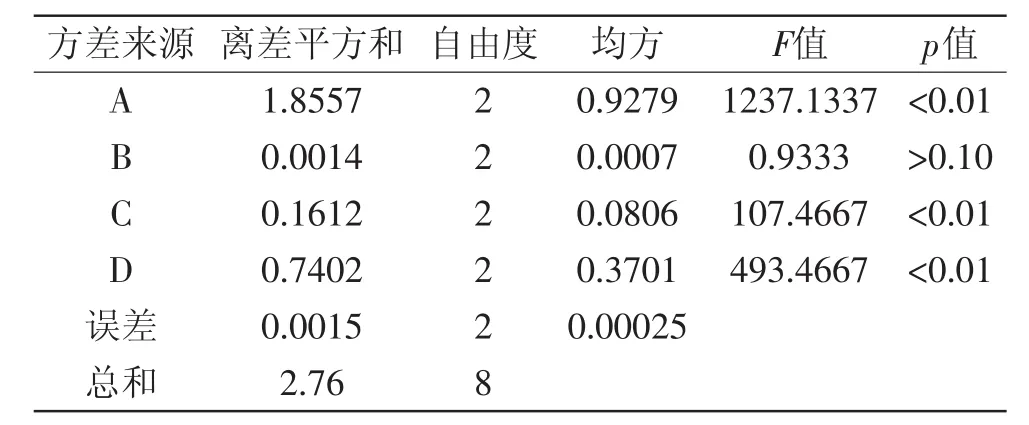
表3 方差分析表Table 3 Analysis of variance
2.4验证实验结果
称取2g莲房多酚,按最佳工艺A1B2C3D2进行提取,进行3次验证实验,实验结果分别为5.19%、5.21%、5.30%,其平均提取率为5.23%,比正交实验中含量最高的一组高出0.05%,表明通过正交实验选择出的最佳提取工艺科学合理,重现性好。
2.5体外抗氧化实验
2.5.1清除DPPH自由基能力如图5所示,莲房多酚(TPNU)可以显著抑制DPPH自由基的产生,且在一定范围内具有量效关系,其IC50=9.03μg/m L,而阳性对照VC的IC50=12.44μg/m L。TPNU清除DPPH自由基能力略大于VC。郑丽鋆等[14]研究了莲房不同溶剂提取物对DPPH自由基的清除作用,其中乙醇提取物的IC50值为12.94μg/m L,分析其造成差异的主要原因可能与不同品种和不同产地的莲房总多酚含量不同有关。
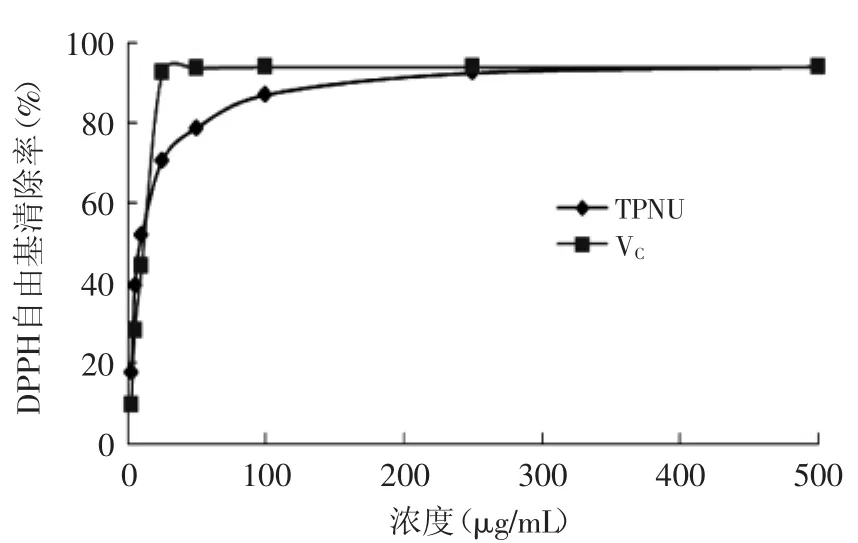
图5 莲房多酚对DPPH自由基的清除能力Fig.5 Capacity of DPPH free radical scavenging by TPNU
2.5.2清除ABTS+自由基的能力如图6所示,TPNU可有效抑制ABTS+自由基的产生,且在一定范围内具有量效关系,其IC50=26.38μg/m L,而阳性对照VC的IC50=17.29μg/m L。TPNU清除ABTS+自由基能力比VC略小,但仍有较强的清除ABTS+自由基的能力。
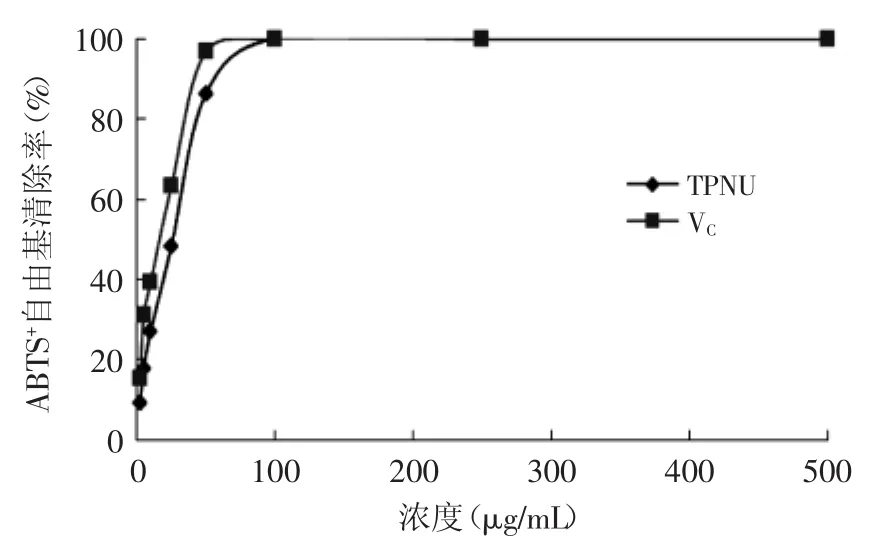
图6 莲房多酚对ABTS+自由基的清除能力Fig.6 Capacity of ABTS+free radical scavenging by TPNU
2.5.3还原力由图7可知,TPNU具有一定的还原力,但比阳性对照VC较小,分别为5.27、9.33μmol/mg。
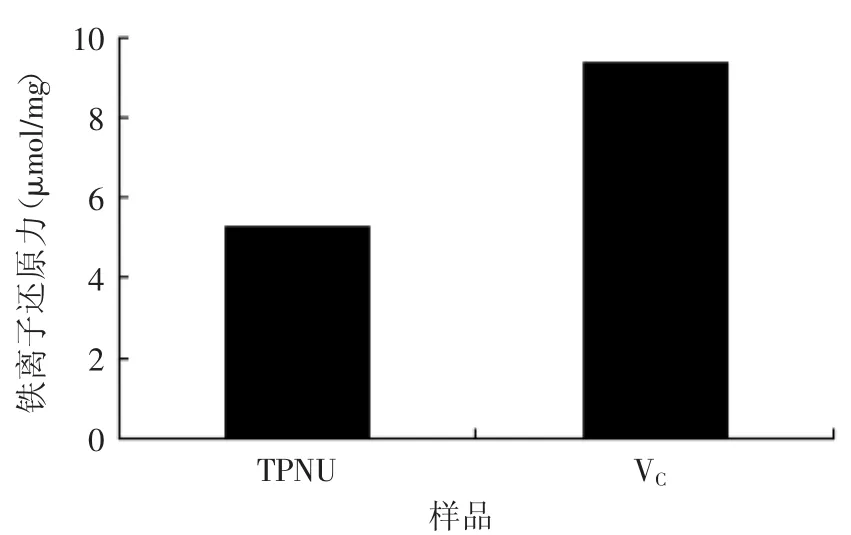
图7 莲房多酚的还原力Fig.7 Reducing power of TPNU
2.5.4清除OH自由基能力OH自由基是已知的最活泼的活性氧自由基,也是毒性最大的氧自由基,会引起脂质过氧化作用及造成生物损伤[15-16]。由图8可知,莲房多酚浓度为100μg/m L时,清除率达到了50%,稍低于VC。
2.5.5亚铁离子螯合活性铁被认为是脂质氧化的重要促进剂。对亚铁离子的螯合,可以保护铁诱导的氧化损伤[17]。由图9可知,莲房多酚对亚铁离子的螯合小于EDTA,但仍具有较强螯合性,浓度为50mg/L时,螯合率达43.2%。
2.5.6对大鼠脑匀浆脂质过氧化的影响由图10可知,莲房多酚对大鼠脑匀浆脂质过氧化抵抗能力与VC相当(最高清除率相等),具有很强的抗脂质过氧化作用。
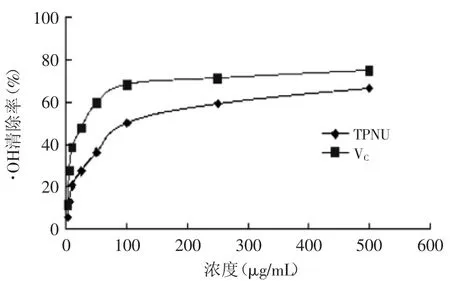
图8 莲房多酚对OH自由基的清除能力Fig.8 Capacity of hydroxy free radical scavenging by TPNU
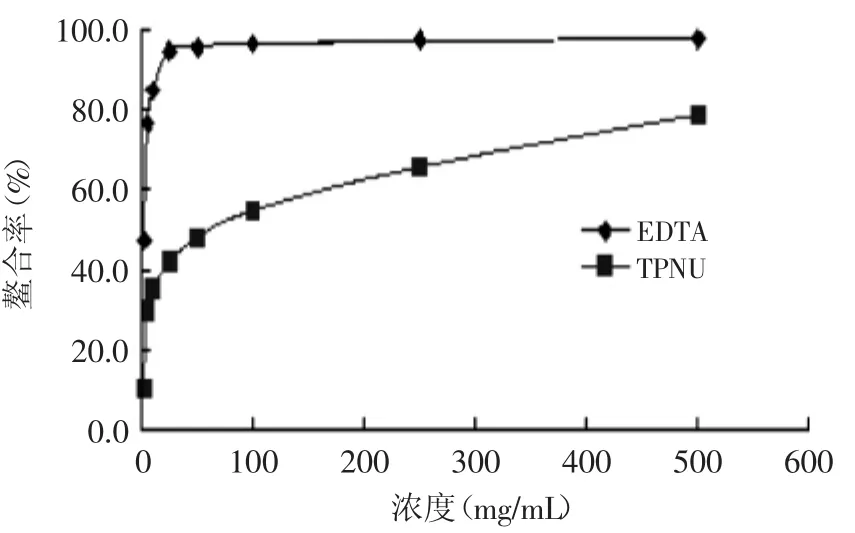
图9 莲房多酚对亚铁离子螯合活性Fig.9 Ferrous ion-chelating capacity by TPNU
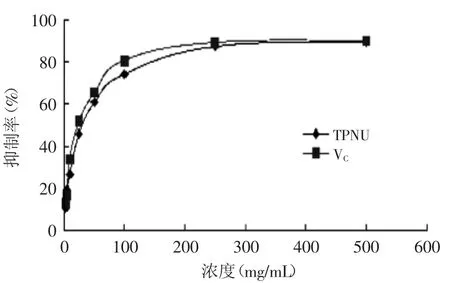
图10 莲房多酚对大鼠脑匀浆脂质过氧化的影响Fig.10 Influence on lipid peroxidation in rats of TPNU
3 结论
在单因素实验的基础上,采用正交实验对莲房多酚提取工艺参数进行优化,水浴回流提取莲房多酚的最佳工艺参数为:乙醇浓度50%,料液比1∶25,提取温度80℃,提取时间为2h,得率最高为5.23%。莲房多酚的体外抗氧化实验表明莲房多酚对DPPH自由基、ABTS+自由基和OH自由基均具有良好清除作用,清除DPPH自由基能力略大于VC,具有很强的抗脂质过氧化作用且具有一定的还原力和亚铁离子螯合活性。表明莲房多酚是一种良好的天然抗氧化剂。本研究为工业化利用丰富的莲房资源提取莲房多酚提供了依据。
[1]廖立,舒展,李笑然,等.莲类药材的化学成分和药理作用研究进展[J].上海中医药杂志,2010,44(12):82-84.
[2]Ling ZQ,Xie BJ,Yang EL.Isolation,characterization,and determination of antioxidative activity of oligomeric procyanidins from the seedpod of Nelumbo nucifera Gaertn[J].Journal of Agricultural and Food Chemistry,2005,53(7):2441-2445.
[3]曹杨,徐虹,王静,等.莲天然产物及其生物活性研究进展[J].食品工业科技,2012,33(8):402-405.
[4]段玉清,闫永胜,张海晖,等.莲房多酚的微波辅助提取技术[J].江苏大学学报,2009,30(5):437-440.
[5]黄素英.莲子多酚提取及其抗氧化抑菌活性研究[D].福州:福建农林大学,2010.
[6]严守雷,王清章,彭光华.莲藕多酚抗氧化作用研究[J].中国粮油学报,2005,20(4):77-81.
[7]郑丽鋆,吴岩斌,王亚贤,等.莲房多酚的超声提取工艺研究[J].福建中医药大学学报,2011,21(3):39-41.
[8]邵芳芳,尹卫平,梁菊.重要的植物多酚及其抗氧化性能的研究概况[J].西北药学杂志,2010,25(1):66-68.
[9]刘琼,夏道宗,叶晓萍,等.安吉白茶含片的制作及其抗氧化活性评价[J].食品工业科技,2012,33(18):245-252.
[10]夏道宗,陈佳,邹庄丹,等.马齿苋、车前草复合保健饮料的研制及其抗氧化活性评价[J].食品科学,2009,30(4):118-122.
[11]郑小薇,夏道宗,张英,等.梅花总黄酮对黄嘌呤氧化镁的抑制作用及其抗氧化活性评价[J].食品工业科技,2011,32(11):168-170,173.
[12]Xia DZ,Yu XH,Zhu ZY,et al.Antioxidantand antibacterial activity of six edible wild plant(Sonchus spp.)in China[J]. Natural Product Research,2011,25(20):1893-1901.
[13]夏道宗,励建荣,刘杰尔,等.高良姜总黄酮的超声萃取及其体外抗氧化作用研究[J].中国食品学报,2009,9(3):63-68.
[14]郑丽銮,吴岩斌,吴建国,等.莲房不同溶剂提取物对DPPH自由基的清除作用[J].福建中医药,2012,43(1):54-56.
[15]Sasaki S,Ohta T,Decker EA.Antioxidant activity of watersoluble fractions of salmon spermary tissue[J].Journal of Agricultural and Food Chemistry,1996,44(7):1682-1686.
[16]Aurand LW,Boone NH,Giddings GG.Superoxide and singlet oxygen in milk lipid peroxidation[J].Journal of Dairy Science,1977,60(3):363-369.
[17]Kehrer JP.The Haber-Weiss reaction and mechanisms of toxicity[J].Toxicology,2000,149(1):43-50.
Study on the extraction and antioxidant activity of total phenolic com pounds from the seedpod of Nelumbo Nucifera Gaertn
ZHONG Yi-ping,XIA Dao-zong*,HUANG Lan,WANG Si-wei,FANG Yue-juan
(College of Pharmaceutical Sciences,Zhejiang Chinese Medical University,Hangzhou 310053,China)
The extraction technology of total phenolic com pounds from the seedpod of Nelumbo nucifera Gaertn(TPNU)was studied by sing le-fac tor experiments and orthogonal test design.Furthermore,the antioxidant activities of TPNU were evaluated,using various antioxidant assays inc luded the scavenging on DPPH,ABTS+,OH free rad icals,reducing power determ ination,ferrous ion-chelating capacity and influence on lip id peroxidation in rats.The results showed that the op timum extrac tion cond itions were determ ined by orthogonal experiment as follows:ethanol concentration 50%,solid-liquid ratio 1∶25,extraction tem perature 80℃ and extraction time 2h,and the extrac tion yield was 5.23%in these conditions.TPNU had strong scavenging activity on DPPH,ABTS+and OH free rad icals,also had strong reducing power and ferrous ion-chelating capacity.In addition,TPNU could significantly inhibit the b rain lipid peroxidation in rats.These findings showed that TPNU had strong antioxidantactivity under the op timalextraction technology.
seedpod of Nelumbo nucifera Gaertn;totalphenolic com pounds;extraction;antioxidantactivity
TS201.1
B
1002-0306(2015)06-0235-05
10.13386/j.issn1002-0306.2015.06.044
2014-07-07
钟怡平(1992-),女,本科,研究方向:功能性食品。
夏道宗(1978-),男,博士,副教授,研究方向:天然产物与功能性食品。
国家自然科学基金(81374048,81102861);国家级大学生创新创业训练计划项目暨浙江省新苗人才计划(2013R410018,2014R410003)。

