盐酸川芎嗪与牛血清白蛋白相互作用的研究及共存金属离子的影响
刘里,成飞翔
(曲靖师范学院化学化工学院,云南 曲靖 655011)
血清白蛋白是一类重要的运输性蛋白,在生物体内的循环系统中含量非常丰富,几乎占血清蛋白的60%[1].近年来采用光谱研究药物与血清白蛋白的相互作用已成为生命科学、化学、药学和临床医学领域的研究热点,这对于了解生命过程、药物作用机制及药物分子设计等都具有重要作用[1-3].因结构上和人血清白蛋白(简称HSA)的相似性,牛血清白蛋白(简称BSA)被广泛地运用于与药物结合作用的研究[1].盐酸川芎嗪(ligustrazine hydrochloride,简称LH),是传统的活血化淤中药里的代表药材川芎中的主要活性成分,是治疗用于缺血性脑血管疾病(如脑供血不足、脑血栓形成、脑栓塞)的常用药[4-6].马贵斌等[5]和张爱平等[6]研究了LH与HSA的相互作用,但主要集中在在两个温度下猝灭机理的判断和热力学研究上.而本文在优化的条件下,从更多的方面系统地研究了3个不同温度时LH与BSA的结合反应,除了作用机理的研究,还详细地探讨了两者的结合位点、结合部位、相互作用力类型、药物之间的协同性、对蛋白质构象的影响以及金属离子对LH与BSA结合反应的影响.这些研究对于阐明LH在机体内的传输、代谢过程及药理作用具有参考意义.
1 实验部分
1.1 仪器与试剂荧光光谱仪:F-4600,日本日立公司,狭缝宽度10.0 nm,光电倍增管负电压为400 V;紫外-可见光谱仪:Cary 50型,美国瓦里安技术中国有限公司;精密酸度计:pHS-3C,上海虹益仪器仪表有限公司.牛血清白蛋白:上海楷样生物技术有限公司,配制1.0×10-5mol/L的溶液;盐酸川芎嗪:98%,阿拉丁®上海晶纯生化科技股份有限公司,配制1.916 7×10-3mol·L-1的溶液;其他试剂都为分析纯,实验用水为超纯水.
1.2 实验方法依次加入2.0mL,pH=7.4,0.01mol·L-1的Tris-HCl缓冲溶液,1.5mL牛血清白蛋白标准溶液(1.0×10-5mol·L-1),2.0mLNaCl溶液(0.5mol·L-1)和不同体积的1.9167× 10-3mol·L-1的LH溶液于10 mL比色管中,稀释到刻度,混合均匀,在荧光仪上以最大激发波长λex=280 nm光激发得到荧光发射光谱,最大发射波长λem在340 nm处.LH-BSA体系中加入0.5mL1.0×10-3mol·L-1金属离子溶液,其他条件同上,测量荧光光谱.扫描同步荧光光谱(Δλ=15 nm和60 nm)记录LH不存在时体系的荧光强度F0和与LH存在时体系的荧光强度F.测定物质的摩尔浓度比为1∶1的BSA与LH溶液的紫外吸收光谱.
2 结果与讨论
2.1 反应条件的优化分别考察缓冲溶液种类、pH值、缓冲溶液的用量、BSA的浓度以及试剂加入顺序对体系的荧光强度的影响,结果表明,实验选用pH=7.40的Tris-HCl缓冲溶液2.0mL调节酸度,1.5×10-6mol/LBSA作为反应浓度,LH→BSA→NaCl→Tris-HCl的加入顺序时最佳,因此实验按照优化出来的结果进行实验测量.
2.2 猝灭光谱BSA分子中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基能够吸收270~300 nm的紫外光而发出荧光[4].图1是固定BSA浓度,增加LH量的猝灭光谱图.图1中BSA峰形无明显变化,强度却明显降低,λem略向蓝移,说明LH对BSA的荧光有猝灭作用.

图1 LH对BSA的猝灭光谱

图2 3个不同温度下的S-V图
2.3 猝灭方式的研究
2.3.1 温度对猝灭的影响 为了确认LH对BSA的猝灭机理,实验用S-V公式[5-6]:F0/F=1+KSV[C]=1+Kqτ0[C]对不同温度下荧光实验数据进行了分析.式中KSV为猝灭常数;Kq为表观速率常数,τ0为荧光体平均寿命,一般为10-8s数量级[5-6],[C]为LH的浓度.按照实验方法在297 K,312 K和327 K时以F0/F对[C]作图(如图2所示),并根据公式算出3个温度下的KSV和Kq列于表1.表中所有温度下的Kq值比动态猝灭最大速率常数大两个数量级,说明LH对BSA的猝灭不属于动态猝灭.由图2可知,3个温度下的S-V曲线均呈良好的线性关系,且随着温度的升高,直线斜率即Ksv减小,正好与静态猝灭机理相吻合.与文献[5-6]报道的LH与HSA猝灭机理一样,文献中Ksv值也是104数量级.
若LH对BSA为静态猝灭,应符合L-B方程[7-9]:(F0-F)-1=F0-1+(KLBF0[C])-1式中KLB为静态猝灭结合常数.(F0-F)-1-[C]-1作不同温度下的L-B曲线,结果见表2.从表2可以看出,3个温度下的相关系数都达到0.99以上,线性关系良好,其KLB值都在103数量级,表明LH与BSA由于发生静态猝灭而结合力较强.以往文献中讨论较少.

表1 不同温度下LH-BSA的S-V方程及相关系数

表2 L-B线性回归方程的相关参数
2.3.2 紫外吸收光谱 另一判断猝灭机理的方法是对比药品加入前后荧光体吸收光谱的变化,动态猝灭仅仅影响荧光体的激发态而不影响荧光体的吸收光谱,而静态猝灭时基态配合物的形成会引起荧光体吸收光谱的变化[5-9].图2中BSA在210 nm附近有一个强吸收(曲线b),LH在此期间内几乎无吸收(曲线a).曲线c和曲线d几乎重合(见图3),表明LH并没有改变BSA的紫外吸收光谱,与前面LH对BSA的猝灭是静态猝灭过程的判断相一致.

图2 LH、BSA的紫外吸收光谱a、b分别为LH、BSA的吸收曲线

图3 LH-BSA混合液的紫外吸收光谱c:LH-BSA混合液的吸收曲线,d:LH吸收曲线与BSA吸收曲线的叠加
2.4 结合常数Kb和结合位点数n如药物小分子与生物大分子存在n个等同且独立的结合位点,它们之间相互作用关系符合Langmuir公式:lg[(F0-F)/F]=lgKb+nlg[C][7-9].由lg[(F0-F)/F]对lg[C]作图,由直线截距可得结合常数Kb,斜率可求n,计算结果见表3.
由表3可看出:297 K,n≈1,表明LH与BSA可形成1个结合位点;312 K、327 K是n≈2,可形成2个结合位点,总体趋势来看Kb也随温度升高而增加.从n和Kb的变化来看,温度的变化对结合影响较大;n和Kb值都较大,温度的提升有利于血清白蛋白携带着LH在体内进行运转、贮存和分配.与文献[5]中报道的298K和308 K时n分别为1.06和1.05值相近.

表3 LH-BSA的K b和n
2.5 热力学参数及作用力类型当温度相差不大时,可以把焓变看成一个常数,由不同温度下的Kb,可根据热力学方程[7-9]算出反应焓变ΔH、自由能ΔG和熵变ΔS,计算结果见表4.由表4可知,LH与BSA的热力学参数ΔG<0,ΔH>0,ΔS>0表明LH与BSA为自发的,吸热反应.根据Ross等[10]总结出的规律推测,LH与BSA主要以疏水作用力相结合,与文献[5]中报道的LH与HSA结合力类型相符.

表4 LH对BSA作用在不同温度下的热力学参数值
2.6 结合位置的确定大多数药物在BSA上结合部位为亚螺旋域ⅡA(含有酪氨酸和色氨酸)和亚螺旋域ⅢA(含有酪氨酸).为确定LH与BSA结合的具体位置采用对比λex=280 nm和λex=295 nm时的荧光光谱的方法[11-14].由图4可知,两种激发波长下,LH与BSA的猝灭曲线是独立的,而且猝灭程度是λem=280 nm时比λem=295 nm时的大,这一现象说明在LH与BSA的猝灭反应中,色氨酸和酪氨酸残基都参与其中.进而可以确定,LH与BSA的结合位置主要位于亚螺旋域ⅡA.以往文献中少见讨论LH与HSA结合位置.

图4 λex为280 nm和295 nm时LH-BSA的荧光光谱
2.7 药物协同作用BSA具有多重结合部位,药物与BSA结合时,BSA各结合部位之间存在相互影响作用,这种相互影响作用称为药物的协同作用[11-14],可用Hill方程[11-14]进行分析:lgD/(1-D)=lgK+nHlg[C],式中,D为结合饱和分数,K为结合常数,nH为Hill系数.在荧光实验中:D/(1-D)=B/(Bm-B),其中,B=(F0-F)/F0;1/Bm是1/B对1/[C]作图的截距.CS-BSA的nH值的计算结果见表5.表5表明,药物协同性对温度变化不是很敏感,3个温度下的nH都略小于1,说明LH与BSA结合过程中,LH分子之间呈现出弱的负协同作用,即前一个药物分子结合到BSA位点上后,阻碍了后一个药物分子与BSA的结合.以往文献中少见讨论LH与HSA药物协同作用.

表5 3个温度下体系的Hill系数n H(λ=280 nm)
2.8 LH对BSA构象的影响BSA的构象变化通常用同步荧光光谱来分析,根据λem的变化来确定[8-10]其荧光猝灭主要由何种氨基酸残基起主导作用,而且氨基酸残基的λem移动方向与其所处的疏水性也密切相关[8-10].酪氨酸残基的特征荧光由Δλ=15 nm时测得的同步荧光光谱显示;色氨酸残基的特征荧光由Δλ=60 nm测得的同步荧光光谱显示[8-10].在Δλ=15 nm和Δλ=60 nm条件下,测定LH加入BSA之后的同步荧光光谱(见图5).由图可知,两种氨基酸残基的荧光强度都随LH的不断加入而逐渐降低,λem明显向紫移,说明LH的加入改变了BSA的构象,使其色氨酸和酪氨酸残基的疏水结构变小,导致肽链的伸展程度减弱,使得BSA腔内疏水环境的极性减弱,疏水性增强[8-10].并且酪氨酸移动得更明显,猝灭程度也更大说明LH与BSA的结合位点更加接近于酪氨酸残基.LH也改变了HSA的构象[5],但具体结合位点更靠近哪个残基未予讨论.
2.9 金属离子的影响人体内存在着的金属离子会参与生命过程,这些金属元素不仅与蛋白质有较强的结合力,而且与药物也有一定的作用,金属元素的存在会直接影响到药物与蛋白质的结合已有报道[14-15].本文中考察Mg2+、Cu2+、Zn2+、Ni2+、Fe3+对LH-BSA体系Kb和n的影响,结果见表6.从表6中可明显看出,金属离子不同,Kb′和n也不同,其原因可能是金属元素本身的原子结构不同导致与BSA的结合力和结合位点的差异.除了Mg2+以外,其他4种离子加入后,Kb和n都增加了,即金属离子对药物与蛋白质的作用产生了促进作用,其中Cu2+对结合体系的影响最大.原因可能是LH与BSA结合时,金属离子是通过桥联作用或形成“离子架桥”[14-15]方式参与其中的,即金属离子先与LH结合,然后再与BSA结合,这种结合促进了LH与BSA的结合能力.Cu2+、Zn2+、Ni2+、Fe3+的加入会使LH与BSA的结合作用增大,有利于延长药物的释放时间,延长了药效时间.Mg2+的加入与其他4种离子所产生的效果相反,减小了原本的Kb和n值,说明Mg2+对LH与BSA结合产生了竞争作用,可能是Mg2+与BSA先结合,占据了BSA的结合位点,从而抑制了BSA与药物的结合作用,说明Mg2+对LH与BSA结合产生了竞争作用,抑制了BSA与药物的结合作用,缩短了LH在血液中的停留时间.LH与HSA在Mg2+存在时Kb也减小,Zn2+和Cu2+存在时Kb也增大,与本研究结果一致.
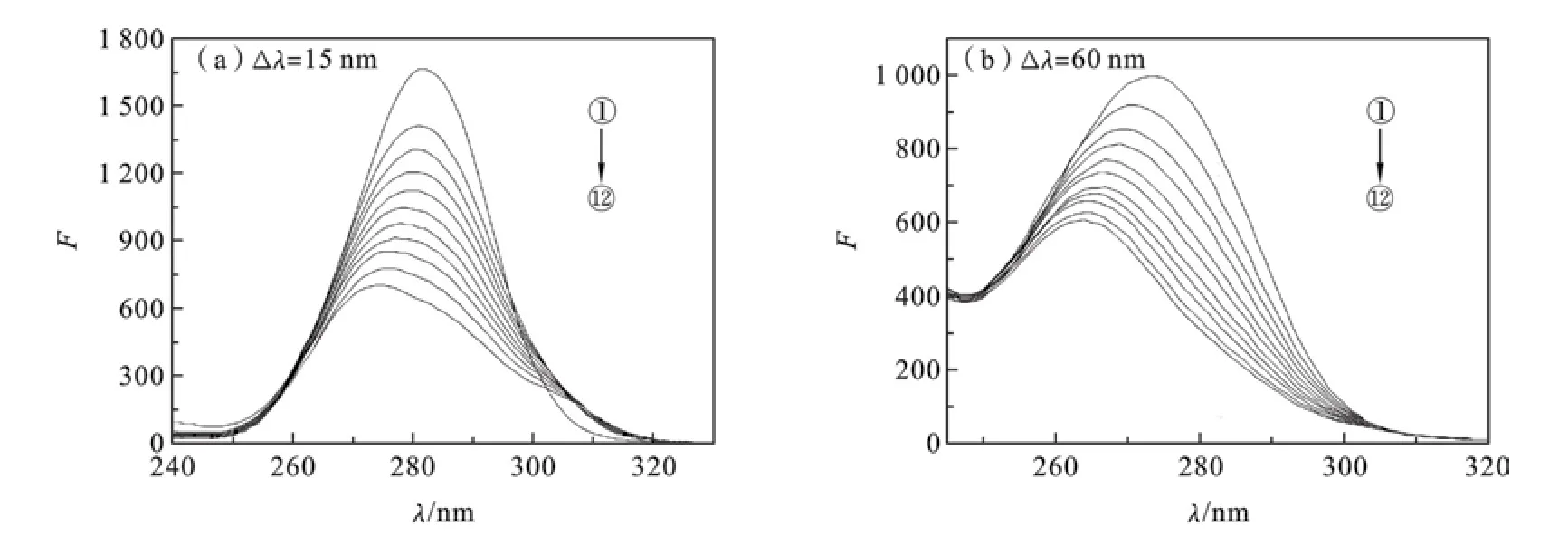
图5 LH与BSA的同步荧光光谱图
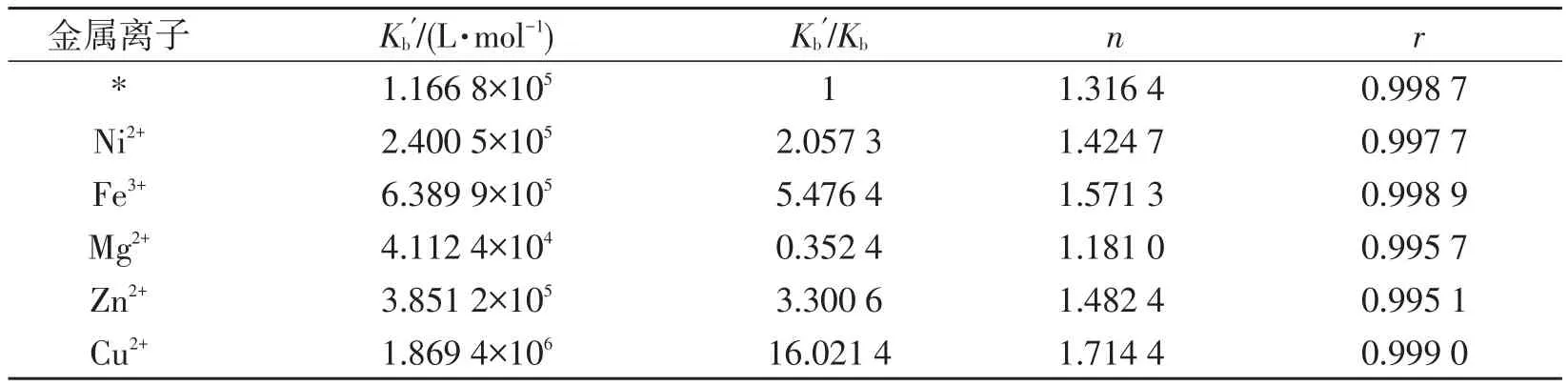
表6 不同金属离子的影响
3 结论
用光谱法推断出LH对BSA荧光产生静态猝灭,两者靠疏水作用力相结合;通过计算求得了Kb和n值的大小,表明LH可以被BSA运输;两者结合位置位于BSA的亚螺旋域ⅡA中;在LH与BSA结合过程中,药物分子之间有弱的负协同性;LH的存在诱导BSA的构象发生了一定程度的变化,结合位点更加接近于酪氨酸残基;详细研究了Mg2+、Cu2+、Zn2+、Ni2+、Fe3+对LH与BSA相互作用的影响.
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2012:678.
[2]薛春霞,董社英.药物分子与血清白蛋白相互作用的研究进展[J].广东化工,2013,40(262):148-149.
[3]王芳,裴明砚,唐乾,等.药物与血清白蛋白相互作用中荧光光谱学的研究进展[J].大连大学学报,2009,3(3):39-43.
[4]汪世龙.蛋白质化学[M],上海:同济大学出版社,2012,139.
[5]马贵斌,高飞,任斌知,等.荧光法研究药物分子与人血清白蛋白的结合作用[J].化学学报,1995,53:1193-1197.
[6]张爱平,杨锦艳,王丽,等.川芎嗪与人血清白蛋白相互作用的热力学研究[J].中西医结合心脑血管病杂志,2010,8(8):965-968.
[5]Lakowicz JR.Principles of fluorescence spectroscopy[M].3rd.New York:Springer Press,2006:280.
[6]许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006:42-60.
[7]刘里,彭洪生,伏云红.荧光光谱法研究头孢孟多酯与牛血清白蛋白的相互作用[J].中国测试,2014,40(3):64-67.
[8]殷磊,刘里,何志钊,等.荧光光谱法研究头孢硫脒与牛血清白蛋白的相互作用[J].安徽农学通报,2012,18(19):14-17.
[9]刘里.光谱法研究马来酸氯苯那敏与牛血清白蛋白的相互作用[J].西北师范大学学报:自然科学版,2014,50(5):44-47,53.
[10]Ross DP,Subramantan S.The rmodynamicsof protein association reactions:forcrs cont ributing to stability[J].Biochemstry,1981,20(11):3096-3102.
[11]刘保生,杨超,王晶,等,硫酸头孢匹罗与牛血清白蛋白结合反应的发光机理[J].发光学报.2011,32(3):295-296.
[12]Sulkowska A,Maciazek-Jurczyk M,Bojko B,etal.Competitive binding of phenylbutazone and colchicine to serum albumin inmultidrug therapy[J].JMol Struct,2008,881(1-3):97-106.
[13]Bojko B,Sułkowska A,Maciaz˙ek-Jurczyk M,et al.The influence of dietary habits and pathological conditions on the binding of theophylline to bovine serum albumin[J].Journal of Pharmaceutical and Biomedical Analysis,2009,52(3):384-390.
[14]刘保生,杨超,王晶,等.头孢匹胺钠与牛血清白蛋白相互作用机理及共存金属离子的影响[J].发光学报,2012,33(9):1021.
[15]刘丽虹,方光荣,宋功武.铜离子存在下依诺沙星与牛血清白蛋白的相互作用研究[J].湖北大学学报:自然科学版,2004,26(2):131-133.

