巯基化壳聚糖包覆CdS量子点荧光猝灭法测定环境水样中的Hg2+
赵亚菲, 黄正喜, 李春涯, 张慧娟
(中南民族大学化学与材料化学学院,湖北武汉 430074)
环境中的汞对生态系统和人体健康危害极大,即使在低浓度时其对微生物和人类也会产生极大的伤害[1]。相较于经典的汞分析方法对仪器需求较高,或者需要繁琐的衍生前处理等缺点[2 - 4],基于量子点(QDs)技术而建立的荧光光度法测定Hg2+以其高灵敏度、操作简便等优点受到广泛关注[5 - 8]。而水溶性量子点具有制备过程简便、重复性好、表面性质易于修饰等优点,已经成为当前研究的热点[9]。制备水溶性量子点一般采用巯基乙酸、巯基丙酸及巯基乙胺等水溶性巯基化试剂作为稳定剂,通过包覆量子点增强其光学稳定性,但是这类巯基化稳定剂都具有较大毒性不利于在生命医学领域应用,因此发展低毒性稳定剂制备水溶性量子点尤为重要[10]。壳聚糖(CTS)及其衍生物一直以生物相容性好、生物可降解性好、安全性高等独特性能,在生物材料、药物缓释和环境治理等领域的应用中取得了重要进展[11,12]。
目前用壳聚糖及其衍生物直接一步法制备水溶性量子点的报道很少,大多采用的是对已合成好的水溶性量子点进行壳聚糖修饰,对于降低量子点的毒性有限[13]。Mansur等人报道了壳聚糖及壳聚糖季铵盐衍生物一步法合成了壳聚糖包覆CdS QDs,但未应用于分析测定[14]。壳聚糖上的氨基和羟基对于很多金属离子都具有配位能力,可能导致制备的水溶性量子点容易受到其他离子干扰,选择性不强,而巯基对于某些金属离子特别是汞具有较强的亲和能力可提高水溶性量子点的选择性和抗干扰性[15,16]。本文采用3-巯基丙酸对壳聚糖进行巯基化改性,将壳聚糖与巯基化稳定剂的优点相结合,制备出壳聚糖巯基化稳定剂,进而采用一步法合成出低毒性具有选择性的巯基化壳聚糖包覆水溶性CdS QDs,并考察所制备量子点的光学性质,建立了荧光猝灭法测定环境水样中的Hg2+。
1 实验部分
1.1 仪器与试剂
NEXUS 470 型智能傅立叶红外光谱仪(美国,Nicolet 公司);VERTEX 70拉曼光谱仪,Bruker D8 X 射线衍射仪(德国,布鲁克公司);FEI Tecnai G20透射电子显微镜(美国,FEI公司);INESA 970CRT荧光分光光度计(上海仪电分析仪器有限公司)。
3-巯基丙酸(99%,J&K CHEMICAL);壳聚糖(脱乙酰度,80%~95%),N,N′-二环己基碳二亚胺(DCC,98%),4-二甲氨基吡啶(DMAP,98%),CdCl2·2.5H2O(> 99%),Na2S·9H2O(> 98%),均购自国药集团化学试剂公司。实验用水为二次蒸馏水。
1.2 实验方法
1.2.1巯基化壳聚糖的合成巯基化壳聚糖的制备过程参照文献报道的方法[17]并做改进。将壳聚糖和3-巯基丙酸混合于二氯甲烷中。随后依次加入DCC和DMAP,搅拌均匀,室温反应24 h。反应结束后,将反应溶液过滤并用少量的DCM和DMF分别洗涤3次后得到白色固体,然后将白色固体溶解在1%乙酸水溶液中,离心后取上清液用丙酮沉淀,得到浅黄色絮状产物,产物在真空干燥箱中60 ℃下干燥5 h。
1.2.2巯基化壳聚糖包覆CdS量子点的合成将制备的巯基化壳聚糖与CdCl2加入圆底烧瓶中,用一定量的水溶解。用冰乙酸将反应溶液的pH调节为3.0,然后将Na2S溶液迅速加入烧瓶中,氮气保护下50 ℃搅拌反应2 h。反应结束后将反应液用无水乙醇沉淀得到CdS QDs。产物用无水乙醇洗涤三次后在真空干燥箱中60 ℃下干燥2 h。
1.2.3测定方法在10 mL容量瓶中依次加入pH值2.0的0.2 mol/L磷酸盐缓冲溶液, 一定量的Hg2+标准溶液和CdS QDs储备液,用水定容,摇匀,在室温下放置20 min,在荧光分光光度计上,在激发/发射波长为350/470 nm处,测量溶液的荧光强度。狭缝宽度为10 nm。
2 结果与讨论
2.1 巯基化壳聚糖及其包覆CdS QDs的表征
图1和图2分别为壳聚糖和巯基化壳聚糖的红外光谱图和拉曼光谱图。由图1可见,与壳聚糖的红外光谱图相比,巯基化壳聚糖1 596 cm-1处的-NH2弯曲振动吸收峰消失,巯基化壳聚糖的红外光谱图中1 634 cm-1、1 530 cm-1都出现一吸收峰,应为酰胺Ⅰ带和酰胺Ⅱ带,可判断巯基化壳聚糖中生成了酰胺键。由图2可看出,与壳聚糖的拉曼光谱相比,巯基化壳聚糖的拉曼光谱中-NH2的伸缩振动峰3 300 cm-1和弯曲振动峰1 592 cm-1消失,在2 600 cm-1出现了-SH的伸缩振动峰,这是因为巯基丙酸的羧基与壳聚糖的氨基发生了酰胺化反应,说明该方法实现了对壳聚糖的巯基化修饰。

图1 壳聚糖(a)和巯基化壳聚糖(b)的红外光谱图
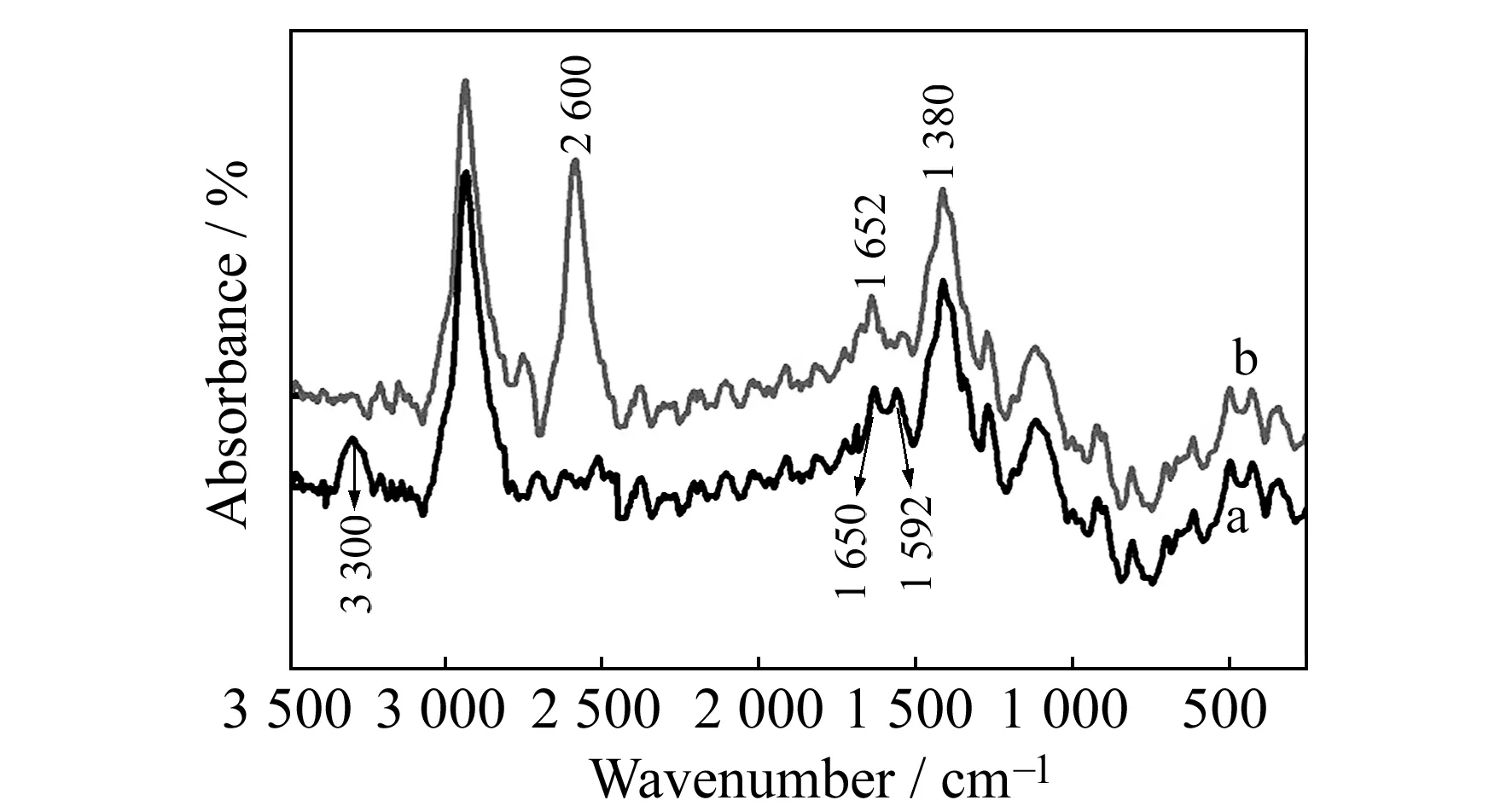
图2 壳聚糖(a)和巯基化壳聚糖(b)的拉曼光谱图
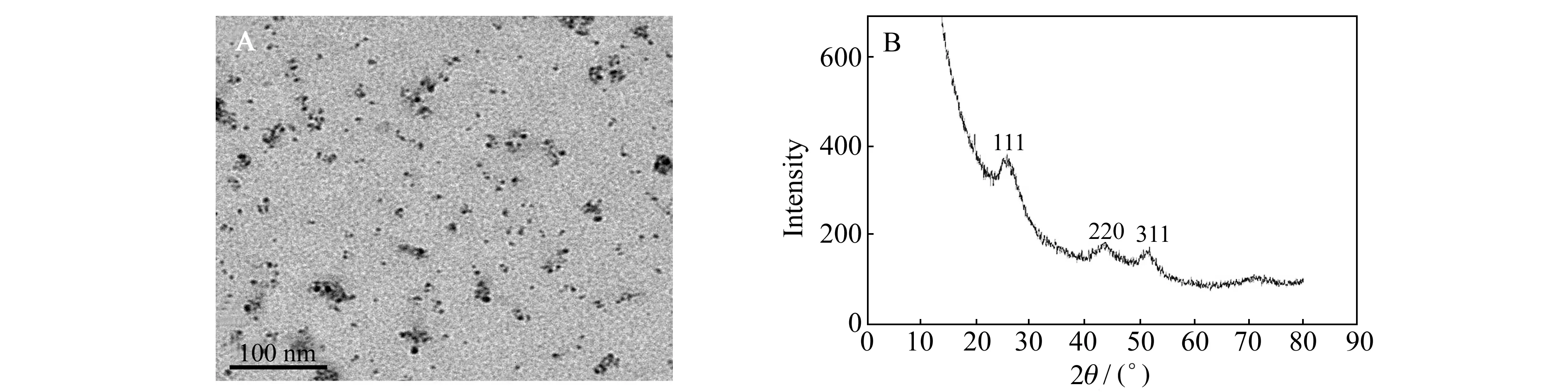
图3 巯基化壳聚糖包覆CdS QDs的透射电镜(TEM)图(A)和X射线衍射(XRD)图(B)
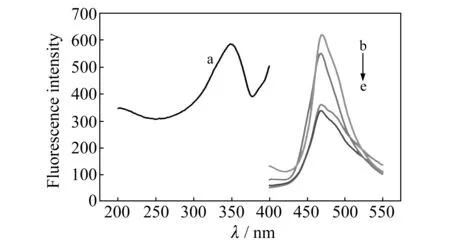
图4 巯基化壳聚糖包覆CdS 量子点的荧光光谱图
利用透射电子显微镜(TEM)对制备的量子点形貌进行了表征,见图3A。TEM图像显示,量子点粒径分布较均匀,大小在3~5 nm之间。巯基化壳聚糖包覆CdS QDs的X射线衍射图如图3B所示。图中出现了三个明显的峰,分别是 26.7°、44.1°and 51.7°,与CdS XRD标准JCPDS卡对比发现这三个峰与CdS 晶体的晶面111、220 和 311的峰位置基本重合,晶体粒径由 Debye-Scherrer’s公式:D=0.89λ/βcosθ(其中D是纳米颗粒的直径,λ是X射线的波长,β是半高宽,θ是衍射角)计算得出。经计算得出CdS QDs 的粒径为3 nm,与TEM表征结果相吻合。
2.2 巯基化壳聚糖包覆CdS量子点光学性质的考察
巯基化壳聚糖包覆CdS QDs在200~400 nm激发波长下,都能被激发,如图4所示。发射的荧光波长都在470 nm处,且当激发波长为350 nm时荧光强度最大,峰形最对称。由此说明制备的巯基化壳聚糖包覆CdS QDs的荧光激发波长范围宽而且连续,其荧光发射峰峰形对称,半峰宽较窄,荧光强度高。后续实验都在激发波长为350 nm和发射波长在470 nm的条件下进行。
2.3 荧光反应条件的选择
考察了pH对巯基化壳聚糖包覆CdS QDs荧光强度的影响。由图5A可见,在pH=1~6的范围内,荧光强度的变化不大,比较稳定,但是当pH>6后,荧光强度降低,量子点开始发生沉降。由图5B中可以看出,当pH值为1~2时,Hg2+对巯基化壳聚糖包覆CdS QDs的荧光猝灭幅度最大且稳定,故后续定量检测Hg2+时选择溶液pH值为2.0。
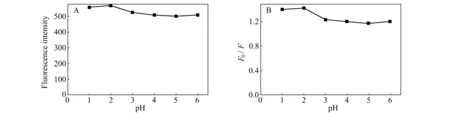
图5 pH对巯基化壳聚糖包覆CdS QDs的荧光强度(A)及Hg2+荧光猝灭效应(B)的影响
同时考察了CdS QDs浓度对荧光反应的影响。在一定浓度范围内,荧光强度随着量子点浓度的增加而增大,但量子点浓度过大时,由于荧光的自猝灭现象,会导致荧光强度降低。经过考察发现,制备的量子点浓度为0.24 g/L时,Hg2+对量子点的荧光猝灭程度最大。所以在定量检测Hg2+时,巯基化壳聚糖包覆CdS量子点的浓度选为0.24 g/L。
2.4 共存离子的影响
将5.0×10-7mol/L Hg2+和共存离子按表1所示浓度混合均匀后,加入巯基化壳聚糖包覆CdS QDs溶液中,共存离子存在下巯基化壳聚糖包覆CdS QDs的荧光强度变化如表1所示。对加入5.0×10-7mol/L Hg2+的巯基化壳聚糖包覆CdS QDs溶液(0.24 g/L)9次重复测定得到的相对标准偏差为3.4%,所以共存离子引起的误差不超过3.4%,对本实验不产生干扰。

表1 共存离子对Hg2+测定的影响
(续表1)
3 方法评价及应用
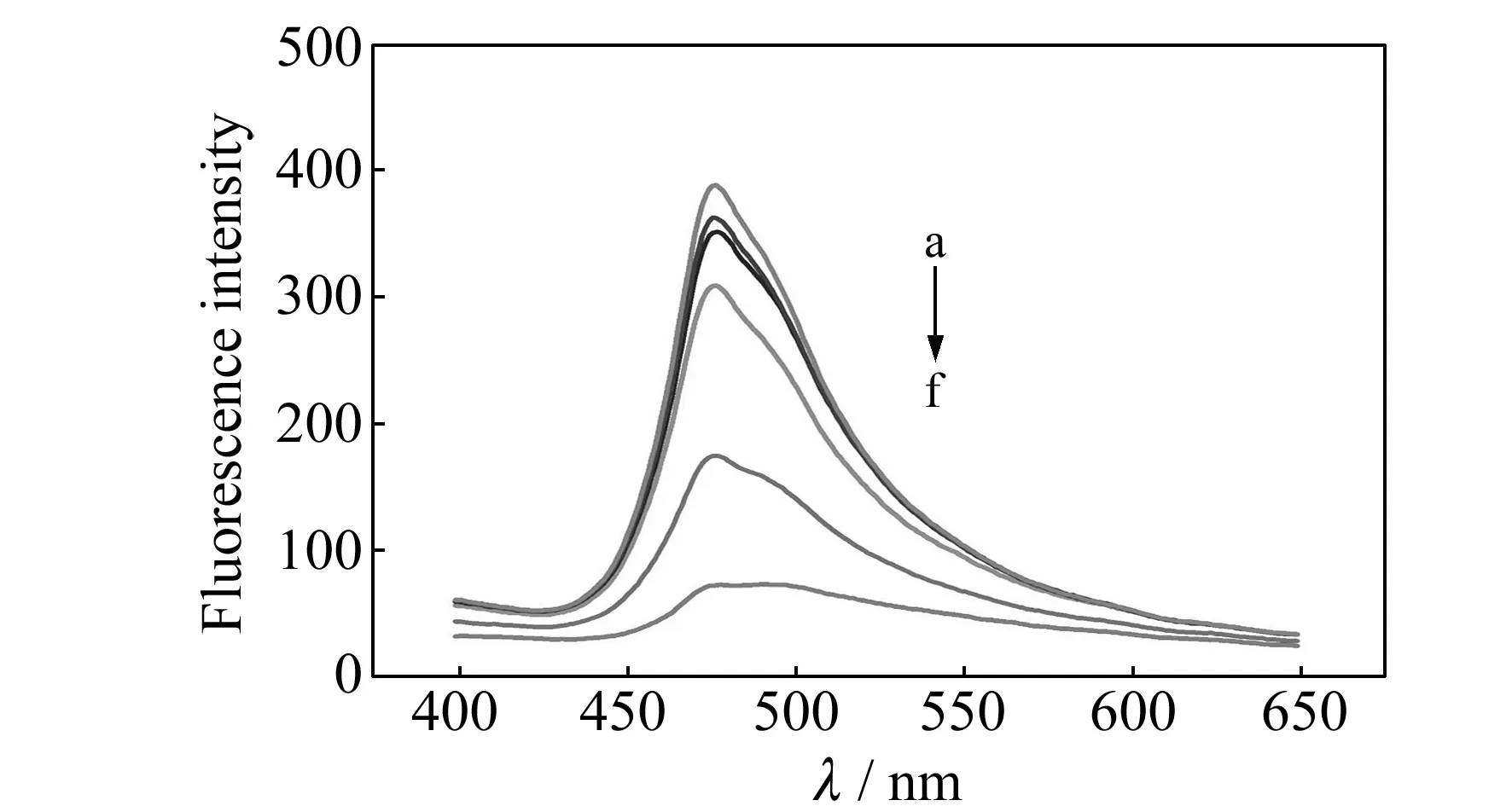
图6 Hg2+浓度变化对巯基化壳聚糖包覆CdS QDs的荧光影响
巯基化壳聚糖包覆CdS QDs荧光强度的减弱程度与Hg2+浓度的关系如图6所示,符合Stern-Volmer方程,即F0/F=9.9×104[S]+1.2,其中F0和F是未加入Hg2+和加入Hg2+时的量子点荧光强度,[S]是Hg2+浓度。在最佳条件下,线性范围为3.0×10-7~5.0×10-5mol/L,线性相关系数R=0.996。在信噪比为3的条件下检出限为5.3×10-8mol/L。由于量子点与Hg2+发生荧光猝灭过程中荧光发射波长没有发生明显的移动,而随着Hg2+浓度的增加荧光发射波长均在 470 nm处,因此该体系的荧光猝灭现象可能是量子点和Hg2+发生了有效电子转移,Hg2+的存在促进了导带中激态电子与价带中空穴的非辐射重组,从而导致量子点的荧光猝灭[18]。
方法的日内及日间精密度在5.0×10-7和5.0×10-5mol/L两个浓度下进行了考察,计算结果表明在两个浓度下平行测定结果的相对标准偏差(RSD)都在5.8%之内(n=6),说明方法的精密度良好。
分别取自来水和湖水作为实际样品进行检测,自来水未作任何预处理,湖水仅进行了过滤去除悬浮物。将水样的pH调至2.0,按照1.2.3测定方法,在最佳条件下进行回收率测定,实验结果如表2所示。虽然在样品中未检出Hg2+,但是加标回收率在86.4%~104.6%之间,说明该方法可用于水样中 Hg2+的测定。
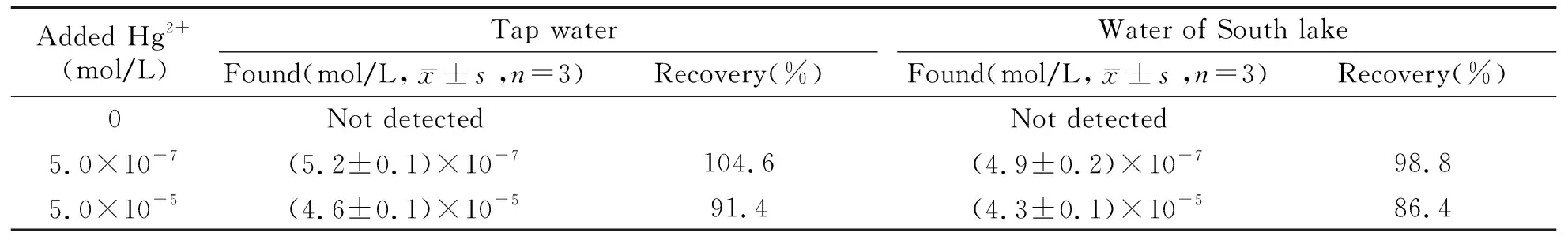
表2 实际水样品的加标回收率
此外,将所建立的方法与文献已报道的量子点荧光光度法测定Hg2+的方法进行了比较,见表3。

表3 与文献已报道的量子点法测定Hg2+的结果比较
4 结论
制备了巯基化壳聚糖,并采用一步法合成了巯基化壳聚糖包覆CdS QDs,制备的量子点粒径分布均匀,光稳定性好且巯基化壳聚糖的包覆降低了量子点的毒性。基于Hg2+对量子点的荧光猝灭作用建立了荧光猝灭法测定水样中Hg2+的分析方法。方法的日内及日间精密度良好且抗干扰性好,所建立的分析方法将有望用于生物体系中Hg2+的检测。

