SO2处理激活龙眼葡萄果实采后防御应答
刘丽青,仪慧兰*
(山西大学生命科学学院,山西 太原 030006)
SO2处理激活龙眼葡萄果实采后防御应答
刘丽青,仪慧兰*
(山西大学生命科学学院,山西 太原 030006)
以龙眼葡萄为材料,研究果实贮藏中防腐保鲜剂SO2处理对果皮组织氧化还原平衡、次生代谢途径的影响。结果表明:使用SO2保鲜剂可使龙眼果实货架期延长,SO2处理组葡萄果实完好率明显高于对照组,脱粒和腐烂率低于对照组。贮藏期间SO2处理组果皮组织抗氧化能力提高,次生代谢途径关键酶苯丙氨酸解氨酶活性增强,总花色苷含量略有升高,H2O2含量和丙二醛含量高于对照组。结果表明,SO2保鲜剂可激活葡萄果实细胞内活性氧升高,介导果实细胞抗氧化能力增强,与植保素合成相关的次生代谢活性增强,从而使细胞防御能力提高,果实保鲜期延长。
葡萄果实;采后贮藏;SO2保鲜;防御应答;次生代谢
鲜食葡萄汁多味美,含有大量的糖及蛋白质、有机酸、矿物质、维生素等多种营养物质,具有很高的营养价值、经济价值和食疗价值,受到广大消费者的喜爱[1]。但由于其果粒皮薄多汁,含糖量高,在贮藏过程中易发生腐烂、脱粒、干梗等现象,降低了葡萄的品质和商品价值[2]。目前,商用葡萄保鲜技术多种多样,较为广泛的是二氧化硫(SO2)熏蒸处理。SO2是传统的葡萄保鲜剂,能抑制贮藏期间病原菌的感染、延缓果实衰老[1-3]。有学者认为SO2对病原微生物可产生直接的毒作用,抑制病原菌生长繁殖,而近期研究发现SO2保鲜处理可激发葡萄果实内与氧化还原和生物防御反应相关的基因转录改变[3]。紫外线和过氧化氢(H2O2)同样具有氧化损伤和抑菌效应,但对葡萄果实的保鲜效果不及SO2,说明SO2保鲜过程具有复杂的作用机制[3],葡萄果实细胞基因的差异表达可能在SO2防腐保鲜作用中发挥功能。但目前SO2保鲜机制尚不清楚。
次生代谢是植物在长期进化过程中对生态环境适应的结果,在受到环境刺激如病原菌侵袭或非生物胁迫时,植物产生并积累次生代谢产物,用以增强自身的抵抗力。花色苷是一类广泛存在于高等植物中的酚类化合物,为植物细胞次生代谢产物。作为保护性色素花色苷可被生物(病菌)或非生物胁迫(低温、紫外线等)诱导积累[4]。鲜食葡萄在采后贮藏过程中花色苷的含量变化不仅影响果实外在品质,还会影响葡萄的食用安全性。苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)是次生代谢途径的关键酶,催化苯丙氨酸转化为反式肉桂酸,进而产生一系列具有结构和防御功能的物质(如植保素、木质素、生物碱、植物激素等);在胁迫条件下,PAL激活被认为是植物细胞防御机制的一部分[5]。但SO2保鲜作用是否与果实花色苷含量和次生代谢有关少有报道。因此本实验选取了PAL活性、总花色苷含量及抗氧化性进行测定,探讨SO2处理对葡萄贮藏生理的作用,为寻求更加安全的贮藏保鲜剂提供依据。
1 材料与方法
1.1材料与试剂
田间采摘后,剔除个别损伤颗粒,选色度较为一致的龙眼葡萄果穗。
SO2制剂 山西省农业科学院;三氯乙酸、硫代巴比妥酸、巯基乙醇、苯丙氨酸、盐酸、甲醇、碘化钾均为国产分析纯。
1.2仪器与设备
TGL-16G离心机 上海安亭科学仪器厂;SB-3200超声波清洗机 宁波新芝生物科技股份有限公司;UV-2000型紫外-可见分光光度计 龙尼柯(上海)仪器有限公司;电子天平 赛多利斯科学仪器(北京)有限公司。
1.3方法
1.3.1SO2处理与实验分组
将龙眼葡萄按每箱5 kg分装,在0 ℃预冷12 h后,处理组放入SO2制剂,每箱1/4张葡萄速释保鲜纸(含Na2S2O5约1.2 g)+8包葡萄控释保鲜片(含Na2S2O5约6.8 g),对照组不放药物,扎紧塑料袋口,于低温保鲜库中-1~0 ℃贮藏。观察统计贮藏期间葡萄果实的脱粒率和腐烂率,根据对照组果实外观品质的变化,选取贮藏初期(果实新鲜,果皮光亮,品质完好,好果率大于98%)、感病初期(好果率大于80%)和感病晚期(好果率低于70%)3 个时期外观完好的果实,及同期用SO2保鲜剂处理的果实,从不同果穗中取果粒,水冲洗后锡箔纸包裹,液氮速冻,-80 ℃保存备用。
1.3.2指标测定
1.3.2.1H2O2的测定
取葡萄果皮,采用Bhatt等[6]的方法测定H2O2含量。
1.3.2.2PAL活性的测定
取葡萄果皮,采用Romero等[7]的方法测定PAL活性。以吸光度变化0.01为苯丙氨酸解氨酶PAL活性单位(1 U=0.01Δ A290nm/(h·g))。
1.3.2.3总花色苷含量的测定
果皮总花色苷含量采用pH值示差法测定[8]。按式(1)、(2)计算花色苷含量。

式中:Mw为锦葵色素-3-葡萄糖苷摩尔分子质量(493.2 g/mol);DF为稀释倍数;1为光程/cm;ε为摩尔消光系数(28 000 L/(mol·cm))。
1.3.2.4抗氧化能力的测定
组织提取液制备方法同总花色苷提取方法,用清除ABTS+·能力的测定方法[9]测定抗氧化能力。
1.3.2.5丙二醛(malondialdehyde,MDA)含量的测定
MDA含量采用硫代巴比妥酸比色法进行测定[10]。
1.4数据统计分析
取3次生物学重复的检测值,计算平均值和标准误。采用SPSS 17.0进行数据处理分析,用邓肯氏多重比较方法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 SO2处理对龙眼葡萄果实外观品质的影响
贮藏初期龙眼果实SO2处理组与对照组的好果率均在98%以上,随着贮藏时间的延长,好果率开始下降,但对照组的降速明显高于SO2处理组(图1)。在贮藏71 d时,对照组好果率为76.8%,SO2处理组好果率为94.87%;贮藏95 d时,对照组好果率降至28.7%,而处理组好果率为90.11%。可见,SO2处理可以有效提高贮藏期间葡萄果实的好果率,延长果实货架期。

图1 SO 1 SO2处理对葡萄果实好果率的影响Fig.1 Effects of SO2on good fruit rate of grape berries
2.2SO2处理对龙眼葡萄果皮H2O2含量的影响
从图2可看出,加入保鲜剂SO2可引发葡萄果皮中H2O2含量升高,在贮藏95 d内SO2处理组H2O2含量维持较高水平,而同期果实完好率保持在90%以上,说明SO2处理诱导果皮H2O2含量升高可能在果实贮藏保鲜中具有一定作用。随贮藏时间的延长,对照组果实逐渐衰老,并开始腐烂,果皮中H2O2含量随之升高。在贮藏95 d时,对照组与SO2处理组果皮组织中H2O2含量接近,但可能由于产生的机制存在差异,果实表现出完全不同的外观特征。

图2 SO 2 SO2处理对葡萄果皮HH2O2含量的影响Fig.2 Effects of SO2on H2O2content in grape skins
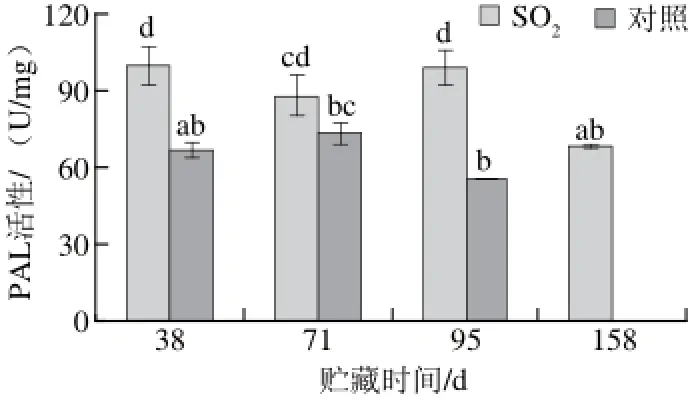
图3 SO 3 SO2处理对葡萄果皮PAL活性的影响Fig.3 Effects of SO2on PAL activity in grape skins
2.3SO2处理对龙眼葡萄果皮PAL活性的影响
贮藏期间SO2处理组葡萄果皮中PAL活性高于对照组(图3),即SO2处理组果皮细胞中次生代谢途径增强。在95 d贮藏期内,对照组PAL活性先升后降,38 d和71d间无显著差异,但95 d时显著降低。SO2处理组PAL活性在95 d内维持较高水平,158 d时显著降低。植物PAL途径能合成多种保护性物质,PAL活性增强有益于这些保护性成分的合成。对照组贮藏95 d与SO2处理组贮藏158 d果实品质下降时均伴随着PAL活性的降低,说明PAL活性对保护果实品质的重要性。
2.4SO2处理对龙眼葡萄果皮总花色苷含量的影响

图 44 SSOO2处理对葡萄果皮总花色苷含量的影响Fig.4 Effects of SO2on total anthocyanin content in grape skins
在整个贮藏期间,SO2处理组果皮中总花色苷含量高于对照组,并维持在较高水平(图4)。贮藏初期对照组与SO2处理组果皮中总花色苷含量接近,但随后对照组总花色苷含量逐渐下降,至71 d后显著降低,而SO2处理组总花色苷含量维持稳定并略有上升,因此随着贮藏期延长,对照组与SO2处理组间总花色苷水平差异逐渐增大,产生显著性差异。
2.5SO2处理对龙眼葡萄果皮抗氧化能力的影响贮藏期间SO2处理组葡萄果皮抗氧化能力(清除

图5 SO 5 SO2处理对葡萄果皮清除ABTSABTS+·能力的影响Fig.5 Effects of SO2on antioxidant capacity in grape skins
ABTS+·)高于对照组(图5)。在贮藏95 d内,SO2处理组抗氧化能力相对平稳,对照组抗氧化能力出现波动但没有形成显著差异。对照组贮藏71 d时可能因衰老或病原菌感染导致胞内活性氧水平升高(图2),介导细胞抗氧化能力增强(图5),但随后因自身衰老或病原菌感染使细胞受损,抗氧化能力下降。
2.6SO2处理对龙眼葡萄果皮MDA含量的影响
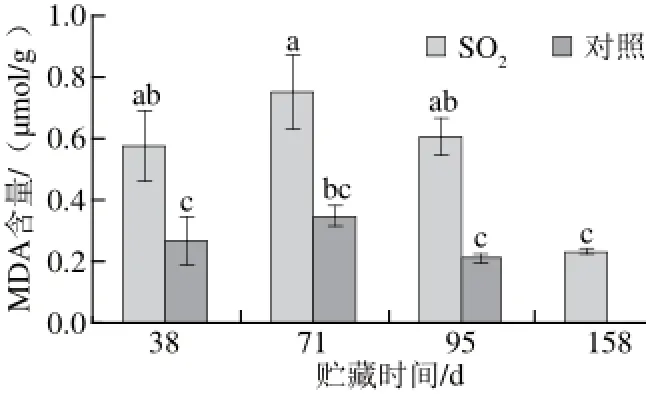
图 66 SSOO2处理对葡萄果皮MDA含量的影响Fig.6 Effects of SO2on malondialdehyde content in grape skins
龙眼葡萄果皮MDA含量检测结果表明(图6),贮藏期间SO2处理组果皮MDA含量高于对照组,贮藏95 d内对照组和SO2处理组果皮MDA含量具有相似的变化趋势。SO2处理组158 d与对照组95 d的MDA水平接近,可能与果实细胞生理衰老有关。
3 讨 论
低温和SO2保鲜剂的联合使用,是目前广泛使用、最为有效的葡萄贮藏保鲜手段。研究[11]表明,适宜的SO2浓度可有效抑制葡萄贮藏过程中病菌感染,降低果实呼吸强度,减少呼吸基质消耗,抑制乙烯释放,从而增加果实的耐贮藏性。葡萄在贮藏过程中会发生一系列的生理生化变化,也是葡萄果实成熟和衰老的重要表现。本实验通过测定龙眼葡萄贮藏期间生理指标的改变来探索SO2制剂对葡萄果实保鲜的生物学机制。
研究发现SO2处理组葡萄果实中H2O2水平、抗氧化能力、次生代谢途径同期增强,可能在贮藏保鲜中发挥了重要作用。H2O2具有杀菌作用,SO2处理组细胞内高水平的H2O2可穿过细胞膜作用于外部病原菌,抑制其生长繁殖或致死。胞内一定水平的H2O2还可作为胁迫信号分子,诱导植物细胞产生防御应答,使抗氧化酶活性提高,还能刺激次生代谢途径增强[12]。PAL是植物细胞次生代谢的第一个关键酶,连接初级代谢和苯丙烷类代谢,催化苯丙烷类代谢第一步反应,是合成植保素、木质素等多种次生代谢产物的关键酶[13]。次生代谢产物中,萜类、生物碱和酚类都是植保素,异黄酮类亦可作为真菌毒素,水杨酸、茉莉酸等可作为信号物质参与植物生理。研究[14]发现,PAL对多种环境刺激应答,启动植物防御系统并产生异黄酮类和酚类等抗病物质,如植保素对病原菌产生抑制作用,木质素将病原菌隔绝使之无法侵犯植物体,在植物抗病中起化学屏障作用和植物抗毒素作用[15]。因此,本研究中SO2处理提高了葡萄果实中H2O2的水平,并可能通过活性氧信号分子激活了细胞防御系统,一方面激活抗氧化系统清除胞内过量活性氧,另一方面诱发果皮PAL活性增强,使具有植保素作用的花色苷及其他次生代谢产物在贮藏期间保持较高水平,从而导致机体防御能力增强,果实生理衰老延缓。
花色苷分子中的酚羟基是其抗氧化作用的主要活性基团。酚羟基可有效清除脂类自由基,中断脂类氧化的链式反应,从而防止脂质过氧化作用[16]。由于花色苷具有清除自由基的能力,所以本实验同时采取ABTS+·方法相应测定花色苷提取液的抗氧化能力。实验中SO2处理组葡萄果皮总花色苷含量和抗氧化能力均高于对照组,表明SO2处理延缓了花色苷的消退,维持了组织的抗氧化活性,该结果与前人的结果[17]一致。此外,研究[18-19]发现,施加植物激素对蓝莓和草莓保鲜处理后,果实花色苷含量积累并维持较高水平的抗氧化活性,说明花色苷积累在果实采后保鲜中经常发生,而同期提高的抗氧化能力可能对果实抗衰老生理有益。花色苷具有清除自由基提高抗氧化能力的功效,因此SO2处理组葡萄果皮内总花色苷含量维持较高水平有利于清除体内代谢产生的自由基,抵御衰老引起的损伤,发挥贮藏保鲜作用。
植物遭遇逆境时细胞内部活性氧水平提高,活性氧积累可能诱发细胞膜脂过氧化作用,使膜脂过氧化产物MDA含量提高[20]。本研究中SO2处理组果实MDA含量高于对照组,可能是由于SO2胁迫引发胞内H2O2等活性氧分子水平提高,诱发了MDA含量的上升。但本研究室检测贮藏期间葡萄果实中的糖分、总酸、VC的含量发现,SO2处理组各营养成分含量相对稳定,其降幅明显低于对照组,说明果实食用品质保持在较好的范围内,MDA含量升高没有对果实品质产生明显不利影响。综上所述,SO2处理葡萄果实能增强果实细胞次生代谢途径,提高组织抗氧化能力,维持果实内部花色苷含量及其他营养元素的稳定,发挥保鲜防腐作用。本结果为探索SO2保鲜作用机制提供了一定的科学依据。
[1] 李明娟, 游向荣, 文仁德, 等. 葡萄果实采后生理及贮藏保鲜方法研究进展[J]. 北方园艺, 2013, 37(20): 173-178.
[2] 贺光祖, 张才智, 晏宇, 等. 葡萄贮藏保鲜技术研究进展[J]. 现代农业科技, 2009, 38(22): 339-343.
[3] GIRAUD E, IVANOVA A, GORDON C S, et al. Sulphur dioxide evokes a large scale reprogramming of the grape berry transcriptome associated with oxidative signalling and biotic defence responses[J]. Plant, Cell and Environment, 2012, 35(2): 11-13.
[4] WINKEL-SHIRLEY B. Flavonoid biosynthesis. A colourful model for genetics, biochemistry, cell biology, and biotechnology[J]. Plant Physiology, 2001, 126(2): 485-493.
[5] 张宽朝, 金青. 苯丙氨酸解氨酶与其在重要次生代谢产物调控中的作用研究进展[J]. 中国农学通报, 2008, 24(12): 59-62.
[6] BHATT D, NEGI M, SHARMA P, et al. Responses to drought induced oxidative stress in fi ve fi nger millet varieties differing in their geographical distribution[J]. Physiology and Molecular Biology for Plants, 2011, 17(4): 347-353.
[7] ROMERO I, MALDONADO R, MERODIO C, et al. Anthocyanin,antioxidant activity and stress-induced gene expression in high CO2-treated table grapes stored at low temperature[J]. Journal of Plant Physiology, 2008, 165(5): 522-530.
[8] 翦祎, 韩舜愈. 单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J]. 食品工业科技, 2012, 33(23): 323-325.
[9] 孟庆焕, 王化, 王洪政, 等. 牡丹种皮黄酮提取及对ABTS自由基清除作用[J]. 植物研究, 2013, 33(4): 504-507.
[10] 张志良. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2009:227-228.
[11] SANDUHU S S, JOHNSTON D E. Effects of package and storage conditions on the keeping quality of Perletle grapes[J]. Vitis, 1982, 29:97-107.
[12] SUZUKI N, KOUSSEVITZKY S, MITTLER R, et al. ROS and redox signalling in the response of plants to abiotic stress[J]. Plant, Cell and Environment, 2012, 35: 259-270.
[13] 马俊彦, 杨汝德, 敖利刚. 植物苯丙氨酸解氨酶的生物学研究进展[J].现代食品科技, 2007, 27(7): 71-74.
[14] WANG Lijun, MA Ling, DUAN Wei, et al. Individual and combined effects of CaCl2and UV-C on the biosynthesis of resveratrols in grape leaves and berry skins[J]. Journal of Agricultural and Food Chemistry,2013, 61(29): 7135-7141.
[15] 林素英, 陈宇, 童丽华, 等. 羧甲基壳聚糖对枇杷果实保鲜效果的影响[J]. 食品科学, 2013, 34(18): 312-316. doi: 10.7506/spkx/1002-6630-201318064.
[16] 薛红玮, 陈向民, 牟德华. 花色苷类色素抗氧化活性研究进展[J]. 食品研究与开发, 2009, 30(7): 190-192.
[17] 吴斌, 张玉丽, 程琳琳, 等. 鲜食葡萄花色苷的研究进展[J]. 现代食品科技, 2012, 28(4): 441-444.
[18] HUANG Xiaojie, LI Jing, SHANG Hongli, et al. Effect of methyl jasmonate on the anthocyanin content and antioxidant activity of blue berries during cold storage[J]. Journal of the Science of Food and Agriculture, 2015, 95(2): 337-343.
[19] LI Dongdong, LUO Zisheng, MOU Wangshu, et al. ABA and UV-C effects on quality, antioxidant capacity and anthocyanin contents of strawberry fruit (Fragaria ananassa Duch.)[J]. Postharvest Biology and Technology, 2014, 90: 56-62.
[20] 李志文, 张平, 刘翔, 等. 1-MCP结合冰温贮藏对葡萄采后品质及相关生理代谢的调控[J]. 食品科学, 2011, 32(20): 300-306.
Sulfur Dioxide Induces Defense Response of Longan Grape Berries during Storage
LIU Liqing, YI Huilan*(School of Life Science, Shanxi University, Taiyuan 030006, China)
The effect of preservative SO2on oxidation-reduction equilibrium capacity and secondary metabolism in grape berries of Longan cultivar during storage was explored. The results showed that application of preservative SO2extended the shelf life of grape berries. Their intactness was signifi cantly higher than that of the control grapes, and threshing and decay rate were also lower relatively. During SO2-fumigated storage, antioxidant capacity of grape skins was increased, the activity of phenylalanine ammonialyase (PAL), a key enzyme involved in secondary metabolic pathways, was enhanced, and total anthocyanin content was elevated slightly. In addition, the contents of H2O2and malondialdehyde (MDA) in SO2-fumigated grape skin tissue were higher than those of the control group. These fi ndings indicated that reactive oxygen species (ROS)signals were activated in grape skin cells. Antioxidant capacity and the secondary metabolism associated with the synthesis of phytoalexin were increased by preservative SO2, thereby enhancing defense capabilities and leading to an extended shelf life of grape berries.
grape berries; postharvest storage; SO2storage; defense response; secondary metabolism
TS255.3
A
1002-6630(2015)18-0209-04
10.7506/spkx1002-6630-201518039
2015-01-04
国家自然科学基金面上项目(30870454;30470318;31371868)
刘丽青(1989—),女,硕士研究生,研究方向为果实保鲜。E-mail:1142292448@qq.com
仪慧兰(1963—),女,教授,博士,研究方向为果实保鲜。E-mail:yihl@sxu.edu.cn

