高效液相色谱法测定8 个彩色马铃薯品种中花青素种类和含量
殷丽琴,彭云强,钟 成,付绍红,杨 进,黄 敏,余 勤,韦献雅,牛应泽,*
(1.成都市农林科学院作物研究所,四川 成都 611130;2.中化化肥有限公司西南分公司,四川 成都 610100;3.四川农业大学农学院,四川 成都 611130)
高效液相色谱法测定8 个彩色马铃薯品种中花青素种类和含量
殷丽琴1,彭云强1,钟 成2,付绍红1,杨 进1,黄 敏1,余 勤1,韦献雅3,牛应泽3,*
(1.成都市农林科学院作物研究所,四川 成都 611130;2.中化化肥有限公司西南分公司,四川 成都 610100;3.四川农业大学农学院,四川 成都 611130)
采用高效液相色谱法,以表皮和薯肉为研究对象,定量分析8 个彩色马铃薯品种块茎中花青素的种类和含量。研究发现,彩色马铃薯块茎中最多含有6 种花青素,即飞燕草色素、矢车菊色素、矮牵牛色素、天竺葵色素、芍药色素和锦葵色素。紫色马铃薯块茎中主要花青素为矮牵牛色素、芍药色素和锦葵色素,红色马铃薯块茎中主要花青素是天竺葵色素和芍药色素。飞燕草色素和芍药色素广泛存在于彩色马铃薯(紫色和红色)块茎的表皮中,而红色马铃薯块茎中未检测到锦葵色素。品种之间差异显著(P<0.05),其中紫云1号的总花青素含量最高。块茎表皮的花青素含量约是薯肉的6~176 倍,且大部分品种的表皮花青素种类比薯肉多。彩色马铃薯块茎的表皮富含丰富的花青素,是天然色素和抗氧化剂的重要来源。
彩色马铃薯;高效液相色谱法;花青素;表皮;薯肉
2015年初马铃薯主粮化发展战略研讨会提出让马铃薯逐渐成为水稻、小麦、玉米之后的我国第4大主粮作物[1]。马铃薯产量高、栽培范围广、生产成本低、生育期短、营养丰富[2],其中彩色马铃薯含有大量的花色苷,是重要的天然色素和抗氧化剂的来源[3-5],越来越受到人们的喜爱。马铃薯表皮含有较高的花色苷等酚类物质,一般是加工过程中的废料,目前生产上可用于生产天然色素和抗氧化剂,提高马铃薯的利用率[3]。
花色苷是一种广泛存在于植物中的水溶性色素,属于类黄酮多酚类化合物,是由花青素在自然条件下与多种糖形成的糖苷[6]。目前已知的花青素有20多种,食品中主要有6 种即天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、矮牵牛色素和锦葵色素[7]。研究[8-9]发现天竺葵色素呈现砖红色,矢车菊素及芍药花色素表现为紫红色,而飞燕草素、矮牵牛色素及锦葵色素表现为蓝紫色系。
大量研究表明彩色马铃薯花色苷是一类含单一酰化p-香豆酸或阿魏酸或咖啡酸的3-鼠李糖-葡萄糖苷-5-葡萄糖苷衍生物[10-12]。Jansen等[13]发现表皮花色苷含量显著高于薯肉花色苷含量,且块茎贮藏135 d后花色苷含量无明显变化。关于彩色马铃薯花青素的研究中国外较多而国内较少,且绝大部分是以马铃薯肉为实验对象,很少有探究表皮花青素组分。Lewis等[14]发现紫色马铃薯富含矮牵牛色素和锦葵色素,而红色马铃薯富含天竺葵色素和少量芍药色素。Rodriguez-Saona等[15]发现红色马铃薯材料主要花青素为天竺葵色素。Brown等[16]研究发现红色马铃薯主要花青素为天竺葵色素,紫色马铃薯主要花青素为锦葵色素、矮牵牛色素、芍药色素和飞燕草色素。本实验采用高效液相色谱(high performance liquid chromatography,HPLC)法,以8 个彩色马铃薯品种为材料,同时以表皮和薯肉为研究对象,分析其花青素的组成谱,为评价彩色马铃薯色素含量、探究花青素积累模式和提高马铃薯利用率等提供理论依据。
1 材料与方法
1.1材料与试剂
供试的彩色马铃薯分为紫云1号、云薯303、S03-2685、S06-1693、S05-603、红云1号、云薯603和S06-277,其中紫云1号、云薯303、S03-2685、S06-1693和S05-603块茎的颜色呈紫色系,红云1号、云薯603和S06-277块茎的颜色呈红色系,均由云南省农科院惠赠。材料于2012年9月中旬种植在四川农业大学实验基地,待完全成熟后收获,随即进行色素提取。
盐酸、乙醇、氯化钾、醋酸钠、碳酸钠、氢氧化钠、氯化钠 四川瑞进特化工公司;乙腈(色谱纯)美国Fisher Scientific公司;甲酸(色谱纯) 比利时Acros Organics公司;锦葵色素、矢车菊色素、天竺葵色素、飞燕草色素、芍药色素和矮牵牛色素标准品 德国PhytoLab公司。
1.2仪器与设备
Bs201s电子天平 北京赛多利斯仪器系统有限公司;HH-8数显恒温水浴锅 国华电器有限公司;KQ-100 TDE型高频率数控超声波清洗器 昆山市超声波仪器有限公司;SORVALL Stratos冷冻型高速台式离心机美国Thermo Fisher公司;1200 Series HPLC仪(包括可变波长检测器、自动进样器色谱柱) 美国Agilent公司。
1.3方法
1.3.1花色苷的提取
从每个品种中选择具有代表性的马铃薯块茎各5 个,用自来水清洗干净,在空气中自然晾干,用水果刀分离表皮(1~2 mm)和薯肉。分别混合表皮和薯肉至均匀,采用四分法各取0.5 g表皮和0.5 g薯肉。花色苷的提取参照殷丽琴等[17]的方法,按料液比1∶30(g/mL)加15 mL 95%乙醇-1.5 mol/L盐酸(85∶15,V/V)提取液,放入研钵中加液氮后捣碎,45 ℃、100 W超声波处理30 min,5 000 r/min离心5 min,吸取上清液;利用滤渣重复提取1 次,将2 次的提取液合并。
1.3.2花色苷水解
花色苷的水解参考郭灵安等[18]方法,略做修改。取3 份花色苷提取液,加入1 份浓盐酸,在90 ℃条件下水浴40 min后放在冰盒上冷却,使花色苷在强酸环境中充分水解成花青素。水解后的溶液经0.45 μm滤膜过滤后用于HPLC分析。
1.3.3HPLC分析
分别精确称取花青素标准品1 mg溶解于10 mL溶剂(提取液-浓盐酸,3∶1,V/V)中,配制成100 μg/mL的储备液,再分别稀释成1、5、10、15、20、25 μg/mL的工作液。
HPLC分析条件:ZorbaxEclipes XDB-C18色谱柱(4.6 mm×150 mm,5 μm);柱温30 ℃;流速0.8 mL/min;进样量20 μL;检测波长520 nm;流动相A为0.5%甲酸,流动相B为乙腈,采用梯度洗脱方式,0~3 min内,流动相B的比例由12%上升到15%;3~25 min,流动相B的比例由15%上升到25%。
1.4数据分析
采用Microsoft Excel 2007软件对数据进行常规整理,运用SPSS 13.0软件进行多重比较和相关分析,采用峰面积归一化法计算花青素含量[19],以鲜质量计。
2 结果与分析
2.1花青素标准曲线
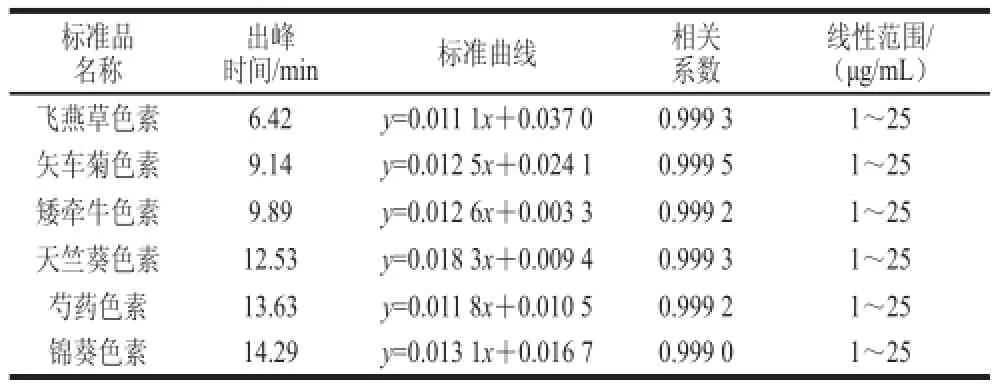
表1 花青素标准品的标准曲线Table 1 Standard curves of anthocyanin standards
分别以6 个花青素标准品的质量浓度为横坐标,峰面积为纵坐标进行线性回归分析,绘制标准曲线,各标准曲线的相关系数均达到了0.999,说明花青素质量浓度与峰面积的线性相关性较好。4 min之前出的峰为溶剂峰。花青素标准品的名称、出峰时间、标准曲线方程、相关系数和线性范围见表1,液相色谱图见图1。
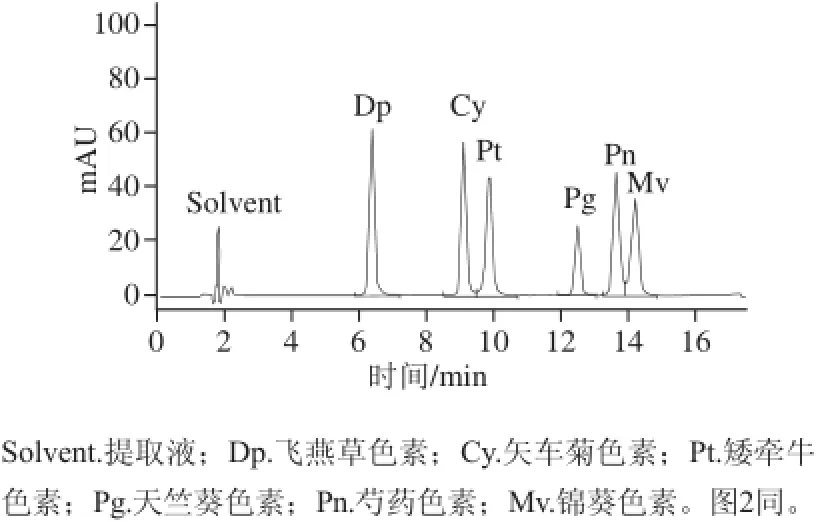
图1 6 种花青素标准品的HPLC图谱Fig.1 HPLC chromatograms of mixture of six anthocyanin standards
2.2表皮花青素种类和含量
从表2可知,彩色马铃薯块茎的表皮中存在4~6 种花青素,品种之间存在差异。紫云1号(图2A)、云薯303和S03-2685的表皮中检测到6 种花青素,分别是飞燕草色素、矢车菊色素、矮牵牛色素、天竺葵色素、芍药色素和锦葵色素。红云1号(图2B)和云薯603的表皮中有5 种花青素,二者均不含有锦葵色素;S06-1693的表皮也有5 种花青素,但没有天竺葵色素。另外,S05-603和S06-277的表皮中检测到4 种花青素,前者不含矢车菊色素和天竺葵色素,后者则不含矮牵牛色素和锦葵色素。
从花青素含量上看,紫云1号、云薯303和S03-2685表皮的矮牵牛色素含量最高,分别占了各自总花青素含量的66.05%、65.99%和65.78%,其次是芍药色素,分别占了21.20%、20.28%和19.00%,第3是锦葵色素,其他3 种色素含量很少。虽然这3 个品种的总花青素含量差异加大,但它们的花青素组成却很相似,主要花青素均为矮牵牛色素、芍药色素和锦葵色素,分别占了各自总花青素含量的95.33%、97.29%和95.58%。S06-1693和S05-603的表皮中含量最高花青素的也是矮牵牛色素,分别占各自总花青素含量的85.76%和88.94%;其次是锦葵色素;飞燕草色素和芍药色素所占比例较小,均在1%左右;S06-1693的总花青素含量约是S05-603的5 倍。红云1号、云薯603和S06-277的表皮中占优势地位的花青素是天竺葵色素,分别占总花青素含量的88.10%、92.30%和91.51%;3 个品种中含量第2高的均为芍药色素,分别占9.45%、5.90%和6.15%;天竺葵色素和芍药色素是红云1号、云薯603和S06-277表皮的主要花青素,共占各自总花青素含量的97.55%、98.20%和97.66%。
8 个彩色马铃薯品种的块茎表皮中均含有飞燕草色素和芍药色素,但飞燕草色素含量非常低,品种间变化范围为0.49~2.48 mg/100 g,仅占总花青素含量的0.43%~1.28%,S06-1693表皮中飞燕草色素含量最高。芍药色素含量相对高些,品种间变化范围为0.56~56.97 mg/100 g,占总花青素含量的1.01%~21.20%,紫云1号表皮的芍药色素含量最高。彩色马铃薯块茎表皮的矢车菊色素含量也较低,品种间变化范围为0~2.87 mg/100 g,所占比例为0~2.68%,紫云1号表皮的矢车菊色素含量最高。矮牵牛色素是紫云1号、云薯303、S03-2685、S06-1693和S05-603块茎表皮中占有优势地位的花青素;其变化幅度较大,含量变化范围为0~177.50 mg/100 g,所占比例变化范围为0~88.94%。天竺葵色素是红云1号、云薯603和S06-277的优势花青素;品种间含量变化范围为0~143.05 mg/100 g,所占比例变化范围为0%~92.30%。锦葵色素品种间的变化范围为0~28.61 mg/100 g,其中颜色呈现红色色系的红云1号、云薯603和S06-277中未检测到任何锦葵色素。从总花青素含量看,品种间差异达显著水平(P<0.05),紫云1号的表皮花色苷含量最高(268.76 mg/100 g),其次是S06-1693,最低的是S05-603(45.59 mg/100 g)。

表2 不同彩色马铃薯品种的表皮花青素种类、含量和比例Table 2 Anthocyanin composition of the skin of pigmented potato tubers from different cultivars
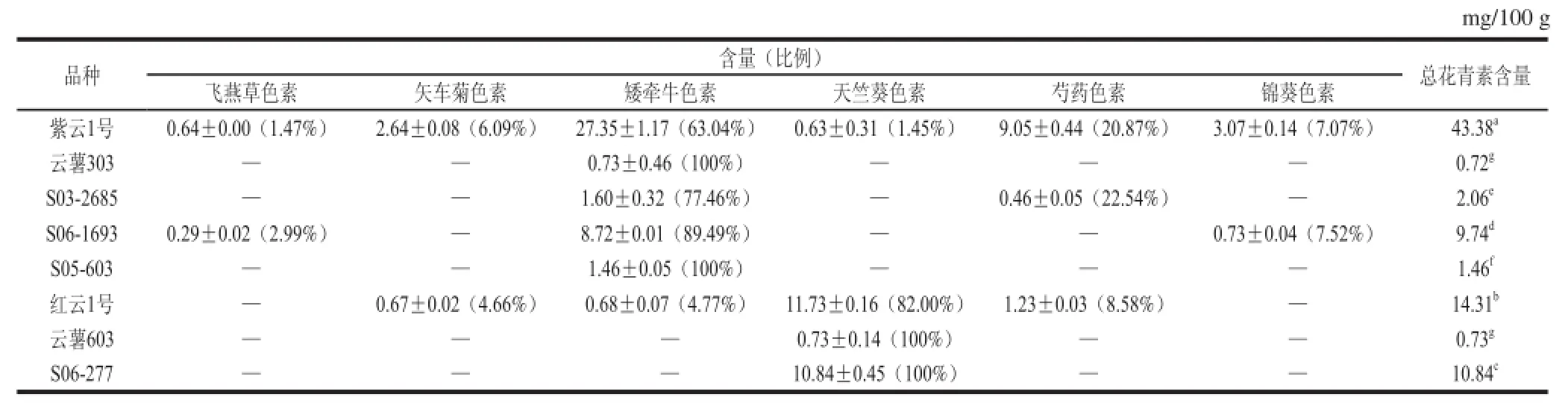
表3 不同彩色马铃薯品种的薯肉花青素种类、含量和比例Table 3 Anthocyanin composition of the fl esh of pigmented potato tubers from different cultivars

图2 紫云1号(A)和红云1号(B)块茎表皮的花青素HPLCC图谱Fig.2 HPLC chromatograms of the tuber skin of cultivar Ziyun No.1 (A)and Hongyun No.1 (B)
2.3薯肉花青素种类和含量
从表3可知,彩色马铃薯块茎的薯肉中也检测到6 种花青素,分别是飞燕草色素、矢车菊色素、矮牵牛色素、天竺葵色素、芍药色素和锦葵色素,不过花青素的含量和种类却较表皮少。紫云1号的薯肉同样含有6 种花青素。红云1号的薯肉中有4 种花青素,不含飞燕草色素和锦葵色素。S06-1693的薯肉含有3 种花青素,分别是飞燕草色素、矮牵牛色素和锦葵色素。S03-2685的薯肉中检测到矮牵牛色素和芍药色素2 种花青素。云薯303和S05-603的薯肉中只检测到矮牵牛色素;云薯603和S06-277的薯肉只检测到天竺葵色素。
从花青素含量上看,薯肉中每种花青素均比表皮的低。紫云1号薯肉中矮牵牛色素含量最高,占63.04%;其次是芍药色素,占20.87%;再次是锦葵色素;3 种花青素共占总花青素含量的90.99%。紫云1号表皮和薯肉的花青素组成很相似。红云1号薯肉的天竺葵色素占82.00%,芍药色素占8.58%,矢车菊色素和矮牵牛色素各占4%左右,其主要花青素为天竺葵色素和芍药色素。S06-1693薯肉中含量最高的是矮牵牛色素,占89.49%,其次是锦葵色素。
不同品种间的薯肉总花青素含量也达到差异显著水平(P<0.05),变化范围为0.72~43.38 mg/100 g,其中紫云1号(43.38 mg/100 g)的最高,红云1号次之,云薯303(0.72 mg/100 g)最低。虽然薯肉中的总花青素含量比表皮低,但就同一品种而言,表皮和薯肉中的主要花青素相同。
2.4表皮和薯肉总花青素含量的比较
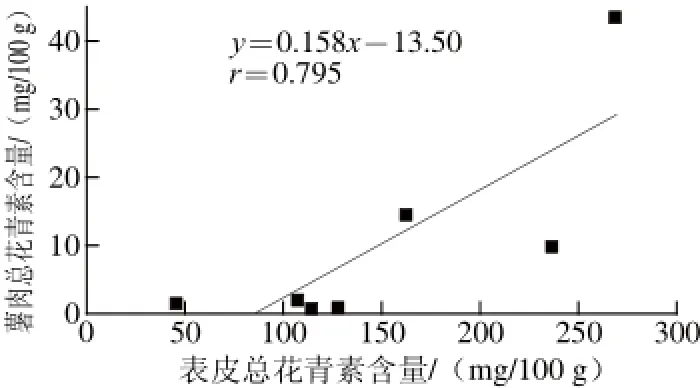
图3 彩色马铃薯块茎表皮和薯肉总花青素含量的相关分析Fig.3 Correlation analysis of total anthocyanidin content between the skin and fl esh of pigmented potato

表4 彩色马铃薯块茎的表皮总花青素含量与薯肉总花青素含量的比值Table 4 The ratios of anthocyanidin content between the skin and fl esh of pigmented potato tuber
从表4可知,彩色马铃薯块茎表皮的总花青素含量是薯肉的6.20~175.60 倍,变化幅度较大,这可能和花青素在表皮和薯肉上分布不均匀有关。Mendel[20]发现多酚类物质首先在马铃薯块茎的表皮累积,再慢慢向内渗透,因而表皮的花青素要比薯肉中多。前人研究还发现彩色马铃薯块茎的表皮为彩色时,薯肉不一定是彩色;且表皮着色均匀,薯肉着色常呈现多样化,有的全部着色、有的部分着色,从而形成了彩色的斑点、弧、环或辐射状等[21]。
对表皮和薯肉中的总花青素含量进行相关分析(图3),结果发现二者呈显著正相关(P<0.05),相关系数为0.795,即表皮花青素含量越高,对应的薯肉花青素含量也越高。
3 结 论
本实验采取HPLC法定量分析彩色马铃薯块茎的表皮和薯肉中花青素组成。结果发现彩色马铃薯块茎中最多含有6 种花青素,分别是飞燕草色素、矢车菊色素、矮牵牛色素、天竺葵色素、芍药色素和锦葵色素,这与Lachman等[22]的研究结果相符合。品种间的花青素种类和含量存在一定差异,紫云1号的表皮和薯肉花青素含量最高。表皮的花青素含量均比薯肉高,且绝大数品种的表皮花青素种类比薯肉的多。
HPLC法得到的块茎总花青素含量与pH值示差法得到的总花色苷含量相关性极显著(P<0.01),花青素含量高,则花色苷含量高。彩色马铃薯块茎的表皮含有丰富的花青素,且种类较多,可作为天然色素和抗氧化剂的重要来源。
研究[23-24]还发现,紫色马铃薯块茎中主要花青素是矮牵牛色素、芍药色素和锦葵色素,其中矮牵牛色素含量最高;红色马铃薯块茎中主要花青素是天竺葵色素和芍药色素,其中天竺葵色素占绝大优势,这和前人的研究结果类似。本研究还发现红色马铃薯中不含锦葵色素,可能是缺少相关色素合成酶或基因。此外,飞燕草色素和芍药色素广泛存在于彩色马铃薯(紫色和红色)块茎的表皮中,但飞燕草色素的含量普遍偏低,这和花青素的合成途径有关,飞燕草色素在类黄酮3,5-糖苷转移酶和转甲基酶的作用下生成矮牵牛色素,矮牵牛色素在转甲基酶的作用下生成锦葵色素[25],因此可能是大部分的飞燕草色素被转化成矮牵牛色素和/或锦葵色素。
[1] 宁启文. 以科技创新引领马铃薯主粮化发展[N]. 农民日报, 2015-01-07(001).
[2] 陈华宁. 中国马铃薯产业发展现状及对策[J]. 世界农业, 2008(8):13-15.
[3] ALBISHI T, JOHN J A, AL-KHALIFA A S, et al. Phenolic content and antioxidant activities of selected potato varieties and their processing by-products[J]. Journal of Functional Foods, 2013, 5(2): 590-600.
[4] HASSAN H, ABDEL-AZIZ A. Evaluation of free radical-scavenging and anti-oxidant properties of black berry against fl uoride toxicity in rats[J]. Food and Chemical Toxicology, 2010, 48(8): 1999-2004.
[5] BONTEMPO P, CARAFA V, GRASSI R, et al. Antioxidant,antimicrobial and anti-proliferative activities of Solanum tuberosum L. var. Vitelotte[J]. Food and Chemical Toxicology, 2013, 55: 304-312.
[6] 王锋, 邓洁红, 谭兴和, 等. 花色苷及其共色作用研究进展[J]. 食品科学, 2008, 29(2): 472-476.
[7] 孙建霞, 张燕, 孙志健, 等. 花色苷的资源分布以及定性定量分析方法研究进展[J]. 食品科学, 2009, 30(5): 263-268.
[8] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5): 923-933.
[9] 张洁. 紫薇花青素成分分析及其成色机理研究[D]. 杨凌: 西北农林科技大学, 2007.
[10] ANDERSEN M, OPHEIM S, AKSNES D W, et al. Structure of petanin, an acylated anthocyanin isolated from Solanum tuberosum,using homo and hetero nuclear two dimensional nuclear magnetic resonance techniques[J]. Phytochemical Analysis, 1991, 2(5): 230-236.
[11] FOSSEN T, VSTEDAL D O, SLIMESTAD R, et al. Anthocyanins from a Norwegian potato cultivar[J]. Food Chemistry, 2003, 81(3):433-437.
[12] LEWIS C. Biochemistry and regulation of anthocyanin synthesis in potato and other tuber-bearing Solanum species[D]. New Zealand:University of Canterbury, 1996.
[13] JANSEN G, FLAMME W. Coloured potatoes (Solanum tuberosum L.) -anthocyanin content and tuber quality[J]. Genetic Resources and Crop Evolution, 2006, 53(7): 1321-1331.
[14] LEWIS C E, WALKER J R, LANCASTER J E. Changes in anthocyanin, flavonoid and phenolic acid concentrations during development and storage of coloured potato (Solanum tuberosum L.)tubers[J]. Journal of the Science of Food and Agriculture, 1999, 79(2):311-316.
[15] RODRIGUEZ-SAONA L E, GIUSTI M M, WROLSTAD R E. Anthocyanin pigment composition of red-fl eshed potatoes[J]. Journal of Food Science, 1998, 63(3): 458-465.
[16] BROWN C, WROLSTAD R, DURST R, et al. Breeding studies in potatoes containing high concentrations of anthocyanins[J]. American Journal of Potato Research, 2003, 80(4): 241-249.
[17] 殷丽琴, 韦献雅, 钟成, 等. 不同品种彩色马铃薯总花色苷含量与总抗氧化活性[J]. 食品科学, 2014, 35(5): 96-100. doi: 10.7506/ spkx1002-6630-201405019.
[18] 郭灵安, 毛建霏, 雷绍荣, 等. 紫甘薯花色苷水解条件研究[J]. 食品与发酵科技, 2012, 48(3): 81-85.
[19] 刘玉芹. 六种紫色蔬菜中花色苷的定性定量分析及抗氧化活性研究[D]. 济南: 山东农业大学, 2011.
[20] MENDEL F. Chemistry, biochemistry and dietary role of potato polyphenols[J]. Journal of Agricultural and Food Chemistry, 1997, 45:1523-1540.
[21] 张静, 郭华春, 姚春雪. 11 个云南地方马铃薯品种块茎的花色苷含量及其分布[C]//马铃薯产业与粮食安全. 榆林: 马铃薯专业委员会,2009: 282-284.
[22] LACHMAN J, HAMOUZ K, ORSÁK M, et al. Impact of selected factors-cultivar, storage, cooking and baking on the content of anthocyanins in coloured-flesh potatoes[J]. Food Chemistry, 2012,133(4): 1107-1116.
[23] 侯夫云, 王庆美, 李爱贤, 等. 植物花青素合成酶的研究进展[J]. 中国农学通报, 2009, 25(21): 188-190.
[24] 顾林, 朱洪梅, 顾振新. 花青素的生物合成和成色机理及提高其稳定性的途径[J]. 食品工业科技, 2007, 28(11): 240-244.
[25] 葛翠莲, 黄春辉, 徐小彪. 果实花青素生物合成研究进展[J]. 园艺学报, 2012, 39(9): 1655-1664.
Determination of Anthocyanidin Composition of Different Pigmented Potato (Solanum tuberosum L.) Cultivars by HPLC
YIN Liqin1, PENG Yunqiang1, ZHONG Cheng2, FU Shaohong1, YANG Jin1, HUANG Min1, YU Qin1, WEI Xianya3, NIU Yingze3,*
(1. Crop Research Institute, Chengdu Academy of Agriculture and Forestry Sciences, Chengdu 611130, China;2. Sinochem Fertilizer Co. Ltd., Southwest Branch, Chengdu 610100, China;3. College of Agronomy, Sichuan Agricultural University, Chengdu 611130, China)
The anthocyanidin composition of the tuber of eight pigmented potato cultivars was analyzed by high performance liquid chromatography (HPLC). Results showed that pigmented potato tubers contained up to six anthocyanidins, namely,delphinidin, cyanidin, petunidin, pelargonidin, peonidin and malvidin. Petunidin, peonidin and malvidin were the dominant anthocyanidins in purple-colored potatoes, while pelargonidin and peonidin were the main anthocyanidins in red-colored potatoes. Delphinidin and peonidin were widely found in the skin of pigmented potato tuber. No malvidin was detected in red-colored potatoes. Signifi cant differences in anthocyanidin content exited among potato cultivars, among which, Ziyun No.1 had the highest content of anthocyanidin. Anthocyanidin contents in the skin were 6 to 176 times higher than in the fl esh. The number of anthocyanidins detected in the skin of most potato cultivars was greater than in the fl esh. In conclusion,pigmented potato skin, an important source of natural pigments and antioxidants, is rich in anthocyanidins.
pigmented potato; high performance liquid chromatography (HPLC); anthocyanidin; skin; fl esh
S532
A
1002-6630(2015)18-0143-05
10.7506/spkx1002-6630-201518026
2015-01-27
四川省科技计划项目(12CGZHZX0712);四川省教育厅重点科技项目(11LD018)
殷丽琴(1990—),女,实习研究员,硕士,研究方向为作物遗传育种。E-mail:yinlq1118@163.com
牛应泽(1955—),男,教授,博士,研究方向为作物遗传育种。E-mail:niuyz01@126.com
——矮牵牛

