萘酰亚胺衍生物的合成及对苦味酸的检测
余颖昊,杜 斌,丁志军,王普红,郭 磊,余建华,胡雨来*
(1.西北师范大学化学化工学院,甘肃兰州 730070; 2.防化研究院,北京 102205)
萘酰亚胺衍生物的合成及对苦味酸的检测
余颖昊1,杜 斌2,丁志军2,王普红2,郭 磊2,余建华2,胡雨来1*
(1.西北师范大学化学化工学院,甘肃兰州 730070; 2.防化研究院,北京 102205)
设计并合成了萘酰亚胺衍生物N-正己基-4-[2-(3-苯基硫脲)-乙氨基]-1,8-萘酰亚胺(HTN),通过NMR和MS表征了其结构。利用荧光光谱法研究了HTN对苦味酸(PA)的识别作用。研究发现,在C2H5OH/ H2O(2∶1)体系中,HTN荧光强度随PA浓度的增加而大幅度下降。PA浓度在1×10-6~5×10-4mol·L-1范围内时,猝灭率(I0-I)/I0与[PA]0.5呈线性关系,R2=0.995 5。常见苯系物,如苯胺、苯甲醛、三硝基甲苯、苯酚、苯乙烯、吡啶、对甲苯磺酸、甲苯、硝基苯及氯苯等均不干扰HTN对PA的识别。结果表明,HTN对PA具有较好的选择性和灵敏度。
萘酰亚胺;苦味酸;荧光光谱;检测
1 引 言
2,4,6-三硝基苯酚(PA)俗称苦味酸,是一种重要的硝基芳香族化合物,广泛应用于染料、炸药、农药、医药等领域。苦味酸对皮肤、眼睛、呼吸道有毒害作用,长期接触还会对肝脏和肾脏造成损害。随着我国工业的发展,排放到自然环境中的苦味酸随工业废水排放量的增加而增多,因此,对水体中苦味酸的检测有着现实的重要意义。GB 3838-2002《地表水环境质量标准》中规定,集中式生活饮用水地表水源的苦味酸标准限值为0.5 mg/m3。目前,苦味酸的检测方法主要有气相色谱法、高效液相色谱法等[1-6]。这些分析检测方法需要采样前处理且耗时较长,不能进行快速现场检测水体中苦味酸。荧光分析法具有响应速度快、灵敏度高、操作简便等优点,近年来受到广泛关注[7-9]。1,8-萘酰亚胺是一类优异的荧光分子,具有较大的共轭体系。其光化学稳定性好、荧光量子产率高、Stokes位移大,广泛应用于荧光探针、液晶、有机发光二极管(OLED)、医药等领域[10-15]。本文以4-溴-1,8萘酐为原料,设计合成了萘酰亚胺衍生物N-正己基-4-[2-(3-苯基硫脲)-乙氨基]-1,8-萘酰亚胺(HTN),并利用光谱方法,研究HTN对PA的识别过程。
2 实 验
2.1 仪器与试剂
仪器:VARIAN 600核磁共振谱仪(美国Varian公司,TMS为内标,600 MHz);Agilent6410 Triple Quad LC/MS液相色谱/四级杆质谱仪(美国Agilent公司);HP 8453紫外-可见分光光度计(美国惠普公司);F-2500荧光分光光度计(日本日立公司)。
试剂:4-溴-1,8-萘酐、正己胺、乙二胺、苯异硫氰酸酯、乙醚、异丙醇、乙醇、二氯甲烷、石油醚、乙二醇单甲醚等均为市售分析纯,苦味酸(分析纯,西亚试剂)使用前经乙醇重结晶。
2.2 实验部分
化合物HTN的合成路线如图1所示。
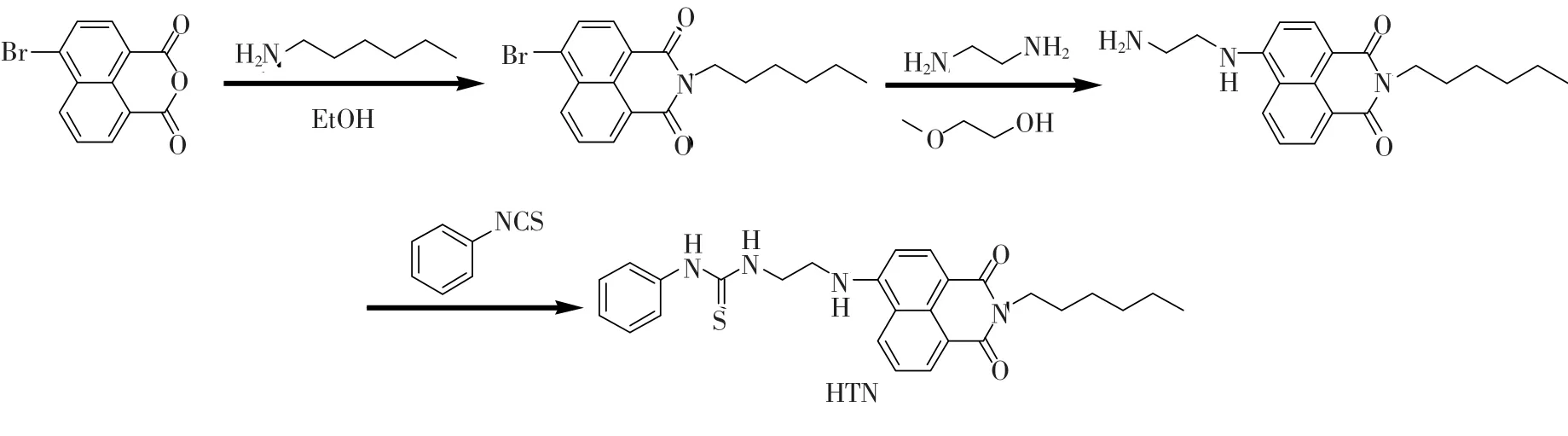
图1 化合物HTN的合成Fig.1 Syntheses of HTN
2.2.1 N-正己基-4-溴-1,8-萘酰亚胺(1)的合成
在50 mL圆底烧瓶中加入4-溴-1,8-萘酐1.11 g(4 mmol)、正己胺0.606 g(6 mmol)及乙醇20 mL,N2保护下回流搅拌反应7 h。反应完毕,减压除溶剂后加入大量的水洗涤,过滤后烘干,硅胶柱层析(洗脱剂V(二氯甲烷)∶V(石油醚)=1∶2)分离得黄色油状物1.2 g,产率83%。1H NMR(600 MHz,CDCl3,TMS)δ:0.95(t,J=7.0 Hz,3H),1.39(dd,J=12.3,9.0 Hz,4H),1.48(dd,J=14.8,7.1 Hz,2H),1.78(dt,J=15.4,7.6 Hz,2H),4.25~4.20(m,2H),7.94~7.89(m,1H),8.10(d,J=7.8 Hz,1H),8.48 (d,J=7.8 Hz,1H),8.63(d,J=8.4 Hz,1H),8.72(d,J=6.5 Hz,1H).13C NMR(151 MHz,CDCl3)δ:163.46(d,J=4.0 Hz),133.07(s),131.90(s),131.04(d,J=15.0 Hz),130.44 (s),130.09(s),128.81(s),127.99(s),123.01 (s),122.15(s),40.60(s),31.53(s),28.00(s),26.78(s),22.57(s),14.09(s).MS(ESI)m/z:382.0(M+Na)+.
2.2.2 N-正己基-4-(2-氨基乙氨基)-1,8-萘酰亚胺(2)的合成
在50 mL圆底烧瓶中加入N-正己基-4-溴-1,8-萘酰亚胺0.360 g(1 mmol)、乙二胺10 mL和乙二醇单甲醚20 mL,N2保护下回流搅拌反应18 h。反应完毕后悬蒸除溶剂,石油醚重结晶。产率40.29%。1H NMR(400 MHz,CDCl3)δ:8.59 (d,J=7.0 Hz,1H),8.46(d,J=8.1 Hz,1H),8.17(d,J=8.2 Hz,1H),7.63(t,J=7.6 Hz,1H),6.71(d,J=8.6 Hz,1H),6.15(s,1H),4.15(s,2H),3.41(s,2H),3.18(s,2H),1.72 (s,2H),1.59~1.24(m,6H),0.88(s,3H).13C NMR(101 MHz,CDCl3)δ:134.42(s),131.07 (s),126.08(s),124.68(s),123.23(s),104.46 (s),44.89(m),40.19(s),31.62(m),28.17(m),26.84(m),22.57(s),14.04(m).MS(ESI)m/z:340.1(M+H)+.
2.2.3 N-正己基-4-[2-(3-苯基硫脲)-乙氨基]-1,8-萘酰亚胺(HTN)的合成
苯异硫氰酸酯0.135 g(1 mmol)溶于10 mL乙醚中,N-正己基-4-(2-氨基乙氨基)-1,8-萘酰亚胺0.339 g(1 mmol)溶于30 mL异丙醇中,在磁搅拌下将前者缓慢滴加到后者中,持续40 min,然后常温下搅拌2 h。反应结束后旋蒸除溶剂,硅胶柱层析(洗脱剂V(二氯甲烷)∶V(石油醚)=1∶2)分离得黄色粉末状固体1.2 g,产率83%。1H NMR(400 MHz,CDCl3)δ:8.58(d,J=7.3 Hz,1H),8.48(d,J=8.4 Hz,1H),8.41(d,J=8.4 Hz,1H),7.90(s,1H),7.64(t,J=7.9 Hz,1H),7.44(t,J=7.7 Hz,2H),7.34(t,J=7.4 Hz,2H),7.23(d,J=7.7 Hz,2H),6.54(d,J=8.5 Hz,2H),4.29(dd,J=10.5,6.0 Hz,2H),4.19~4.11(m,2H),3.60~3.49(m,2H),1.72(dt,J= 15.2,7.5 Hz,2H),1.49~1.26(m,6H),0.90(t,J=6.9 Hz,3H).13C NMR(101 MHz,CDCl3)δ:182.51(m),164.76(m),164.28(m),150.05 (s),134.35(s),131.19(s),130.43(s),128.16 (s),127.92(s),125.80(s),124.91(s),122.80 (m),103.28(s),46.22(s),43.39(s),40.24 (s),31.63(s),28.18(s),26.88(s),22.59(s),14.09(s).MS(ESI)m/z:475.3(M+H)+.
2.3 实验方法
配制HTN为1×10-4mol·L-1的C2H5OH/ H2O(2∶1)溶液,PA为0.02 mol·L-1的溶液,以及苯胺、苯甲醛、三硝基苯酚(TNT)、苯酚、苯乙烯、吡啶、对甲苯磺酸、甲苯、硝基苯、氯苯为2.5 ×10-3mol·L-1的溶液,使用前稀释。
光谱分析:向比色皿中加入2 mL HTN(1× 10-5mol·L-1)的C2H5OH/H2O(2∶1)溶液,依次测定其紫外-可见光谱和荧光发射光谱,确定最大吸收波长λmax和最大发射波长λem。于一系列10 mL容量瓶中分别加入1 mL HTN(1×10-4mol· L-1)的C2H5OH/H2O(2∶1)溶液,再加入1 mL的1×10-5~2×10-2mol·L-1的10个不同浓度的PA溶液,用C2H5OH/H2O(2∶1)稀释至刻度并摇匀,配制成PA浓度逐级增大的一系列HTN的C2H5OH/H2O(2∶1)溶液,用波长446 nm的光激发,测定HTN在450~800 nm的荧光发射光谱。
荧光选择性实验:在比色皿中,分别加入2 mL HTN(1×10-5mol·L-1)的C2H5OH/H2O(2∶1)溶液及常见的各种苯系物及溶剂(过量20倍),激发光波长为446 nm,分别测定每种物质加入到HTN溶液中的荧光发射光谱。
3 结果与讨论
3.1 HTN的光谱特性
分别测定HTN(1×10-5mol·L-1)的C2H5OH/H2O(2∶1)溶液的紫外-可见吸收光谱和荧光光谱,如图1所示。虽然原料4-溴-1,8-萘酐的荧光性能较弱,但修饰后的HTN发光能力显著增强。这是由于HTN分子在萘酰亚胺的4位上引入了供电子的氨基,与分子内的酰亚胺基团形成了推-拉电子体系,使之具有较高的荧光量子产率。图1中实线为HTN的UV-Vis吸收光谱,虚线为446 nm激发所得的荧光光谱。由图1可知,HTN有两个主要的吸收谱带:240~300 nm处为苯环吸收谱带;375~475 nm处为萘环的吸收谱带,其最大吸收波长λmax为446 nm。由其荧光光谱可知其最大发射波长λem为528 nm。该体系中HTN的Stokes位移值Δλ为82 nm。较大的Stokes位移可以降低激发光对发射光谱的干扰,有利于提高HTN的荧光识别能力。
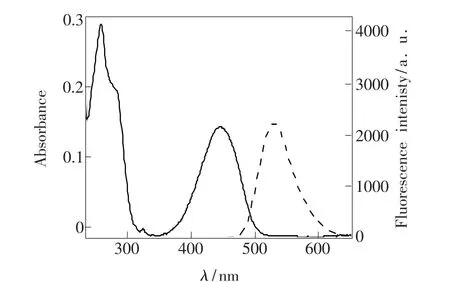
图1 化合物HTN(1×10-5 mol·L-1)在C2 H5 OH/H2 O (2∶1)溶液中的紫外-可见吸收光谱和荧光光谱Fig.1 UV-Vis and fluorescence spectra of HTN(1×10-5 mol·L-1)in C2 H5 OH/H2 O(2∶1)solution
3.2 PA对HTN光谱特性的影响
图2为加入不同浓度PA后的HTN(1×10-5mol·L-1)溶液的荧光发射光谱。加入PA后,体系在波长528 nm处的荧光强度显著下降。当PA浓度增大至2×10-3mol·L-1时,HTN溶液的荧光基本完全消失。HTN与PA作用后的荧光信号减弱是PET(光诱导电子转移)作用的结果。我们考察了HTN溶液的荧光强度猝灭率与PA浓度之间的关系,并用猝灭率与PA浓度关系作图,如图3所示。结果表明,当化合物HTN的浓度为1×10-5mol·L-1时,在1×10-6~5×10-4mol· L-1的PA浓度范围内,HTN荧光强度的猝灭率(I0-I)/I0与[PA]0.5呈线性关系,线性回归方程为:(I0-I)/I0=37.237[PA]0.5-0.0053,R2= 0.996 2。
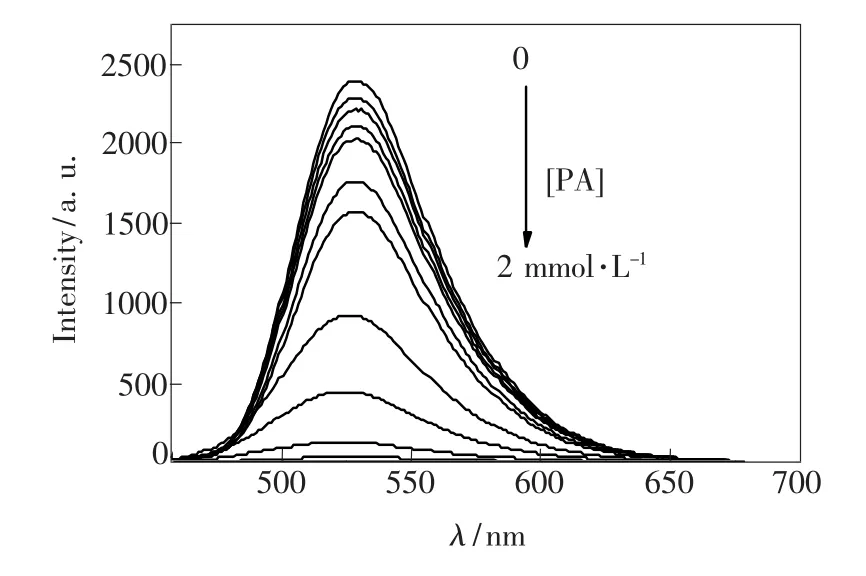
图2 PA浓度对HTN荧光光谱的影响Fig.2 Fluorescence spectra of HTN upon the addition of PA in C2 H5 OH/H2 O(2∶1)
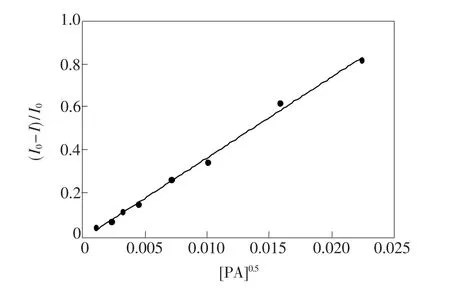
图3 HTN荧光的猝灭率与[PA]0.5的拟合曲线Fig.3 Plot of(I0-I)/I0 aganist[PA]0.5 in C2 H5OH/H2O (2∶1)
3.3 选择性测试
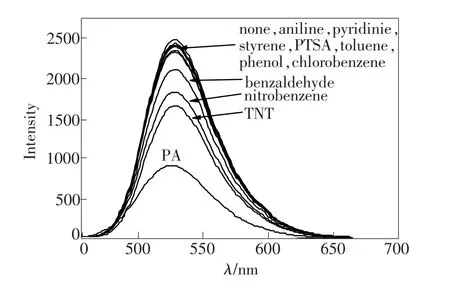
图4 常见苯系物及溶剂对HTN溶液荧光发射光谱的影响Fig.4 Fluorescence spectra responses of HTN with various benzene series and solvent(20 equiv)in C2 H5OH/H2 O
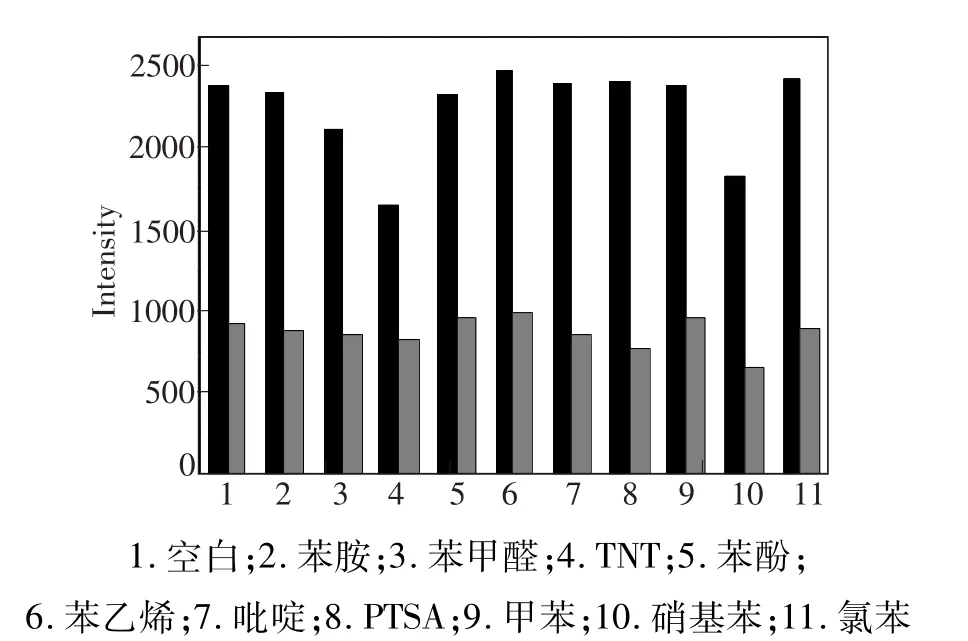
图5 HTN(1×10-5 mol·L-1)在C2 H5 OH/H2 O中对常见苯系物的选择性,λex=446 nm。黑色:20倍当量的不同苯系物共存时的HTN荧光强度;灰色:加入浓度为2×10-4 mol·L-1苦味酸后的荧光强度。Fig.5 Selectivity of HTN(1×10-5 mol·L-1)with different benzene series in C2 H5 OH/H2 O,λex=446 nm. The black bars represent the fluorescence intensity of HTN(1×10-5 mol·L-1)in the presence of 20 equiv different benzene series.The gray bars represent the fluores-cence intensity that occurs upon the subsequent addition of2×10-4 mol·L-1 PA to the solution.
本文考察了苯系物及溶剂对HTN荧光性能的影响。在HTN(1×10-5mol·L-1)的C2H5OH∶H2O(2∶1)溶液中,我们引入了不同的苯系物及溶剂并分别测定它们的荧光光谱。如图4所示,在该体系中引入常见的苯系物及溶剂,如苯胺、苯甲醛、三硝基甲苯(TNT)、苯酚、苯乙烯、吡啶、对甲苯磺酸(PTSA)、甲苯、硝基苯及氯苯等。除加入TNT和硝基苯后使HTN溶液的荧光强度略有下降外,其他均没有明显变化,只在加入PA后,HTN溶液的荧光强度才明显减弱。我们考察了PA与其他常见苯系物共存时的HTN的选择性,结果如图5所示。当常见苯系物及溶剂加入到HTN的C2H5OH/H2O溶液中时,荧光强度未产生明显的变化;但是再向该体系中加入PA时,528 nm处的荧光明显减弱。这些现象表明,在其他常见苯系物及溶剂存在的条件下,HTN对PA的识别具有较强的抗干扰能力。可见,HTN分子是一个高选择性的PA荧光探针。
4 结 论
设计并合成了一种新型萘酰亚胺荧光探针N-正己基-4-[2-(3-苯基硫脲)-乙氨基]-1,8-萘酰亚胺(HTN),其Stokes位移值达到了82 nm。该探针对PA具有较好的识别作用,通过检测探针分子荧光强度的变化可以实现对PA浓度的检测。当PA浓度在1×10-6~5×10-4mol·L-1范围内时,HTN荧光强度的猝灭率(I0-I)/I0与[PA]0.5呈线性关系,且常见的苯系物对其无显著影响。该探针结构简单、易于合成,对PA识别具有较高的灵敏度和选择性,是一种理想的PA荧光探针。
[1]Shi Y J,Ma Y X,ChuiM,et al.Determination of picric acid by gas phase chromatography[J].Inner Mongolia Petrochem.Industry(内蒙古石油化工),2014(7):9-10(in Chinese).
[2]Zhao H S,Chang M,Liu B X,etal.Quickly determination of picric acid in water by high performance liquid chromatography[J].Environmental Monitoring in China(中国环境监测),2013,29(4):135-137(in Chinese).
[3]Cui F Y,Zhou P,Wang W M,et al.Progress ofmethod for determination of picric acid in water[J].Norhern Environmental(北方环境),2013,25(7):155-158(in Chinese).
[4]Parham H,Zargar B,Rezazadeh M.Removal,preconcentration and spectorphotometric determination of picric acid in water samples usingmodifiedmagnetic iron oxide nanoparticles as an efficient absorbent[J].Mater.Sci.Eng.C,2012,32 (7):2109-2114.
[5]Singh K,Chaudhary G R,Mehta SK,et al.Synthesis of highly luminescentwater stable ZnO quantum dots as photoluminescent sensor for picric acid[J].J.Lumin.,2014,154:148-154.
[6]Huang JR,Wang L Y,Gu CP,etal.Selective detection of picric acid using functionalized reduced graphene oxide sensor device[J].Sens.Actuat.,B:Chem.,2014,196:567-573.
[7]Yun SW,Kang N Y,Park S J,et al.Diversity oriented fluorescence library approach(DOFLA)for live cell imaging probe development[J].Acc.Chem.Res.,2014,47(4):1277-1286.
[8]Sorokin A V,Zabolotskii A A,Pereverzev N V,et al.Plasmon controlled exction fluorescence ofmolecular aggregates[J].J.Phys.Chem.C,2014,118(14):7599-7605.
[9]Tanaka H,Shizu K,Nakanotani H,et al.Dual intramolecular charge-transfer fluorescence derived from a phenothiazinetriphenyltriazine derivative[J].J.Phys.Chem.C,2014,118(29):15985-15994.
[10]Chen J,He Y,Wang JA,et al.Synthesis and optoelectronic properties of aromatic polyetherswith a 1,8-naphthalimide unitmain chain[J].Chin.J.Lumin.(发光学报),2012,33(3):243-246(in Chinese).
[11]Zhang Y H,Zhang Q P,ShiW Y,et al.Synthesis and quantum chemistry study on fluorescence spectra of three 1,8-naphthalimidemonomers[J].Chin.J.Lumin.(发光学报),2011,32(5):505-513(in Chinese).
[12]Tian J,Chen B,Lv H,et al.Progress in fluorescence resonance energy transfer probes for detection of cation ions based on 1,8-naphthalimide[J].Appl.Chem.Ind.(应用化工),2014,43(2):346-352(in Chinese).
[13]Langdon-Jones E E,Symonds N O,Yates SE,et al.Fluorescent rhenium-naphthalimide conjugates as cellular imaging agents[J].Inorg.Chem.,2014,53:3788-3797.
[14]Mahato P,Saha S,Suresh E,et al.Ratiometric detection of Cr3+and Hg2+by a naphthalimide-rhodamine based fluorescent probe[J].Inorg.Chem.,2012,51:1769-1777.
[15]Panchenko P A,Fedorov Y V,Perevalov V P,et al.Cation-dependent fluorescent properties of naphthalimide derivatives with N-benzocrown ether fragment[J].J.Phys.Chem.A,2010,114:4118-4122.
Synthesis of Naphthalim ide Derivatives and Its Recognition for Picric Acid
YU Ying-hao1,DU Bin2,DING Zhi-jun2,WANG Pu-hong2,GUO Lei2,YU Jian-hua2,HU Yu-lai1*
(1.Department of Chemistry and Chemical Engineering,Northwest Normal University,Lanzhou 730070,China;2.Research Institute of Chemical Defense,Beijing 102205,China) *Corresponding Author,E-mail:huyl@nwnu.edu.cn
N-hexyl-4-[2-(3-phenyl-thiourea)-ethylamino]-naphthalimide(HTN),a naphthalimide derivative,was synthesized and its structure was determined by NMR and MS.The recognition of HTN for picric acid(PA)was investigated by fluorescence spectrum.The results show that the fluorescence intensity of HTN significantly reduceswith the increasing of PA concentration in C2H5OH/ H2O(2∶1).For PA concentration from 1×10-6mol·L-1to 5×10-4mol·L-1,the quenching rate,(I0-I)/I0,correlates linearly with[PA]0.5,and R2=0.995 5.Meanwhile,no obvious interference is observed in the presence of the benzene series such as aniline,benzaldehyd,trinitrotoluene,phenol,styrene,pyridine,p-toluenesulfonic acid,toluene,nitrobenzene and chlorobenzene,indicating HTN's excellent selectivity and high sensitivity for the detection of PA.
naphthalimide;picric acid;fluorescence spectrum;detection
1000-7032(2015)01-0039-06
O644
A
10.3788/fgxb20153601.0039
2014-10-11;
2014-11-05
国家重点基础研究发展计划(973)(2011CB706902);国家重大科学仪器设备开发专项(2011YQ150078);国家自然科学基金(21262031)资助项目

余颖昊(1987-),男,四川蓬溪人,硕士研究生,2010年于北京化工大学获得学士学位,主要从事有机化学及高分子材料合成与应用方面的研究。E-mail:xingxin9843@sina.com

胡雨来(1964-),男,甘肃静宁人,教授,1998年于中国科学院兰州化学物理研究所获得博士学位,主要从事不对称合成及有机氟化学方面的研究。E-mail:huyl@nwnu.edu.cn

