改良大鼠颈动脉内膜剥脱术模型的建立及病理形态初步观察
洪景芳,徐维华,王守森
(南京军区福州总医院神经外科,福州 350025)
改良大鼠颈动脉内膜剥脱术模型的建立及病理形态初步观察
洪景芳,徐维华,王守森
(南京军区福州总医院神经外科,福州 350025)
目的使用改良方法建立一种稳定可靠的大鼠内膜剥脱术(CEA)模型,观察术后组织形态学变化及平滑肌细胞增殖情况。方法将48只SD大鼠分为改良组和常规组,每组24只;通过切开前穿刺血管前壁和预先留置缝线建立改良CEA模型,比较两组建模成功率及建模手术时间,HE染色观察术后3 d、14 d和28 d血管壁厚度动态变化,免疫组织化学方法测量不同时期血管壁增殖细胞核抗原(PCNA)表达情况。 结果成功构建改良大鼠CEA模型。改良组建模成功率(87.5%)与常规组(79.2%)比较差异无统计学意义(P=0.46),改良组手术时间(31.2±3.7 min)显著低于常规组(40.9±4.2 min)(P=0.00);改良组术后28 d管壁厚度(258.4±20.9 μm)较术后3 d(116.3± 14.6 μm)显著增厚(P<0.01);改良组术后28 d管腔内径(309.6±32.8 μm)较术后3 d (602.8±40.5 μm)显著狭窄(P<0.01);PCNA表达在3 d为稍高表达,14 d为高表达,至28 d未见表达。结论改良的大鼠颈动脉内膜切除模型成模率高,操作简单,建模手术时间短,稳定可靠,适用于CEA术后再狭窄的研究。
颈动脉内膜剥脱术(CEA);动物模型;增殖细胞核抗原(PCNA)
在缺血性脑血管疾病中,15%~20%是由颈动脉粥样斑块形成引起的血管狭窄或闭塞所致。颈动脉内膜剥脱术(carotid endarterectomy,CEA)是目前预防缺血性脑卒中的常见手术方式[1]。CEA术后再狭窄发生率为1.1%~6.9%[2],有学者甚至认为,CEA术后动脉再狭窄发生率可高达37%[3,4]。稳定可靠的动物模型是研究CEA术后内膜增生的重要手段,作者在原有大鼠CEA模型的基础上进行了改良,取得了满意效果,现将改良大鼠CEA模型的建立及增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)在CEA术后血管壁的表达情况报告如下。
1 材料与方法
1.1实验动物
清洁级雄性SD大鼠48只,体质量250~300 g,由上海斯莱克实验动物有限责任公司提供[SCXK(沪)2012-0002],在南京军区福州总医院比较医学科动物实验室饲养并进行实验[SYXK(闽)2013-0004]。分为改良模型组和常规模型组,每组24只。
1.2主要试剂和仪器
显微持针器及显微镊,上海金钟医疗器械有限公司;手术显微镜,江苏镇江中天光学仪器有限责任公司;术中多普勒超声血流探测仪,美国VTI公司;不锈钢双面剃须刀片,上海吉列有限公司;质量分数10%水合氯醛,南京军区福州总医院药学科制剂室产品;兔抗大鼠PCNA单克隆抗体,英国Abcam公司;DAB显色试剂盒,福州迈新生物科技有限公司。
1.3建立改良CEA模型及常规CEA模型
SD大鼠术前常规禁食8 h,禁饮4 h,10%水合氯醛0.3~0.4 mL/100 g腹腔注射麻醉,仰卧位固定在手术台上,消毒颈部皮肤,铺无菌洞巾(图1)。用剪刀沿颈部正中处纵形剪开颈前皮肤,上至下颌,下至胸骨上缘,切口长约3~3.5 cm,锐性分离皮下筋膜,推开下颌下腺。以下在显微镜下操作,沿左侧胸锁乳突肌及颈前肌群间隙分离,将胸锁乳突肌向外侧牵拉,暴露左侧颈动脉鞘。钝性游离左侧颈总动脉,长约13 mm。予100 U/kg肝素大鼠尾部静脉注射行肝素化后,用无损血管夹依次夹闭左侧颈总动脉远心端及近心端(间隔10 mm)(以上步骤两组无差别,以下步骤分为改良模型组及常规模型组,详见表1所示)。术后均予青霉素20万单位肌肉注射,连用3 d。普通饲料喂养。
1.4计算建模手术时间及建模成功率
分别计算两组从开始夹闭颈动脉远、近心端到打完最后一个结松开血管夹的操作时间,定义为建模手术时间。术后即刻手术血管通畅,14 d见内膜增生,28 d后大鼠成活且管腔未完全闭塞者(多普勒超声血流探测仪探头测定有血流信号)定义为建模成功。

表 1 改良模型组与常规模型组具体操作步骤的区别
1.5动脉壁及管腔内腔的测定
术后3 d、14 d及28 d,每组各8只大鼠(死亡者除外)以质量分数10%水合氯醛麻醉后,经原切口进入并找到左侧颈动脉,分别结扎手术段血管近端和远端,取下后用肝素生理盐水冲洗,体积分数10%甲醛溶液固定,脱水、石蜡包埋后常规切片备HE染色或免疫组织化学用。每个标本取非连续的4个层面切片,HE染色后采用Image-Pro Plus 6.0软件测量动脉壁厚度及血管内腔。随机取材改良组或常规组右侧颈动脉作为正常血管对照。
1.6免疫组织化学法测定PCNA在血管壁中的表达
取材标本及时间点同上。免疫组织化学染色采用ABC法,具体操作步骤参照ABC免疫组织化学法试剂盒说明书。所用一抗为兔抗PCNA单抗,二抗为羊抗兔IgG。在每张切片上取4个区域,在显微镜(200×)下拍照,通过Image-Pro Plus 6.0图像处理软件测量每条动脉12个200倍视野下增殖细胞在平滑肌层占总细胞数百分比。计算其均值,将数值纳入统计分析。
1.7统计方法
采用SPSS13.0统计软件对实验数据进行统计分析,数据以x-± s或率(%)表示。组间建模成功率的比较采用四格表资料的χ2检验,两独立样本均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1建模情况
改良组雄性SD大鼠共24只,其中1只死于麻醉意外,1只术中多普勒超声探测仪未探及血流信号,提示颈动脉缝合后血管不通畅,考虑急性血栓形成,1只在术后次日死亡于术区血肿压迫气管,成功建模21只,建模成功率87.5%,死亡率4.2%;常规组雄性SD大鼠共24只,1只在内膜剥除后准备打结缝线时大鼠麻醉提前清醒后躁动,导致血管撕裂,1只术后即刻急性血栓形成,1只术后3 d死于局部血肿压迫,术后14 d及28 d取材发现各有1只术侧颈动脉闭塞,成功建模19只,建模成功率79.2%,死亡率4.2%。两组比较,虽然改良组建模成功率高于常规组,但差异无统计学意义(P=0.46)。
2.2建模手术时间比较
改良组平均手术时间为31.2±3.7 min,常规组平均手术时间为40.9±4.2 min,差异有统计学意义(P=0.00)。
2.3颈动脉形态学观察
颈动脉切片行HE染色,光学显微镜下观察(图2),正常大鼠颈动脉由内膜、中膜和外膜层构成,其中内膜为单层连续内皮细胞。中膜由3~5层平滑肌细胞环形排列构成,呈波浪状。CEA术后3 d,可见内膜层缺如,动脉壁吻合处平滑肌层断裂,局部见缝合线残留,管腔内壁不光滑。术后14 d,可见新生内膜形成,内膜层增厚并有较多有核细胞。术后28 d,颈动脉新生内膜明显增厚,动脉内腔明显狭窄。动脉壁厚度28 d时最大,为258.4 ±20.9 μm,与术后3 d、14 d时比较有显著统计学差异(P<0.01);管腔内径术后第28 d时最小,为309.6±32.8 μm,与术后3 d、14 d时比较有显著统计学差异(P<0.01);改良组和常规组之间形态学观察以及术后3 d、14 d、28 d时管壁厚度及管腔内径比较无统计学差异(P>0.05),详见表2。
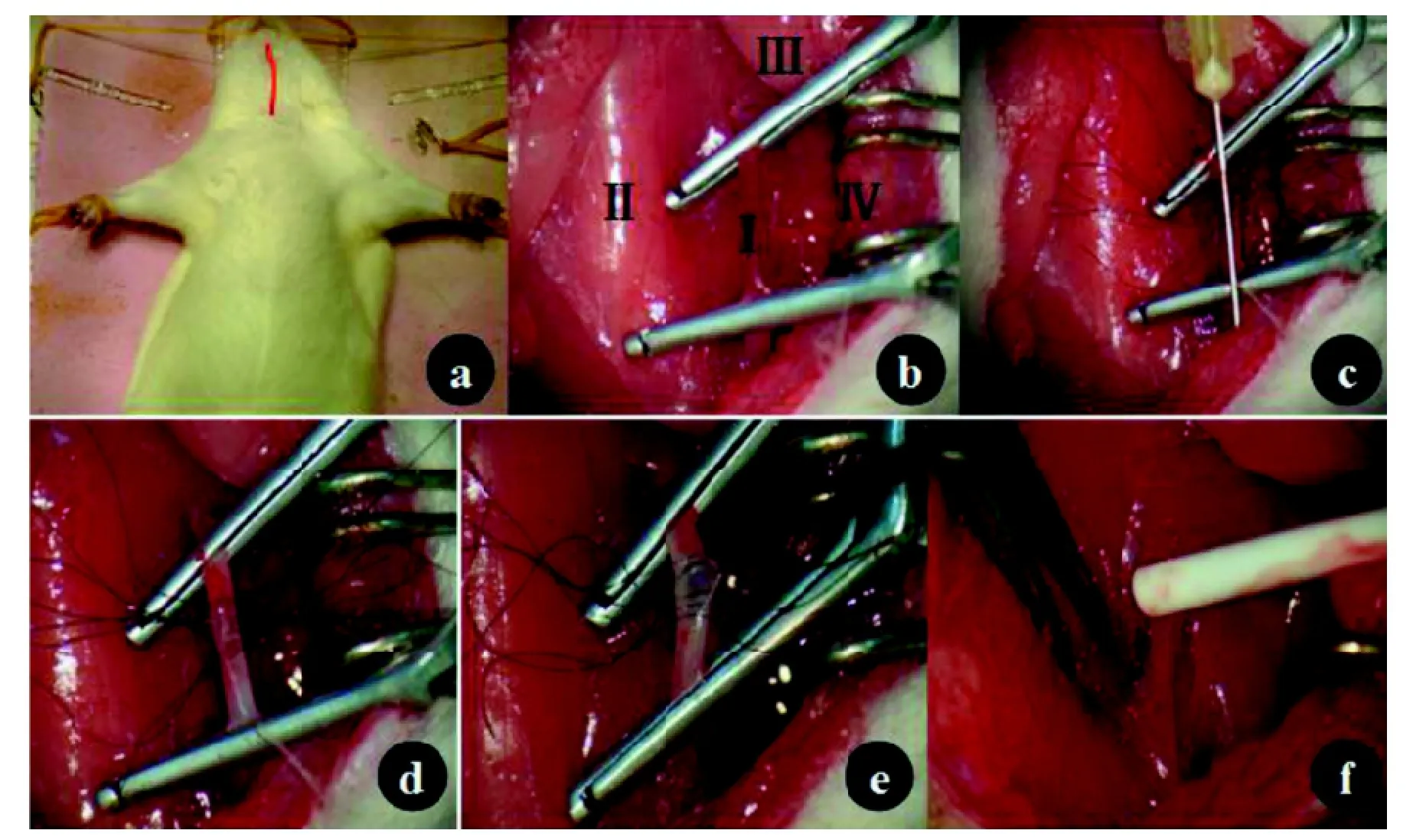
图 1 大鼠左侧颈总动脉内膜切除术

表 2 不同时间点改良及常规大鼠CEA模型管壁厚度和管腔内径的变化 μm
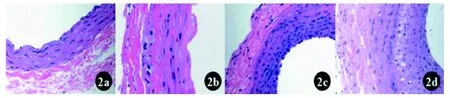
图 2 大鼠正常颈动脉和内膜切除术后不同时期HE染色(×200)
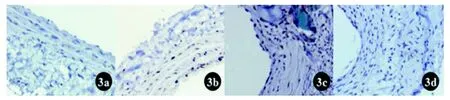
图 3 PCNA免疫组织化学染色显示增殖细胞在大鼠正常颈动脉及术后各时间点分布(×200)
2.4内膜切除颈动脉细胞增殖情况
PCNA免疫组织化学染色在血管平滑肌层可见增殖细胞散在表达,细胞核被染成棕褐色,提示抗原存在细胞核内。增殖细胞在3 d出现,14 d达高峰,以后进行性下降,至28 d增殖细胞未见表达(图3)。改良组和常规组之间术后3 d、14 d、28 d时PCNA表达情况比较无明显差异。
3 讨论
稳定可靠并与临床上CEA手术相符的动物模型是研究动脉术后再狭窄的重要工具。大鼠CEA术后再狭窄模型的建立方法主要有颈动脉内膜剥脱损伤法、球囊损伤法和气体内膜干燥损伤法,其中球囊损伤法和气体内膜干燥损伤法虽然模型制作相对简单,但与临床上CEA手术对动脉造成的损伤方式不相符[5,6],而内膜剥脱损伤法与CEA相似,在国外已经被广泛使用[7-9]。传统的造模方法为,暴露左侧颈动脉后,在显微镜下用显微剪纵形剪开动脉约6 mm,并在内膜表面划垂直切口的平行线(间距4 mm),用显微镊仔细剥除内膜层,然后再用11-0缝线缝合动脉[10]。该方法存在2个主要缺陷:①大鼠颈动脉直径细小,显微剪刀在剪开血管前壁及剥离内膜时由于血管缺乏固定较为困难,容易人为损伤血管;②由于大鼠颈动脉壁本身较薄,当内膜层被剥除后,动脉壁因失去内皮层支撑而塌陷,此时再逐针贯穿缝合动脉时对术者显微镜下缝合技术要求较高,针距线距难以保持均匀,易人为造成缝合后动脉狭窄,尤其对于刚刚接触显微外科并且是科研主力的研究生来讲往往很难娴熟操作,作者在制作常规组模型时有两例发生管腔闭塞,而改良组则没有发生,考虑人为因素造成血管狭窄致闭塞可能,因此,按照常规方法制作模型制作难度大,且稳定性相对较差。张宏伟等[11]利用金刚钻头磨除内膜制作了新的CEA模型,但该模型本质上并没有改变颈动脉缺乏固定及缝合困难的缺陷。
针对上述模型制作过程中的缺陷,本研究在原动物模型的基础上进行了改良,首先在暴露并夹闭左侧颈动脉两端后,先用针头(30G×1/2'')纵形穿刺动脉前壁,动脉前壁两穿刺点间距离约为6 mm,11-0缝线间断挂线不打结,针距约0.6 mm,边距约0.1 mm,切开颈总动脉后,通过挂线之间的广泛空间进行剥离内膜的操作,内膜完全剥离后,将原先留置的11-0缝线相应两端依次打结。这种方法的优点:①通过细针头穿刺血管前壁很好地固定了颈动脉;②在切开前壁及剥除内膜前预先间断缝合挂线时针距、线距非常均匀合理,③改用消毒灭菌剃须刀片沿穿刺针切开不会损伤血管后壁,且切口平直损伤小。实验结果证实,改良后的方法能有效避免因缝合因素引起的动脉狭窄,大大降低了手术操作难度,减少了手术时间。该方法稳定性好,简单易重复。虽然统计学显示两组之间建模成功率无显著统计学差异,但改良组中发生急性血栓形成管腔闭塞及早期闭塞的仅1例,而常规组中共有3例,统计学无显著差异可能与实验动物数量相对较少有关。切片病理染色提示损伤后3 d, 内膜层剥离完整,14 d时新生内膜生成,新生内膜含有较多增殖细胞,28 d时新生内膜层进一步增厚,管腔明显狭窄,动脉壁厚度术后3 d、14 d比较增厚有显著差异(P<0.01)。这些病理改变与Bledsoe等[12]报道的动脉内膜损伤后内膜增生、动脉狭窄的病理改变相符,而且改良组和常规组比较形态学无明显差异,证实成功建立改良大鼠颈动脉内膜剥脱模型。
本研究在模型制作中的创新点是:在动脉切开前预先纵行穿刺血管前壁及留置缝线,容易控制缝合的边距和间距。当内膜剥除完整后,将事先留置的缝线相应打结,有效避免了因缝合导致的动脉狭窄,提高了手术时间,大大降低了手术难度,提高了造模成功率。其它的经验包括:①水合氯醛麻醉效果稳定,优于氯胺酮、戊巴比妥钠、乙醚等其它麻醉剂;②术中肝素化,切开动脉壁后用肝素盐水冲洗清洁管腔;③使用针头在内膜上划平行线时要轻柔,尽量避免损伤动脉中膜层。
本研究通过改良方法成功建立大鼠颈动脉内膜剥脱模型,对术后不同时期血管内膜增生情况进行了连续、动态观察。血管中膜平滑肌细胞的增殖、迁移和表型转化是CEA术后新生内膜的主要成分,PCNA可以评估新生内膜的增殖状态[13]。从PCNA在动脉壁分布情况来看,术后3 d动脉壁存在较多增殖细胞,术后14 d增殖细胞在动脉壁中的含量达最高峰,术后28 d动脉壁增殖细胞含量显著减少,提示术后内膜增生主要发生在28 d以内,故防治术后再狭窄应侧重于早期。
[1] Halliday A,Harrison M,Hayter E,et al. 10-year stroke prevention after successful carotid endarterectomy for asymptomatic stenosis (ACST-1): a multicentre randomised trial[J]. Lancet,2010,376(9746):1074-1084.
[2]De Rango P,Parlani G,Verzini F,et al. Long-term prevention of stroke: a modern comparison of current carotid stenting and carotid endarterectomy[J]. J Am Coll Cardiol,2011,57 (6):664-671.
[3]Sadideen H,Taylor PR,Padayachee TS. Restenosis after carotid endarterectomy[J]. Int J Clin Pract,2006,60(12): 1625-1630.
[4] Fluri F,Engelter ST,Wasner M,et al. The probability of restenosis,contralateral disease progression,and late neurologic events following carotid endarterectomy: a long-term follow-up study[J]. Cerebrovasc Dis,2008,26(6):654-658.
[5]Tulis DA. Rat carotid artery balloon injury model[J]. Methods Mol Med,2007,139:1-30.
[6]王凯,金凤,王涛,等. 高脂喂养加干燥气体损伤构建颈动脉狭窄动物模型[J]. 国际神经病学神经外科学杂志,2009,36(02):109-114.
[7]Nyalala JO,Luo S,Campbell DN,et al. The effects of acarbose treatment on intimal hyperplasia in a rat carotid endarterectomy model of diet-induced insulin resistance[J]. Vasc Endovascular Surg,2010,44(7):560-567.
[8]Nyalala JO,Brown AT,Luo S,et al. Estrogen replacement attenuates exaggerated neointimal hyperplasia following carotid endarterectomy in rats[J]. Vasc Endovascular Surg,2011,45(8):720-726.
[9]Kalapatapu VR,Satterfield L,Brown AT,et al. The effects of Toradol on postoperative intimal hyperplasia in a rat carotid endarterectomy model: laboratory research[J]. Vasc Endovascular Surg,2007,41(5):402-408.
[10] Southern FN,Cruz N,Fink LM,et al. Hyperhomocysteinemia increases intimal hyperplasia in a rat carotid endarterectomy model[J]. J Vasc Surg,1998,28(5):909-918.
[11] 张宏伟,鲍圣德. 改良大鼠颈动脉内膜剥脱模型的建立及其VCAM-1表达[J]. 中国微侵袭神经外科杂志,2008,13 (09):412-414.
[12] Bledsoe SL,Brown AT,Davis JA,et al. Effect of clopidogrel on platelet aggregation and intimal hyperplasia following carotid endarterectomy in the rat[J]. Vascular,2005,13(1): 43-49.
[13] Huang L,Zhang SM,Zhang P,et al. Interferon regulatory factor 7 protects against vascular smooth muscle cell proliferation and neointima formation[J]. J Am Heart Assoc,2014,3(5):e001309.
Establishment of Modified Rat Carotid Endarterectomy Model and Preliminary Observation on Changes of Pathological Morphology
HONG Jing-fang,XU Wei-hua,WANG Shou-sen
(Department of Neurosurgery,Fuzhou General Hospital,Nanjing Command,Fuzhou 350025,China)
ObjectiveTo establish a steady and reliable rat model of carotid endarterectomy (CEA)by improved method,and to explore the changes of pathological morphology of vascular wall and proliferation of vascular smooth muscle cells after CEA. MethodsForty-eight SD rats were divided into two groups with 24 rats in each group (modified CEA group and conventional CEA group). The modified model was created by puncturing the carotid artery with a thin needle and detaining sutures before a longitudinal arteriotomy was performed;The success rate of modeling and the operation time were observed to evaluate the characteristics and reliability of two models. HE staining was performed to measure dynamic changes of the thickness of the vascular walls and immunohistochemistry was used to find expression of proliferating cell nuclear antigen (PCNA) on vessel wall on 3 days,14 days and 28 days after operation. ResultThe model of rat carotid endarterectomy were successfully constructed. There was no significant difference in the success rate of modeling between two groups (87.5% vs 79.2%,P=0.46). The operation time (31.2±3.7 min) of modified group was significantly lower than that (40.9± 4.2 min) of conventional group (P=0.00). Twenty-eight days after the operation,the thickness of the artery and the luminal diameter were significantly different from those of 3 days after the operation in modified group. The positive expression of PCNA was slightly higher on 3 days after operation,the highest on 14 days,and there was no positive expression on 28 days. ConclusionModified rat carotid endarterectomy model has the characters of high success rate and simple handling,short operation time,and as a steady and reliable model,it is suitable for the study of restenosis after CEA.
Carotid endarterectomy(CEA);Animal models;Proliferating Cell Nuclear Antigen(PCNA)
Q95-33
A
1674-5817(2015)03-0182-06
10.3969/j.issn.1674-5817.2015.03.002
2014-12-01
福建省科技计划重点项目(2014Y0036)
洪景芳(1976-),男,博士,主治医师,研究方向: 脑血管病的临床和基础研究,E-mail: yellowcard2001@163.com
王守森(1965-),男,博士,主任医师,研究方向: 脑血管病和脑肿瘤,E-mail: wshsen126@126.com

