Hnrnpu+/-小鼠表现出发育迟缓、活动水平下降和糖代谢异常
孙 敏,沙海波,屠 鑫,邹耩欢,赖贝贝,高 翔,齐 心
(1. 上海交通大学医学院医学遗传学教研室,上海200025;2. 南京大学模式动物研究所教育部重点实验室,南京210061)
·论著·
Hnrnpu+/-小鼠表现出发育迟缓、活动水平下降和糖代谢异常
孙敏1,2,沙海波2,屠鑫2,邹耩欢2,赖贝贝2,高翔1,2,齐心2
(1. 上海交通大学医学院医学遗传学教研室,上海200025;2. 南京大学模式动物研究所教育部重点实验室,南京210061)
目的建立核异质核糖核蛋白U(hnRNP U)基因全身性敲除小鼠模型,研究该基因在小鼠体内的功能。方法通过同源重组的方法建立hnRNP U全身性敲除的小鼠模型。观察统计小鼠的出生以及生长情况,检查其组织器官发育,通过代谢笼检测其代谢水平,并用糖耐量试验检测其糖代谢变化。结果hnRNP U全身性敲除纯合子小鼠(Hnrnpu-/-)死于胚胎期7.5 d前,而其杂合子小鼠也有部分在胚胎期死亡,出生的杂合子小鼠表现为生长发育迟缓、部分组织的重量减轻、骨密度降低以及肌肉含量减少。进一步实验表明,Hnrnpu+/-小鼠夜间进食量、活动水平和产热量等降低,糖代谢能力下降。结论通过同源重组方法成功建立hnRNP U全身性敲除小鼠模型,并在整体水平证实了该基因在小鼠发育和代谢稳态调节中起重要作用。
核异质核糖核蛋白U(hnRNP U);基因敲除;发育迟缓;代谢异常;糖代谢
核异质核糖核蛋白U(Heterogeneous nuclear ribonucleoprotein U,hnRNP U)也被称为脚手架附着因子A(scaffold attachment factor A,SAF-A),是最早被发现是在HeLa细胞广泛表达的核脚手架成分之一[1]。它作为核异质核糖核蛋白家族中的一员[2],对细胞内活动有广泛作用,包括与RNA聚合酶II形成剪切复合体调节核内mRNA的转录,调节pre-mRNA的加工以及对细胞内mRNA翻译过程起作用等等[3]。hnRNP U由825个氨基酸组成[4],其中N端富含酸性残基(被称为骨架附着区),是DNA结合区域,而C端包含一个由26 个氨基酸构成的区域,这个区域富含甘氨酸,天冬氨酸和精氨酸[5,6],是RNA结合位点[7]。
hnRNP U对前体mRNA的剪切有重要调节作用。它与snRNA形成的复合物是前体-mRNA内含子剪切所必须的[8,9]。hnRNP U能被招募到X染色体上从而帮助Xist附着X染色体上,该过程对X染色体失活起着重要作用[10]。另外,hnRNP U还参与细胞中其他重要的生理和生化活动[11,12]。其对DNA有丝分裂中极光激酶A(Aurora-A)和纺锤体的附着[13]、肢端发育中的音猬因子(Shh)表达[14]、mRNA的稳定[15]和转录调节[16]等方面起着重要作用。Hnrnpu在人类中位于一号染色体长臂44位点,由14个外显子组成。在一些说话迟缓、癫痫、智障、头小畸形、颅面畸形、四肢异常,以及深度检查(核磁共振和基于比较基因组单核苷酸序列分析)之后发现大脑胼胝体异常的病人中,都检测到它们位于1号染色体上的包含了Hnrnpu的这一段基因是缺失的[17]。 Caliebe 等[18]和 Zaki 等[19]也观察到Hnrnpu的类似的缺失。
尽管已有报道表明,hnRNP U在调节细胞的生长和活动方面有重要作用,但是关于其体内功能的研究还不是很清楚。作者通过同源重组基因打靶的方法,得到了Hnrnpu全身性敲除小鼠并研究了hnRNP U的体内功能。
1 材料与方法
1.1实验动物
所用小鼠由南京大学模式动物研究所提供[SCXK(苏)2010-0001] 并在南京大学模式动物研究所机构动物管理和使用委员会的准则下进行实验。小鼠均为C57BL/6背景的SPF级,并用普通饲料饲养在12 h明/暗周期中[SYXK(苏)2010-0003]。实验中所用的小鼠年龄和性别均在图例中说明。
1.2Hnrnpu+/-打靶载体的构建及敲除小鼠制备
使用细菌人工染色体(BAC)套取的方法构建了基因打靶载体[20]。包含Hnrnpu基因的 129/S6 BAC克隆来自于英国桑格研究所。作者通过包含两个同源臂的套取载体套取得到Hnrnpu 基因。5' loxP位点被导入基因的第三个外显子上游,3' loxP位点(包含frt-Neo-frt筛选标记)位于基因第5个外显子的下游。打靶载体包含一个胸苷激酶(thymidine kinase)作为符筛选标记。
Hnrnpu基因打靶载体用Not I线性化后电转到小鼠全能干细胞中。经过G418抗性的筛选得到克隆并进行PCR筛选。筛选得到发生同源重组的G-418抗性的克隆将经过southern blot进行验证[20]。接着,验证后的克隆显微注射到C57BL/6J囊胚中以得到嵌合小鼠。将嵌合小鼠和C57BL/6J交配,并对产生的子代小鼠进行基因鉴定来验证性腺传递并得到Hnrnpuflox/+小鼠。为了进一步敲除Hnrnpu基因,作者将Hnrnpuflox/+小鼠与全身表达Cre环化重组酶的EIIa-Cre转基因小鼠(a germ cell-specific Cre line,# 003314,JAX lab,USA)进行繁育。PCR鉴定Cre介导Hnrnpu基因第4到第6个外显子的敲除。
1.3小鼠的身体成分和骨密度的分析
为了获得小鼠的身体成分,作者通过双能X射线吸收(DEXA)系统(GE Medical System Lunar,Madison,WI)进行小鼠全身的测量。脂肪含量,瘦肉含量和骨密度是去除了头和尾的计算值。脑、心、脾、肾、睾丸和附睾等组织的重量是通过分离各个组织后称重得到的。
1.4代谢实验
小鼠单只饲养在综合实验室动物监测系统(CLAMS system)(Columbus Instruments,USA)中进行小鼠进食、活动、氧气消耗、二氧化碳产出和产热量的测量。光照和饮食都与正常饲养条件一致。
1.5葡萄糖耐耐量试验
通过葡萄糖耐量试验(GTT)检测小鼠的糖代谢的能力。所有血样来自于小鼠的尾部。使用京都1640血糖仪(Super Glucocard II,Arkray,Japan)对小鼠的血糖值进行测量。GTT中,小鼠禁食16 h后腹腔注射2 g/kg D-(+)-葡萄糖并且在0 min、15 min、30 min、60 min、90 min、120 min后检测血糖变化。
1.6统计方法
数据以平均值±标准误差表示,n为小鼠的数量。组间比较通过双尾t-检验,P<0.05为差异有统计学意义。
2 结果
2.1Hnrnpu全身性敲除纯合子小鼠是胚胎致死的
将与Hnrnpu+/-雄鼠交配后妊娠的Hnrnpu+/-雌鼠子宫内的胚胎取出进行基因鉴定分析,发现从胚胎期7.5 d到11.5 d都没有纯合子的胚胎,只有杂合子和野生型的小鼠胚胎(表1)。另外,出生的Hnrnpu-/-小鼠的比例和胚胎的比例都明显低于孟德尔遗传定律的比例(表2)。这些结果表明,Hnrnpu全部缺失或者一半缺失都影响了小鼠的正常存活。
2.2Hnrnpu+/-小鼠表现出生长发育迟缓
发现出生后8 d的Hnrnpu+/-小鼠看上去比同窝野生型小鼠小(图1 A)。通过跟踪测量从出生后一周到五个月雄鼠的体长,发现Hnrnpu+/-小鼠从出生后就明显的比同窝野生型小鼠小,在一周时只有野生型雄鼠体长的90%左右,到了五个月时增加到野生型雄鼠体长的93%(图1 B)。同时,统计了从小鼠离乳(3周龄)到3月龄时小鼠体质量,发现Hnrnpu+/-雄鼠,离乳时就明显比同窝野生型小鼠要轻(图1 C)。通过X光射线检测小鼠的胫骨长度,也发现Hnrnpu+/-小鼠的胫骨长度比野生型小鼠的胫骨要短(图1 D)。
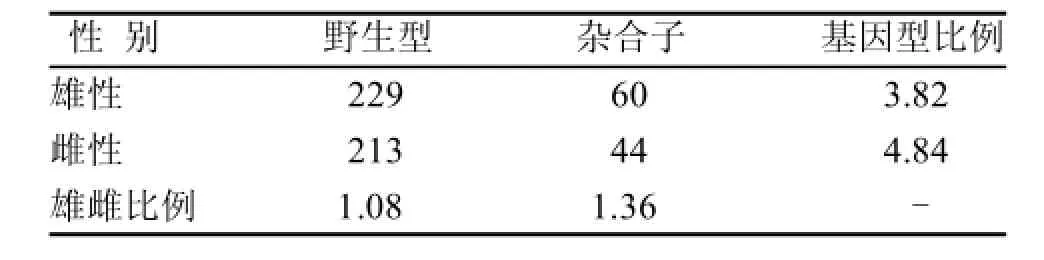
表 2 Hnrnpu+/-雄鼠和C57BL/6J雌鼠交配得到的出生后代的基因型统计
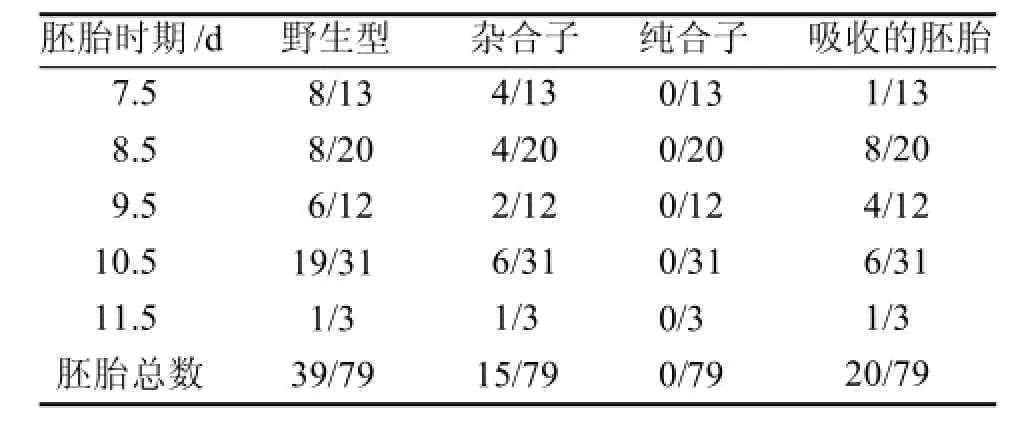
表 1 Hnrnpu+/-雄鼠和Hnrnpu+/-雌鼠交配得到的胚胎的基因型统计
统计了Hnrnpu+/-成年雄鼠的各个组织器官的重量后发现,除了肝脏外,Hnrnpu+/-成年雄鼠的其他组织(脑、心、脾、肾、睾丸和附睾)的重量明显低于同窝野生型对照的重量(图1 E)。通过与小鼠体质量比较发现,Hnrnpu+/-成年雄鼠的脑重体质量比明显比同窝野生型的要大,但是其睾丸重量体质量比却明显小于同窝野生型小鼠(图1 F)。
2.3Hnrnpu+/-小鼠有较低的骨密度及瘦肉含量
通过X光透射检测小鼠的骨骼形态是否异常,发现Hnrnpu+/-小鼠(不管是雄鼠还是雌鼠)在骨骼的形态或者不对称发育方面与同窝野生型对照小鼠相比并没有明显的差异(图2 A)。但是,不管是雄性还是雌性,成年的Hnrnpu+/-小鼠的骨矿物质含量都明显的低于同窝野生型对照小鼠(图2 B)。同时,其骨矿物质密度也明显的比对照小鼠要低(图2 C)。小鼠的体内脂肪和瘦肉含量,脂肪含量和比例在成年的Hnrnpu+/-小鼠和同窝野生型对照小鼠中并没有显著的差异(图2D)。但是,成年的Hnrnpu+/-小鼠的瘦肉含量却明显低于同窝野生型对照小鼠(图2 E)。这些结果表明,Hnrnpu+/-小鼠有较低的骨密度和瘦肉含量。
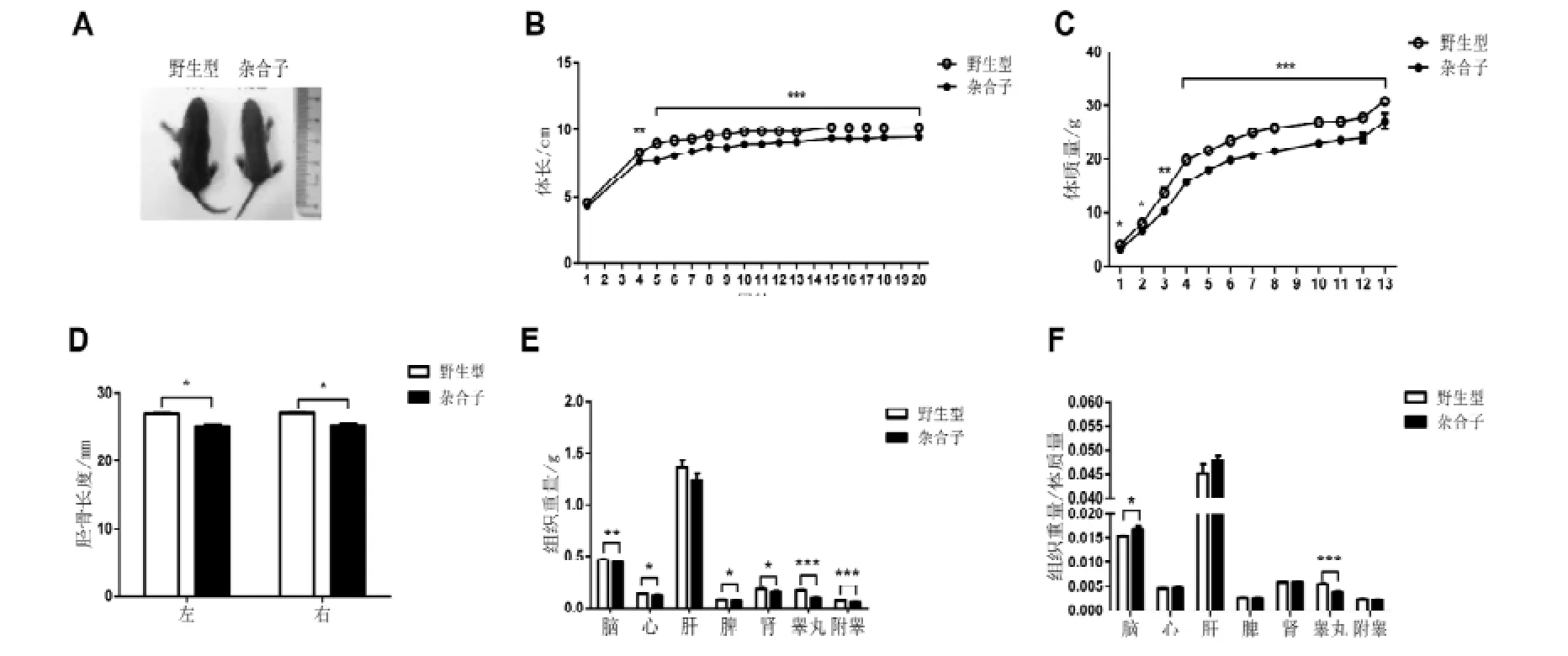
图 1 Hnrnpu+/-小鼠表现出生长发育迟缓
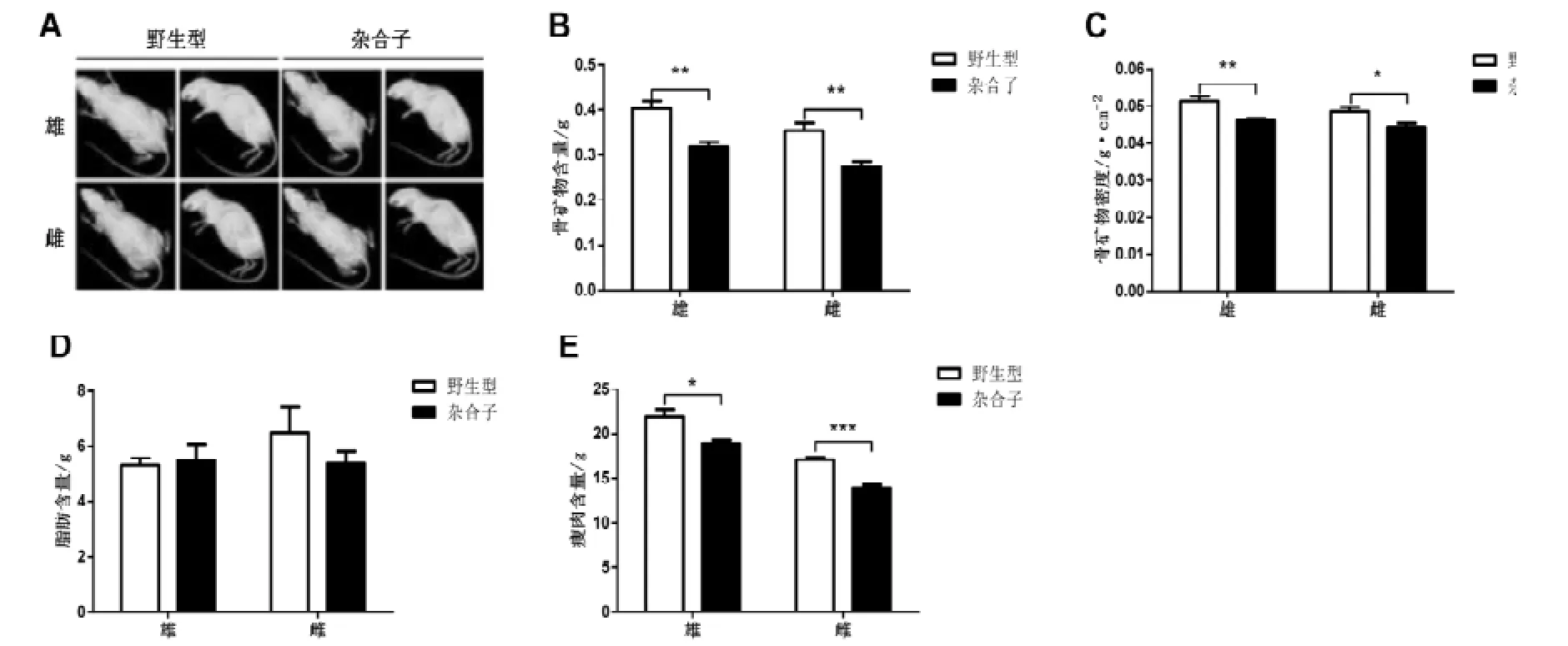
图 2 Hnrnpu+/-小鼠表现有降低的骨密度及瘦肉含量
2.4Hnrnpu+/-小鼠夜间代谢和活动水平降低
实验表明,Hnrnpu+/-小鼠的氧气消耗与同窝野生型对照小鼠相比没有明显的区别(图3 A)。其总的二氧化碳产生与同窝野生型对照小鼠相比也没有明显的差异,但是在晚上的时候有显著的减少(图3 B)。反应小鼠能量消耗途径的呼吸熵并没有明显的区别(图3 C)。Hnrnpu+/-小鼠总的进食量与野生型对照相比并没有明显区别。但是,Hnrnpu+/-小鼠在夜间的进食量明显比同窝野生型对照小鼠要少,大约只有野生型对照的72%(图3 D和E)。同时其活动量在晚上也是比对照小鼠明显的减少了(图3 F和G)。Hnrnpu+/-小鼠的总体产热水平也明显少于比野生型对照的量,尤其是在夜间,只有野生型的83%(图3 H 和I)。这些结果表明,Hnrnpu单倍剂量不足影响小鼠代谢活动的稳态,尤其是对夜间小鼠的摄食和活动水平有显著的抑制作用。
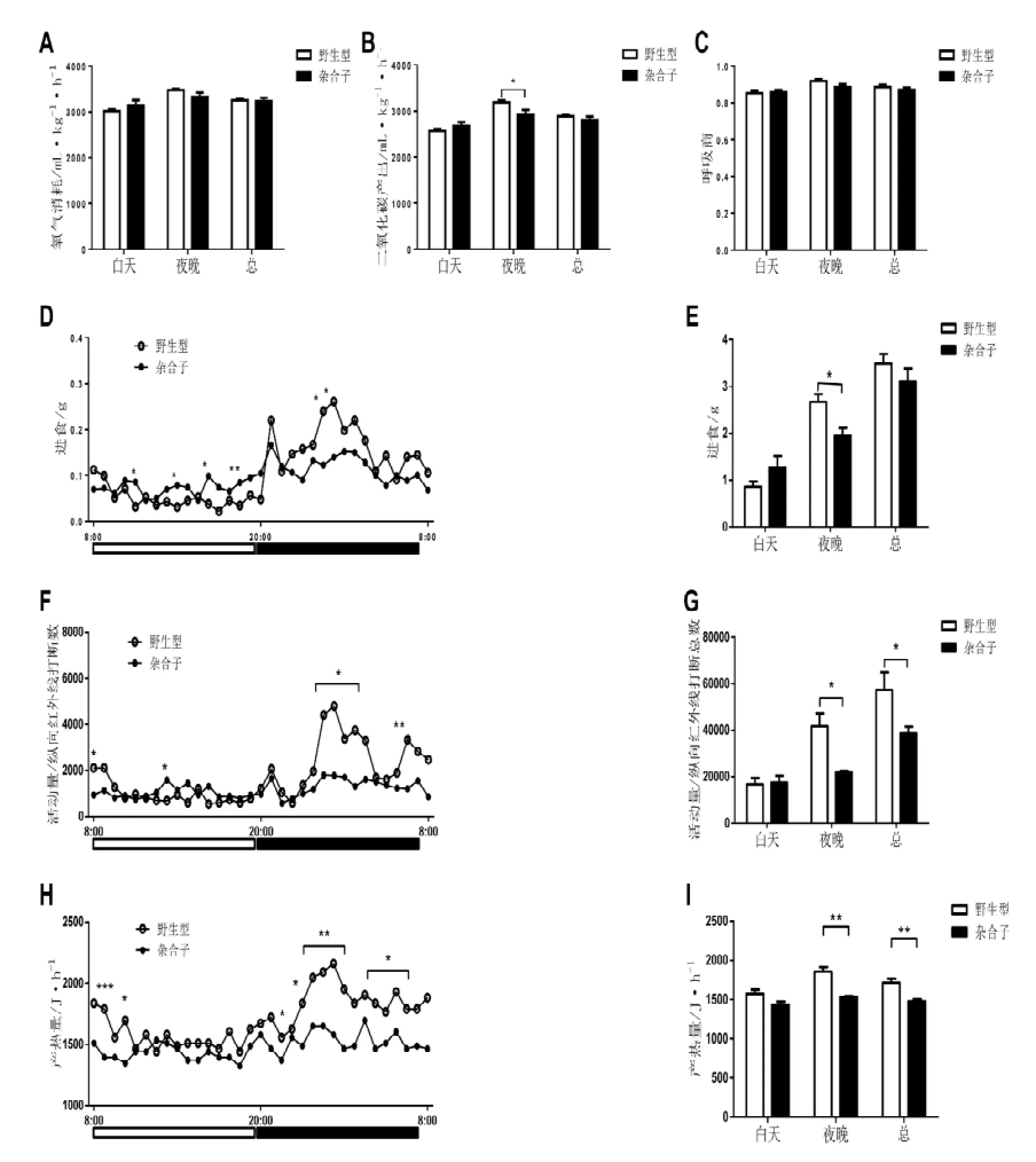
图 3 Hnrnpu+/-小鼠表现出夜间代谢水平降低
2.5Hnrnpu+/-小鼠表现出变差的糖代谢能力
结果表明,Hnrnpu+/-成年雄鼠在腹腔注射了2 g/kg的葡萄糖之后,从30 min开始,其血糖值要明显高于野生型对照鼠,一直到120 min才逐渐下降至野生型小鼠的血糖值水平(图4 A)。这说明Hnrnpu+/-雄鼠的清除血糖的能力明显变差了。同样,在Hnrnpu+/-成年雌鼠也有同样的糖代谢变差的异常(图4 B)。这些结果表明,Hnrnpu单倍剂量不足降低了小鼠的糖代谢的能力。
3 讨论
本文作者首次建立了核异质核糖核蛋白U (hnRNP U)基因全身性敲除的小鼠模型。作者发现,Hnrnpu-/-小鼠死于胚胎期7.5 d前,而Hnrnpu+/-小鼠也有部分胚胎死亡,出生后的杂合子小鼠表现明显的发育迟缓。其表现出若干个共济失调毛细血管扩张症(Ataxia-telangiectasia,A-T)的特点,包括发育迟缓、活动水平的降低和血糖代谢能力的不足等。这些结果表明,hnRNP U对小鼠的生长发育,活动的调节和代谢的稳态体起着至关重要的作用。
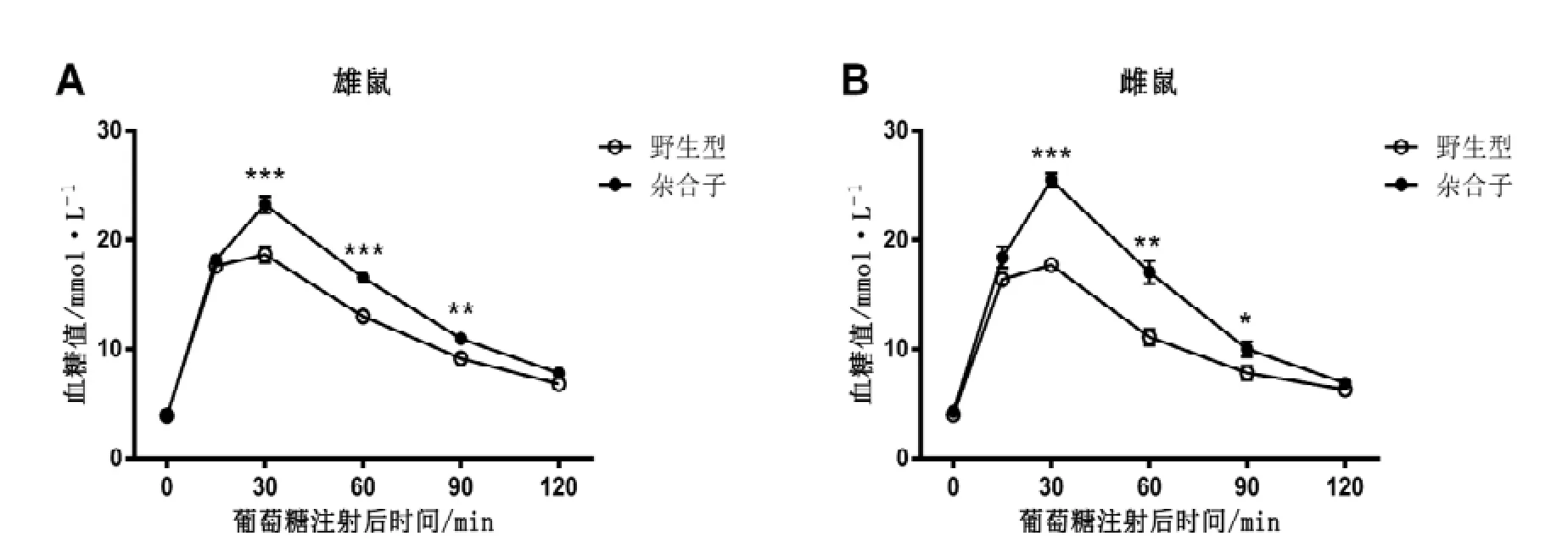
图 4 Hnrnpu+/-小鼠糖代谢能力下降
Roshon和Ruley[21]观察到hnRNP U突变的纯合子小鼠胚胎致死。早在胚胎期6.5 d,纯合子突变胚胎开始出现生长异常。到了7.5 d,突变胚胎较小于对照胚胎(主要表现为欠发育的胚胎外胚层)。最后这些突变的胚胎在发育的第10日被吸收。而之前的报道表明,Hnrnpu点突变的纯合子死于胚胎期。作者的结果与之一起证实了hnRNP U对小鼠早期的胚胎发育起着至关重要的作用。
为了解释Hnrnpu+/-小鼠的表型,作者首先考虑Hnrnpu在mRNA剪切过程中的重要作用。hnRNP U通过RNA聚合酶II结合形成剪切复合体,能够确保正确的外显子的剪切,从而来减少错误的mRNA的合成。大约有一半的可变剪切的前体mRNA是由核异质核糖核蛋白家族来完成这个过程,当然也包括hnRNP U。hnRNP U可能通过调节下游重要基因的mRNA剪切从而影响小鼠的发育和代谢活动,hnRNP U还可以调节运动神经元存活基因(SMN)的剪切从而影响新生儿的脊髓性肌萎缩。在作者的研究中,Hnrnpu+/-小鼠表现了肌肉减少和活动下降,这和SMN基因的剪切受抑制引起的脊髓性肌萎缩相吻合。这暗示,hnRNP U单倍剂量不足就可以导致SMN的剪切问题从而导致肌肉的发育障碍。另外,hnRNP U还可以调节Caspase 9a 和Caspase 9b的剪切比例影响细胞的凋亡过程。作者的结果表明,Hnrnpu+/-小鼠表现了组织发育的缺陷,并表现有增加的凋亡细胞(数据未列出)。这很可能是由于hnRNP U单倍剂量不足引起Caspase 9a 和Caspase 9b的剪切比例从而引起的凋亡增加。这些分子机制还不清楚,需要进一步确认和研究。
总之,作者的工作揭示了hnRNP U是小鼠体内组织发育、活动调节和糖代谢稳态等活动所必需的。这为证实Hnrnpu在小鼠发育的调节和维持代谢稳态中发挥了重要的作用提供了体内的证据,为研究人类发育迟缓和代谢等疾病(如A-T)提供了很好的疾病模型。
(致谢: 感谢张明坤,朱权凤和王桂琴在载体构建和小鼠繁育方面的帮助)。
[1]Romig H,Fackelmayer FO,Renz A,et al. Characterization of SAF-A,a novel nuclear DNA binding protein from HeLa cells with high affinity for nuclear matrix/scaffold attachment DNA elements[J]. EMBO J,1992,11(9):3431-3440.
[2]Kukalev A,Nord Y,Palmberg C,et al. Actin and hnRNP U cooperate for productive transcription by RNA polymerase II[J]. Nat Struct Mol Biol,2005,12(3):238-244.
[3]Howell M,Borchers C,Milgram SL. Heterogeneous nuclear ribonuclear protein U associates with YAP and regulates its co-activation of Bax transcription[J]. J Biol Chem,2004,279(25):26300-26306.
[4] Han SP,Tang YH,Smith R. Functional diversity of the hnRNPs: past,present and perspectives[J]. Biochem J,2010,430(3):379-392.
[5]Fackelmayer FO,Dahm K,Renz A,et al. Nucleic-acid-binding properties of hnRNP-U/SAF-A,a nuclear-matrix protein which binds DNA and RNA in vivo and in vitro[J]. Eur J Biochem,1994,221(2):749-757.
[6]Krecic AM,Swanson MS. hnRNP complexes: composition,structure,and function[J]. Curr Opin Cell Biol,1999,11(3): 363-371.
[7] Bandziulis RJ,Swanson MS,Dreyfuss G. RNA-binding proteins as developmental regulators[J]. Genes Dev,1989,3 (4):431-437.
[8]Xiao R,Tang P,Yang B,et al. Nuclear matrix factor hnRNP U/SAF-A exerts a global control of alternative splicing by regulating U2 snRNP maturation[J]. Mol Cell,2012,45(5): 656-668.
[9]Vu NT,Park MA,Shultz JC,et al. hnRNP U enhances caspase-9 splicing and is modulated by AKT-dependent phosphorylation of hnRNP L[J]. J Biol Chem,2013,288,8575-8584.
[10] Pullirsch D,Hartel R,Kishimoto H,et al. The Trithorax group protein Ash2l and Saf-A are recruited to the inactive X chromosome at the onset of stable X inactivation[J]. Development,2010,137(6):935-943.
[11] Zhao W,Wang L,Zhang M,et al. Nuclear to cytoplasmic translocation of heterogeneous nuclear ribonucleoprotein U enhances TLR-induced proinflammatory cytokine production by stabilizing mRNAs in macrophages[J]. J Immunol,2012,188(7):3179-3187.
[12] Banerjee D,Mandal SM,Das A,et al. Preferential repair of oxidized base damage in the transcribed genes of mammalian cells[J]. J Biol Chem,2011,286(8):6006-6016.
[13] Ma N,Matsunaga S,Morimoto A,et al. The nuclear scaffold protein SAF-A is required for kinetochore-microtubule attachment and contributes to the targeting of Aurora-A to mitotic spindles[J]. J Cell Sci,2011,124(Pt 3):394-404.
[14] Zhao J,Ding J,Li Y,et al. HnRNP U mediates the long-range regulation of Shh expression during limb development[J]. Hum Mol Genet,2009,18(16):3090-3097.
[15] Yugami M,Kabe Y,Yamaguchi Y,et al. hnRNP-U enhances the expression of specific genes by stabilizing mRNA[J]. FEBS Lett,2007,581(1):1-7.
[16] Gao C,Guo H,Mi Z,et al. Transcriptional regulatory functions of heterogeneous nuclear ribonucleoprotein-U and -A/B in endotoxin-mediated macrophage expression of osteopontin[J]. J Immunol,2005,175(1):523-530.
[17] Thierry G,Beneteau C,Pichon O,et al. Molecular characterization of 1q44 microdeletion in 11 patients reveals three candidate genes for intellectual disability and seizures[J]. Am J Med Genet A,2012,158A(7):1633-1640.
[18] Caliebe A,Kroes HY,van der Smagt JJ,et al. Four patients with speech delay,seizures and variable corpus callosum thickness sharing a 0.440 Mb deletion in region 1q44 containing the HNRPU gene[J]. Eur J Med Genet,2010,53(4): 179-185.
[19] Zaki MS,Gillessen-Kaesbach G,Vater I,et al. Bladder exstrophy and extreme genital anomaly in a patient with pure terminal 1q deletion: expansion of phenotypic spectrum [J]. Eur J Med Genet,2012,55(1):43-48.
[20] Gu P,Qi X,Zhou Y,et al. Generation of Ppp2Ca and Ppp2Cb conditional null alleles in mouse[J]. Genesis,2012,50(5): 429-436.
[21] Roshon MJ,Ruley HE. Hypomorphic mutation in hnRNP U results in post-implantation lethality[J]. Transgenic Res,2005,14(2):179-192.
hnRNP U Haploinsufficiency Leads to Growth Retardation,Decreased Activities and Abnormal Glucose Metabolism in Mice
SUN Min1,2,SHA Hai-bo2,TU Xin2,ZOU Jiang-huan2,LAI Bei-bei2,GAO Xiang1,2,QI Xin2
(1. Department of Medical Genetics Shanghai Jiao Tong University School of Medicine,Shanghai,200025. China;2. MOE Key Laboratory of Model Animal for Disease Study,Model Animal Research Center,Nanjing University,Nanjing 210061,China)
ObjectiveTo establish a heterogeneous nuclear ribonucleoprotein U (HnRNP U) knockout mouse model and study the roles of hnRNP U in vivo. MethodsThe Hnrnpu conventional knockout mouse model was established by homologous recombination. The roles of hnRNP U in vivo were studied by growth analyses,body and tissues weighting,metabolic analyses and glucose tolerance tests. ResultsThe Hnrnpu-/-mice are embryonic leathal before embryonic day 7.5. The Hnrnpu+/-mice were partially died at embryonic stage and the viable individuals showed growth retardation with decreased tissues weight,bone mineral density and lean mass compared with wild-type littermates. In addition,hnRNP U haploinsufficiency leads to decreased activity and food intake at night and impaired glucose homeostasis. ConclusionHnrnpu knockout mouse model was successfully established and hnRNP U played a great role in a diverse group of cellular processes,including the normal growth of somatic tissues,metabolic activities and glucose metabolism.
Heterogeneous nuclear ribonucleoprotein U (hnRNP U);Knockout;Growth retardation;Metabolic disorder;Glucose metabolism
10.3969/j.issn.1674-5817.2015.03.001
Q95-33
A
1674-5817(2015)03-0175-07
2014-09-26
国家重点基础研究发展计划(973计划)(2011CB944104)和国家科技支撑计划(2011BAI15B02;2012BAI39B01)
孙敏(1989-),女,硕士,研究方向: 实验动物遗传学,E-mail: sunmin@nicemice.cn
齐心,博士,南京大学模式动物研究所,E-mail: qixin@nicemice.cn

