10月龄淀粉样前体蛋白和早老素双转基因(APP/PS-Tg)小鼠相关指标检测
10月龄淀粉样前体蛋白和早老素双转基因(APP/PS-Tg)小鼠相关指标检测
目的观察10月龄淀粉样前体蛋白(APP)和早老素(PS)双转基因(APP/PS-Tg)小鼠的各种病理学检测指标, 为后续阿尔茨海默病(AD)研究提供参考。方法①用自主活动试验和水迷宫试验观察行为学改变; ②用HE染色、硫代黄素S染色和TUNEL荧光染色观察脑组织病理学改变、纤维状Aβ沉积和细胞凋亡; ③用多重荧光检测系统对血清和脑组织匀浆进行与免疫调节和信号通路有关的细胞因子检测。结果①行为学试验中, 10月龄APP/PS-Tg小鼠自主活动次数与阴性对照比较差异无统计学意义, 但Morris水迷宫试验显示APP/PS-Tg小鼠学习认知的时间(即潜伏期)落后于阴性对照组。②脑组织切片HE染色, 可见APP/PS-Tg小鼠大脑皮层和海马区可见散在老年斑病变。老年斑大小不一, 部分老年斑周围可见不典型的小胶质细胞反应, 而阴性对照无此病理改变。用硫代黄素S染色, 在激光共聚焦显微镜下用波长429 nm观察, APP/PS-Tg小鼠大脑皮层和海马区可见散在颗粒状绿色荧光, 荧光颗粒大小不一, 主要分布在大脑皮层, 海马区数量较少。阴性对照小鼠大脑皮层和海马区未发现有荧光颗粒。用TUNEL试验检测脑内细胞凋亡情况, 在激光共聚焦显微镜下在520±20 nm的荧光下观察绿色荧光标记的凋亡细胞。APP/PS-Tg
淀粉样前体蛋白和早老素双转基因(APP/PS-Tg)小鼠; 阿尔茨海默病(AD); 行为学试验;组织病理学; 细胞凋亡; 细胞因子
阿尔茨海默病(Alzheimer disease, AD)是最常见的与年龄有关的中枢神经系统退行性疾病,是导致老年人痴呆的主要原因。据报道[1],全球现有痴呆症病人2 400万,预计到2050年接近1亿病人,其中大部分是AD引起。我国老年痴呆症发病率没有官方确切的数据,文献报道的各地调查报告数据有所差异[2,3]。据最新上海城区的调查[4],≥60岁老年人的痴呆患病率为5.0%,其中AD占72.4%。随着我国快速进入老龄化社会,对此病的研究也越发成为应对老龄化社会的重要的课题之一。
虽然AD的确切病因还未完全明了,但已知它的主要病理改变包括神经元外纤维状β淀粉样沉积、细胞内异常磷酸化的tau蛋白聚集所形成的神经纤维缠结和神经元突触连接丢失。其中神经元外纤维状β淀粉样沉积的原因是由于淀粉样前体蛋白(APP)和早老素(PS)基因的突变[5]。针对这种病因而制作的Mo/HuAPP695swe和PS1-dE9双转基因小鼠(以下简称APP/PS-Tg小鼠)在小鼠脑内表达针对中枢神经系统神经元的小鼠/人淀粉样前蛋白(Mo/ HuAPP695swe)和突变人早老素1(PS1-dE9)[6],目前已广泛应用于AD发病机理的研究。
在本研究中, 作者对10月龄APP/PS-Tg小鼠的行为学、组织学和特殊染色以及血清和脑组织匀浆9种细胞因子等指标进行观察, 探讨该品系小鼠作为老年痴呆症模型应用于药物筛选和药效学评价可靠指标。
1 材料与方法
1.1动物与饲养
SPF级APP/PS-Tg小鼠和阴性对照野生型B6C3小鼠购自上海南方模式生物科技发展有限公司[SCXK(沪)2009-0023]。动物饲养在屏障系统中[SYXK(沪)2009-0069],温度20~25 ℃, 相对湿度40%~70%, 光照12 h/12 h。动物自由饮食、饮水。10月龄时用于试验。
1.2仪器设备
YLS-1A多功能小鼠自主活动记录仪(成都泰盟软件有限公司),Morris水迷宫(上海吉量软件科技有限公司),激光共聚焦设备型号:Leica TCS SP8,显微镜型号:Leica DMI6000,图像分析软件LAS.AF版本,悬液芯片系统:Bio-Plex Magpix System (Bio-Rad)。硫代黄素S染色颗粒计数及TUNEL试验凋亡细胞计数采用奥林巴斯图像分析系统cell Sens Dimention。
1.3试剂
硫代黄素S试剂: 购自上海良一国际贸易有限公司; TUNEL试剂盒: 购自上海翊圣生物技术有限公司。
1.4试验方法
1.4.1自主活动试验试验时将小鼠放入自主活动箱(长12 cm×宽10.5 cm×高12 cm)中,适应3 min后,仪器自动记录5 min内小鼠自主活动次数,分别统计计算两组小鼠的自主活动次数。
1.4.2Morris水迷宫试验Morris水迷宫直径120 cm,高60 cm,水池水深35 cm,一个φ 9 cm圆形平台藏匿于2 cm的水面之下。水温23~25℃,水中加入适量的新鲜牛奶,使水成为不透明乳白色水迷宫图像自动采集和处理系统,能自动采集动物的入水位置、游泳速度、搜索目标所需时间、运行轨迹和搜索策略等参数,并可对所采集的各种数据进行统计和分析。实验训练连续进行6 d,每日2次,每次设定时间为70 s。训练时,将小鼠面向池壁分别从两个入水点放入水池,记录小鼠从入水至找到水下隐蔽平台并站立于其上所需时间,作为潜伏期 (s)。如在70 s内小鼠没有找到并站立于平台上,则记为70 s。
1.4.3样品的采集行为学实验结束后,对小鼠经异氟烷麻醉后摘眼球取血,分离血清,用于血清细胞因子检测; 部分小鼠用质量分数4%的多聚甲醛进行心脏灌流固定、取脑、石蜡包埋、切片, 用于常规HE染色、硫代黄素S染色和细胞凋亡检测,部分快速取脑,分离大脑皮层和海马区, 液氮冷冻,-80 ℃保存,用于脑组织细胞因子检测。
1.4.4常规HE染色将石蜡切片用HE染色机进行常规HE染色,梯度酒精脱水、封片。
1.4.5硫代黄素S染色将石蜡切片常规脱蜡、水洗:蒸馏水洗1~2 min; 用l%的硫代黄素S染液于室温浸染15 min; 蒸馏水洗l~2 min; 用80%酒精1 min,95%酒精1 min。在载玻片上加1滴生理盐水,盖上盖玻片,在激光共聚焦显微镜下用波长429 nm观察、扫描,保存图片,在图像分析系统计数荧光颗粒。
1.4.6TUNEL检测细胞凋亡按试剂盒说明书指导进行操作,试验结束后在激光共聚焦显微镜下在520±20 nm的荧光下观察绿色荧光标记的凋亡细胞。随机选取5个视野,拍照,在图像分析系统设置自动计数,记录每个视野的凋亡细胞数。
1.4.7细胞因子检测用Bio-Plex Magpix System (Bio-Rad)多重荧光检测仪对阴性对照和APP/PS-Tg小鼠血清样品和脑匀浆样品进行9种细胞因子(其中Mouse Cytokine Group I Panel 6-Plex试剂盒包括:白介素(IL)-2、IL-4、IL-10、IL-12(p40)、IL-17α肿瘤坏死因子(TNF)-α; Bio-Plex Pro TGF-β ASSAY试剂盒包括: 转化生长因子(TGF)β1, 2, 3)含量检测
1.5统计学分析
试验数据分析使用采用PASW18.0软件,采用ANOVA,Mauch-y's Test of Sphercity, LSD's post hoc test统计学方法进行统计学分析,以P≤0.05判为差异有统计学意义。
2 结果
2.1小鼠自主活动试验
APP/PS-Tg小鼠和阴性对照组间自主活动次数差异不明显(表1无统计学意义)。

表1 APP/PS-Tg小鼠和阴性对照小鼠自主活动试验结果
2.2Morris水迷宫试验
水迷宫试验第1 日,小鼠从入水到找到水下隐蔽平台并站立于其上所需的潜伏期均较长,均接近于70 s。随着训练时间的延长,两组潜伏期均有所缩短,但差距扩大(表2)。如将两组6 d的潜伏期进行总的比较,则阴性对照组潜伏期明显缩短,差异有极显著意义(P≤0.01)。
2.3HE染色组织学检查
阴性对照小鼠大脑皮层和海马区未见明显病理改变(图1A)。APP/PS-Tg小鼠大脑皮层和海马区可见散在老年斑病变。老年斑大小不一,最大可达50 μm,最小10 μm,老年斑嗜伊红染色略深,有类淀粉中芯,部分老年斑周围可见不典型的小胶质细胞反应(图1B)。镜下对大脑皮层和海马区的老年斑数量进行计数,APP/PS-Tg小鼠大脑皮层和海马区老年斑数量分别为13.7±7.8和3.8±2.5,而阴性对照小鼠脑内未见老年斑(P≤0.05)。

表2 APP/PS-Tg小鼠和阴性对照小鼠Morris水迷宫试验结果 (s)
2.4脑组织硫代黄素S染色观察
APP/PS-Tg小鼠大脑皮层和海马区可见散在颗粒状绿色荧光, 荧光颗粒大小不一, 主要分布在大脑皮层,海马区数量较少(图2A)。阴性对照小鼠大脑皮层和海马区未发现有荧光颗粒(图2B)。用奥林巴斯图像分析系统cell Sens Dimention对大脑皮层和海马区进行分区域荧光颗粒计数, APP/PS-Tg小鼠大脑皮层和海马区的荧光颗粒显著多于阴性对照小鼠(表3)。
2.5脑组织细胞凋亡观察
阴性对照小鼠脑内也有凋亡细胞发现(图3A)。APP/PS-Tg小鼠凋亡细胞发出明亮的绿色荧光,呈多形性,在核内形成一个或多个荧光物质(图3B)。但APP/PS-Tg小鼠细胞凋亡计数(58.90±13.62)明显多于阴性对照(9.87±7.25)(P≤0.01)。

表3 APP/PS-Tg小鼠和阴性对照小鼠脑内硫代黄素染色荧光计数比较

表4 小鼠血清细胞因子检测 ng·L-1

表5 小鼠脑组织匀浆细胞因子检测 ng·L-1
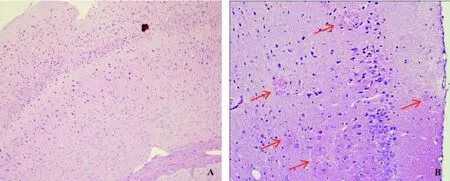
图1 APP/PS-Tg小鼠和阴性对照小鼠脑组织病理学观察

图2 小鼠脑组织硫代黄素S染色观察

图3 小鼠脑组织TUNEL荧光染色观察
2.6细胞因子检测
2.6.1血清细胞因子检测10月龄APP/PS-Tg小鼠与阴性对照组比较,IL-2、IL-10、IL-12、IL-12、IL-17α、TNF-α和TGFβ3含量明显下降(P≤0.05, P≤0.01)(表4)。
2.6.2脑组织匀浆细胞因子检测部分细胞因子有差异但均无统计学意义(表5)。
3 讨论
引起老年痴呆症的病因很多,如AD引起的痴呆、血管性痴呆、Lewy体痴呆、额颞痴呆、与帕金森病有关痴呆、与亨廷顿氏舞蹈症有关痴呆、韦尼克健忘综合症以及克雅二氏症,其中AD引起的痴呆占老年痴呆症的大部分[7]。目前,研究老年痴呆症的动物模型主要有诱发性小鼠模型[如氯化铝、β-淀粉样蛋白(Aβ)、D-半乳糖、以中枢神经抑制药樟柳碱、氢溴酸东莨菪碱、或戊巴比妥钠腹腔注射模拟AD出现的记忆障碍或方向辨别障碍症状而得]和转基因小鼠模型[7,8]。由化学药物诱导的老年痴呆症动物模型尽管可以模拟部分老年痴呆症特征病理改变,但是均不能模拟人类疾病渐进性的退行性改变[9],故应当谨慎评价用此类动物模型进行药效学评价所得出的结论。APP/PS-Tg小鼠是将突变人淀粉样前蛋白(Mo/HuAPP695swe)和人早老素1(PS1-dE9)基因转到小鼠基因组内,在脑组织中表达Aβ,模拟了人AD的病理学改变,已成为研究AD发病机理的重要工具。
目前用APP/PS-Tg小鼠作为老年痴呆症模型进行药物筛选和药效学评价报道的检测指标多使用行为学试验方法,但单纯动物行为学试验在评价药物疗效并不全面,最好同时有组织学和功能性指标改善的证据。
在本研究中, 选用了行为学试验、组织病理学和特殊染色方法以及血清和脑内免疫细胞因子检测等三方面指标来观察10月龄APP/PS-Tg小鼠的变化。
在小鼠自主活动试验中,10月龄APP/PS-Tg小鼠与阴性对照组比较,自主活动次数并没有明显改变,作者在日常饲养管理中也未发现APP/PS-Tg小鼠有自主活动减少和行动迟缓的表现。自主活动减少和行动迟缓可能是晚期老年痴呆症的表现。Morris水迷宫试验中10月龄APP/PS-Tg小鼠从试验一开始,其学习认知能力就低于阴性对照组。
常规HE染色能很好显示老年痴呆症的特征性表现: 老年斑。本研究中阴性对照组HE染色未发现有老年斑,而10月龄APP/PS-Tg小鼠的大脑皮层和海马区均可发现散在分布、大小不一的老年斑。硫代黄素S染色简单、灵敏,能很好显示APP/ PS-Tg小鼠脑组织内纤维状Aβ的沉积。在荧光显微镜下模型组小鼠大脑皮层和海马区可见均匀散在颗粒状绿色荧光,与文献报道的一致[10],计数结果也与HE染色基本一致,但与HE染色的老年斑的分布和形态并不一致。
用TUNEL方法检测脑组织细胞凋亡,试验显示10月龄APP/PS-Tg小鼠的凋亡细胞与阴性对照比较,差异有极显著意义(P≤0.01),表明老年痴呆症的发病可能与大脑神经细胞凋亡有关。
细胞因子含量变化是检测动物免疫调节功能信号通路的一个重要方面。文献报道APP/PS-Tg小鼠脑组织中多个细胞因子含量上升[1,2],但未见到有血清细胞因子检测的报道。本研究表明,10月龄APP/PS-Tg小鼠与阴性对照组比较,IL-2、IL-10、IL-12、IL-17α、TNF-α和TGFβ3含量明显下降,其中IL-2、IL-10、IL-17α和TNF-α含量均有显著下降(P≤0.01),其机理有待进一步阐明。APP/ PS-Tg小鼠血清和脑组织匀浆中细胞因子含量检测显示有些细胞因子可能参与阿尔茨海默病的发病过程,将为后续研究提供参考。
[1]Reitz C, Mayeux R. Alzheimer disease: epidemiology,diagnostic criteria, risk factors and biomarkers [J]. Biochem Pharmacol, 2014, 88(4):640-651.
[2]刘爽, 张玉莲, 周震. 老年性痴呆流行病学研究现况[J]. 中国老年学杂志, 2010, 30(10):1455-1457.
[3]沈来凤. 老年痴呆症的研究进展[J]. 现代医药卫生, 2010,26(4):542-543.
[4]丁玎, 赵倩华, 郭起浩, 等. 上海城区老年性痴呆患病率调查[J]. 中国临床神经科学, 2013, 21(1):19-25.
[5]Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics [J]. Science, 2002, 297(5580):353-356.
[6]Reiserer RS, Harrison FE, Syverud DC, et al. Impaired spatial learning in the APP + PSEN1DeltaE9 bigenic mouse model of Alzheimer's disease[J]. Genes Brain Behav, 2007, 6(1):54-65.
[7]Neha, Sodhi RK, Jaggi AS,et al. Animal models of dementia and cognitive dysfunction[J]. Life Sci, 2014, 109(2): 73-86.
[8]文彪, 叶冰, 董青青, 等. 老年性痴呆动物模型的研究进展[J]. 实验动物科学, 2009, 26(1):45-48.
[9]唐军, 徐海伟, 周光纪, 等. 阿尔茨海默病转基因小鼠的研究现状与展望[J]. 中国行为医学科学, 2006, 15(2):190-192.
[10] Zhang W, Bai M, Xi Y, et al. Multiple inflammatory pathways are involved in the development and progression of cognitive deficits in APPswe/PS1dE9 mice[J]. Neurobiol Aging, 2012,33(11):2661-2677.
顾组曦,汤家铭,米金霞,吴文斌,赵源,樊海艇,张超超
(上海中医药大学实验动物中心,上海 201203)
Q95-33
B
1674-5817(2015)02-0170-05
10.3969/j.issn.1674-5817.2015.02.017
2014-06-30
顾祖曦(1972-), 女, 高级实验师, 主要从事动物模型和动物实验管理。E-mail: guzuxi1972@163.com
汤家铭(1952-), 男, 研究员, 主要从事动物实验管理和动物模型制作。E-mail: tangjiaming@hotmail.com
小鼠与阴性对照比较, 差异有极显著统计学意义(P≤0.01)。③血清细胞因子检测, 10月龄APP/PS-Tg
小鼠与阴性对照组比较, 白介素(IL)-2、IL-10、IL-12、IL-12、IL-17α、肿瘤坏死因子(TNF)-α和转化生长因子(TGF)β3含量明显下降, 其中IL-2、IL-10、IL-17α和TNFα含量均有显著下降(P≤0.01); 用脑组织匀浆检测细胞因子,APP/PS-Tg小鼠IL-2、IL-17α、TNF-α和TGFβ1, 2, 3的含量较阴性对照高, 但差异无统计学意义(P≥0.05)。结论在APP/PS-Tg小鼠的评价指标中,Morris水迷宫试验是一个敏感可靠的行为学试验方法; 脑组织切片HE染色、硫代黄素S染色和TUNEL试验均简单易行,可从不同角度检测APP/PS-Tg小鼠的脑内病理改变; 血清和脑组织匀浆细胞因子的检测显示有些细胞因子可能参与阿尔茨海默病的发病过程。

