母体糖尿病环境对体外受精胚胎早期发育的影响
强苏静,陶凌云,刘丽均,徐 平,3,高 诚
(1. 上海斯莱克实验动物有限责任公司,上海 201615;2. 上海实验动物研究中心,上海 201203;3. 中国科学院上海生命科学院,上海 201615)
母体糖尿病环境对体外受精胚胎早期发育的影响
强苏静1,陶凌云2,刘丽均1,徐平1,3,高诚2
(1. 上海斯莱克实验动物有限责任公司,上海 201615;2. 上海实验动物研究中心,上海 201203;3. 中国科学院上海生命科学院,上海 201615)
目的通过腹腔注射链脲佐菌素(streptozotocin, STZ)构建小鼠糖尿病(diabetes mellitus,DM)模型后, 运用体外受精技术研究母体高血糖环境对早期胚胎发育的影响。方法选取6~8周龄ICR雌鼠经2次腹腔注射小剂量STZ构建小鼠糖尿病模型,并设实验对照组。实验母鼠体外受精得到2-细胞胚胎,统计受精率等,并将2-细胞胚胎移植至代孕母鼠体内。取14 d胎龄的胚胎提取总RNA,用Agilent 2100 Bioanalyzer系统对总RNA进行质检合格后,经过逆转录、标记、杂交、洗脱,芯片结果用Affymetrix Scanner 3000进行扫描,用Command Console Software 3.1读取原始数据,实验重复3次,比较实验组与对照组的基因表达的差异情况。结果较高血糖组(血糖为9.5~15.5 mmol/L)母鼠卵子体外受精后发育到2-细胞胚胎的比例为52.3%与对照组的72.1%存在显著统计学差异(P<0.01),高血糖组(血糖值>15.5 mmol/L)胚胎发育到2-细胞的比例为44.2%与对照组相比也存在显著统计学差异(P<0.01)。芯片筛选出差异表达基因121个(P<0.05),其中有119个基因实验组的表达量是对照组的0.5倍以下,2个基因实验组的表达量是对照组的2倍以上。结论糖尿病小鼠的卵子与正常精子体外受精后发育到2-细胞的比例较对照组小鼠低,并且血糖值越高比例越低。由此说明母体糖尿病环境能影响其卵子的生长发育,并且这些影响可能是通过上调代谢相关基因和下调发育相关基因产生的。
链脲佐菌素(STZ); 体外受精; 基因芯片; 差异表达
代谢疾病如肥胖症、糖尿病和心血管疾病已成为一个世界范围内的社会和健康问题,为深入研究这些疾病的发病机理,利用动物模型进行研究是有效途径之一。作者前期实验表明,用正常ICR雄鼠与糖尿病模型雌鼠交配,受精率仅为46.9%,流产率高达73.9%,胚胎畸形率为9%,仔鼠出生死亡率为20%[1]。因此本实验采取体外受精的方法,排除母体本身在交配环节对受精率的影响着重研究高血糖母体对卵细胞的影响,并且这种影响是否持续到胚胎发育期。
研究认为[2],糖尿病胎儿发育异常与基因表达改变有关,糖尿病引起的神经管缺失与神经管表面的细胞凋亡有关,并观察到糖尿病小鼠胚胎中脑和后脑的神经管中Pax-3 mRNA表达明显下降; 对链脲佐菌素(streptozotocin, STZ)诱发的大鼠糖尿病模型研究表明,12 d胚胎的卵黄囊细胞膜的损伤与细胞凋亡信号调节通路的破坏有关, 发现卵黄囊细胞凋亡相关基因Bax蛋白表达上升,而细胞生存因子Akt酶活力下降[2]。本实验通过基因芯片的方法检测高糖母体的体外受精胚胎中的一些基因表达情况,并与正常对照组进行比较,研究糖尿病与这些基因表达的相关性,为后续实验提供研究方向
1 材料与方法
1.1实验动物与环境条件
SPF级雌性ICR小鼠,6~8周龄,28~30 g,购自上海西普尔-必凯实验动物有限公司[SCXK(沪)2008-0016],饲养于上海实验动物研究中心(上海市实验动物质量监督检验站)屏障系统内[SYXK(沪)2008-0056], 密度≤5只/每盒, 温度20℃~24 ℃,相对湿度40%~60%,喂以配方饲料,自由采食和饮水,自动光控(12 h/12 h)。
1.2试剂及仪器
链脲佐菌素(STZ)、超促排卵所需激素(PMSG、hCG)、配置胚胎体外培养液HTF所需试剂、胚胎冲洗液M2均购自Sigma公司;枸橼酸钠为国产分析纯; 血糖试纸为罗氏公司产品;RNA抽取试剂盒(RNeasy Mini Kit)购自Qiagen公司; 小鼠RNA表达谱芯片为Affymetrix Mouse 430 2.0芯片(上海伯豪生物技术有限公司,生物芯片上海国家工程研究中心)。另有罗氏罗康全活力型血糖测定仪(罗氏公司); 紫外分光光度仪ND-1000(NanoDrop),Stemi2000C显微解剖镜(Zeiss公司); Micro Galaxy CO2培养箱(60 mm×15 mm)(Becton Dickinson公司); GeneChip®Scanner 3000 扫描仪(Cat#00-00212,Affymetrix, Santa Clara, CA, US)等。
1.3糖尿病动物模型的建立
将实验小鼠分为实验组和对照组, 实验组30只,对照组15只。实验组用0.05 mmol/L pH 4.5 的无菌枸橼酸钠缓冲液配制成10 mg/mL的STZ溶液后按10 mL/kg体质量的剂量腹腔注射(即小鼠腹腔注射STZ的剂量为100 mg/kg体质量),对照组腹腔注射按10 mL/kg体质量注射无菌枸橼酸钠缓冲液,1 周后按上述剂量再次腹腔注射实验组和对照组小鼠。将空腹血糖值9.5~15.5 mmol/L作为较高血糖模型小鼠, 血糖值>15.5 mmol/L为高血糖小鼠, 观察并记录小鼠症状、体征和死亡情况。
1.4血清葡萄糖浓度和体质量测定
每次注药后一周测定实验组和对照组小鼠的血清葡萄糖浓度和体质量,采用空腹尾尖采血,直接用血糖试纸测定。
1.5实验小鼠的超促排卵和体外受精
实验组和对照组小鼠用6 IU PMSG和hCG进行超排卵。注射hCG 14 h后, 小鼠脱臼处死。取出雌鼠的卵子与正常的ICR雄鼠的精子进行体外受精。体外受精24 h后, 计数发育到2-细胞的胚胎。并将2-细胞胚胎转移入正常的同期假孕雌鼠的输卵管内, 12.5 d后剖宫取14 d胚胎。由于高血糖组雌鼠体外受精后得到的2-细胞比较少,发育状态也不佳,故未做移植。
1.614 d胚胎总RNA提取
分别提取10个实验组和10个对照组14 d胚胎总RNA, 操作按试剂盒进行。紫外分光光度计测定总RNA/DNA浓度(260 nm), 经紫外波谱扫描分析RNA/DNA纯度,D260/D280值在2.0左右,D260/D230值>D260/D280值,说明核酸纯度较高。
1.7芯片实验与数据分析
采用Affymetrix表达谱芯片配套试剂盒和标准操作流程对实验组和对照组胚胎总RNA中的mRNA进行放大、标记和纯化, 获得带有生物素(biotin)标记的cRNA。按照Affymetrix表达谱芯片配套提供的杂交标准流程和配套试剂盒, 在滚动杂交炉中16h滚动杂交, 杂交完成后在洗涤工作站按照Affymetrix提供的标准操作流程进行芯片的洗涤。芯片结果采用Gene Chip®Scanner 3000进行扫描,用Command Console Software 3.1读取原始数据, 质控合格的数据采用Gene Spring Software 11.0进行归一化处理,所用的算法为MAS5.0。基因表达差异用差异倍数值(foldchange)表示, 差异基因的筛选标准为差异倍数值≥2为上调基因, 差异倍数值≤0.5为下调基因。
1.8统计学方法
所有数据用Mean±SE表示, 采用SPSS19.0 软件进行统计学处理。差异显著性检验采用独立样本t检验和单因子方差分析(one way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1糖尿病模型
对实验组30只雌性小鼠第一次注射STZ后一周,小鼠血糖与对照组无明显差异, 体质量小幅下降(图1),不表现多饮、多食、多尿, 活动正常; 第二次注射STZ后1周, 76.6%的小鼠血糖值≥9.5 mmol/L, 其间表现多饮、多食、多尿, 活动减少, 体质量下降明显(图1), 没有出现小鼠死亡。由图2可见, 63.3%小鼠血糖值(12.08±0.47 mmol/L, n=19)明显升高, 较对照组(6.16±0.24 mmol/L, n=15)有显著统计学差异(P<0.001), 其中13.3%小鼠血糖值>15.5 mmol/L (n=4)。
2.2实验小鼠体外受精后的2-细胞比例
由图3可见,模型小鼠超排卵子与正常雄鼠的精子体外受精后, 卵子的个数较正常小鼠少, 并且发育到2-细胞的个数较少。由表1可见,较高血糖组小鼠超排后卵子与正常雄鼠的精子体外受精后,发育到2-细胞的比例为52.6%, 较对照组72.1%有统计学差异(P<0.01),高血糖组小鼠超排后卵子与正常雄鼠的精子体外受精后,发育到2-细胞的比例为43.3%,较对照组亦有统计学差异(P<0.01)。
2.3芯片杂交
共检测了45 101个点, 检出25 978个点, 检出率为57.6%, 图4为基因芯片杂交信号强度的散点图。X轴、Y轴分别以实验组g1和对照组g2的荧光强度值为坐标, 每一个数据点代表芯片上一个基因点的杂交信号, 数据点颜色越红表示杂交信号越强
2.4差异基因分析
共检出差异表达基因121个(P<0.05),其中有119个基因表达量下调,2个基因表达量上调。这些基因包括发育因子、细胞因子、信号转导蛋白、代谢酶、转录调节因子、免疫调节因子和一些Cdna(图5)。发现部分差异基因与胚胎发育和代谢有关,部分基因如表2示,另观察到一些印迹基因在实验组和对照组表达有差异(表3)。

图1 小鼠体质量变化平均值Figure 1 Average value about weight change in treated mice
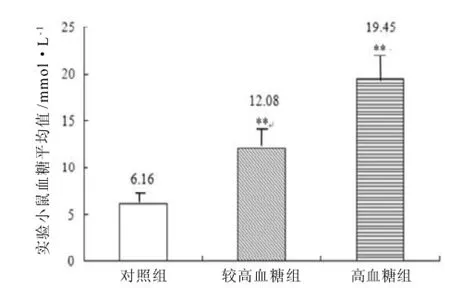
图2 STZ处理后实验小鼠血糖平均值Figure 2 Average value about blood glucose levels in treated mice

图3 实验组(左图)与对照组(右图)单只母鼠卵细胞体外受精后的2-细胞胚胎(× 80)Figure 3 Two-cell embryos of treated group (left) and control group (right) after in vitro fertilization(× 80)

表1 实验小鼠体外受精后的受精率Table 1 The ratio of fertilization after in vitro fertilization
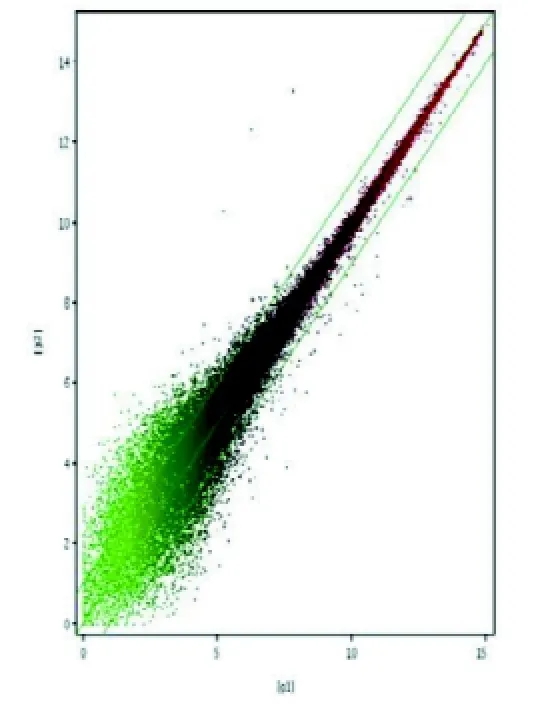
图4 胚胎的荧光强度值Figure 4 Fluorescence intensity value of the embryo
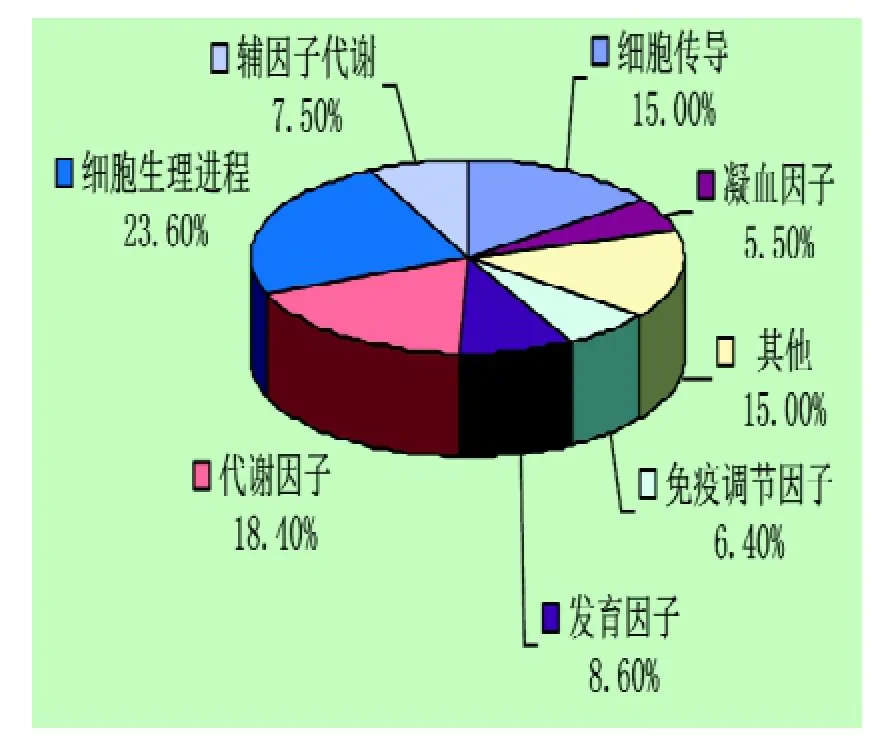
图5 胚胎差异基因功能分布图Figure 5 Distribution figure of embryo's different genes function
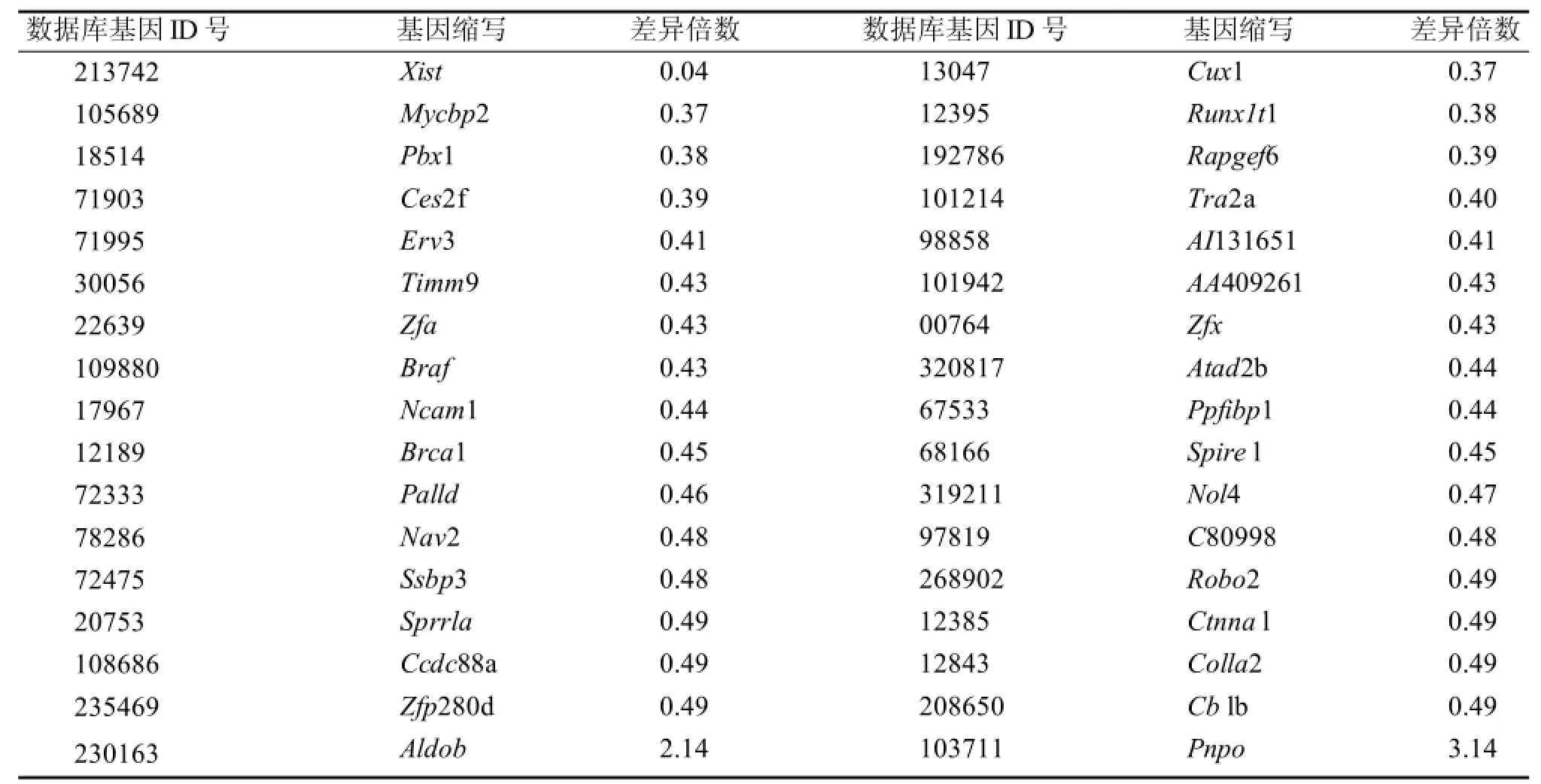
表2 胚胎部分差异显著基因简略表Table 2 Brief table of partial embryo's different expression genes
3 讨论
前期实验表明,用正常的雄性小鼠与糖尿病雌鼠交配,其受精率可能与母体的高血糖有关[1]。因此本实验采取体外受精的方法,排除母体环境对受精率的影响,而主要研究高血糖的母体对卵细胞的影响。将模型小鼠用PMSG和hCG超促排卵后,与正常精子进行体外受精, 经过24 h的体外培养后,发现模型小鼠的胚胎发育到2-细胞的比例明显低于对照组的小鼠,且血糖越高比例越低,这可能与母体的高血糖有关。林锟等研究了高血糖对卵母细胞和早期胚胎细胞凋亡的影响,结果表明糖尿病小鼠的卵泡破裂和卵母细胞减数分裂时间都比正常小鼠延迟,卵母细胞大小较正常明显减小[3]。体外细胞培养亦观察到高浓度葡萄糖环境下排卵后卵母细胞培养存活率下降,提示高糖对卵母细胞存在着一定的细胞毒性作用,母体的高血糖对其卵子的发育是有不良影响的[4]。本实验将模型小鼠的卵子与正常小鼠的精子体外受精,发现受精率偏低,鉴于精子是正常的,排除精子对受精率的影响后,表明受精率偏低主要是由于卵子质量下降引起的。本实验得出的结果和林锟等研究是一致的,而且是从胚胎发育学角度来证明高糖对卵母细胞存在着一定的细胞毒性作用,并为其提供实验依据。

表3 胚胎印迹基因表达差异Table 3 Different expression of placenta's imprinting genes
本实验通过基因芯片检测出差异表达基因121个, 其中有119个基因表达量下调, 2个基因表达量上调。其中差异较明显的印迹基因有Xist、Xlr4c、Grb10(growth factor receptor-bound protein 10)、Meg3、Impact、Gab1、Sgce、Phlda2等。X染色体失活特异转录物(X inactive transcript, Xist)是母源印迹基因,它是一种非编码的RNA。Xist基因在X染色体失活过程中起着关键性作用[5],Xist的表达为雌性胚胎发育过程中X染色体失活的起始和剂量补偿所必需。印迹基因Grb10为母源等位基因表达,Grb10基因干扰导致小鼠胚胎及胎盘的过渡生长,以致出生时胎儿及胎盘均比正常的大30%左右,说明Grb10是强大的生长抑制剂[6,8]。在小鼠上,Gab1基因定位于染色体8C31,Gab1在小鼠的胚胎期就开始表达,利用基因敲除研究Gab1的基因功能显示, Gab1基因敲除小鼠于胚胎期12.5~17.5 d死亡,并表现出胎盘、心脏、皮肤等多器官发育障碍[7,9]。Sgce (Epsilon-Sarcoglycan) 基因是父源等位基因表达,Sgce基因在早期和晚期胎盘中呈现组成性的高表达,且Sgec基因纯合性缺失的小鼠胚胎由于无法着床而死去,提示该基因的表达产物可能在细胞增殖、分化和滋养层细胞侵入子宫壁的过程中,对细胞之间的信号转导起着重要作用[10]。Phlda2在胎盘中是父源印迹、母源表达的基因,表达于人胎盘绒毛的细胞滋养层及小鼠胎盘迷路滋养层。Phlda2通过参与不同滋养层细胞间的信号转导,使各滋养层按比例协调生长,维持胎盘功能的稳定[11]。Phlda2基因敲除的小鼠,胎盘过度增生,但以海绵滋养层增生为主,母-胎营养传递的关键部位一迷路滋养层的比例相对减少,且胎盘毛细血管数量减少[11]。
上述几个印迹基因与胚胎和胎盘的发育密切相关,本实验中小鼠母体的高血糖环境可能是引起这些基因异常表达的重要原因之一,因实验设置了同样进行体外受精的对照组,故胚胎体外操作的影响可以忽略不计。这些基因的异常表达是否引起胚胎发育乃至成年期以后的异常,将通过后续研究进行验证。通过筛选出这些差异基因,为进一步研究糖尿病影响胚胎的遗传发育和代谢性疾病的分子机理提供了基础数据。
[1]邵伟娟, 陶凌云, 赵茹茜, 等. 不同剂量STZ 诱导小鼠糖尿病模型及生殖能力的研究[J]. 上海交通大学学报: 农业科学版, 2007, 25(6):541-546.
[2]Sun FY, Kawasakia E, Akazawac S. Apoptosis and its pathway in early post-implantation embryos of diabetic rats Diabetes [J]. diabetes Res Clin Pract, 2005, 67(2):110-118.
[3]Vesela J, Cikos S, Hlinka D, et al. Effects of impaired insulin secretion on the fertilization of mouse oocytes [J]. Hum Reprod, 1995, 10(12):3233- 3236.
[4]林锟. 高血糖对卵母细胞和早期胚胎细胞凋亡的影响[J].医学综述, 2009, 15(19):2932-2934.
[5]Okamura K, Wintle RF, Scherer SW. Characterization of the differentially methylated region of the Impact gene that exhibits Glires-specific imprinting[J]. Genome Biol, 2008, 9 (11):160-170.
[6]刘齐, 王燕, 陈岩, 等. Grb10 基因在小鼠胚期特异性表达分析[J]. 遗传, 2009, 31(7):732-740.
[7]胥传飞, 卢晟盛, 王友亮, 等. 接头蛋白Gabl的结构及功能研究进展[J]. 生物技术通讯, 2009, 20(6):839-842.
[8]Shiura H, Nakamura K, Hikichi T, et al. Paternal deletion of Meg1/Grb10 DMR causes maternalizationof the Meg1/ Grb10 cluster in mouse proximal chromosome11 leading to severe pre- and postnatal growth retardation[J]. Hum Mol Genet, 2009, 18(8):1424-1438.
[9]Park CH, Uh KJ, Mulligan BP, et al. Analysis of imprinted gene expression in normal fertilized and uniparental preimplantation porcine embryos[J]. PLoS One, 2011, 6(7):e22216.
[10] Frank D, Fortino W, Clark L, et al. Placental over growth in mice lacking the imprinted gene IPI[J]. Proc Natl Acad Sci USA, 2002, 99(11):7490-7495.
[11] Himes KP, Koppes E, Chaillet JR. Generalized disruption of inherited genomic imprints leads to wide-ranging placental defects and dysregulated fetal growth [J]. Dev Biol, 2013, 373 (1):72-82.
Effect of Maternal Diabetic Environment on Development of Early Mouse Embryo by in vitro Fertilization
QIAANG Su jing1, TAO Ling-yun2, LIU Li-jun1, XU Ping1,3, GAO Cheng2
(1. Shanghai SLAC Laboratory Animal Ltd. Co., Shanghai 201615 China;2. Shanghai Laboratory Animal Research Center, Shanghai 201203, China;3. Shanghai Institute for Biological Sciences, Chinese Academy of Sciences, Shanghai 201615, China)
ObjectiveThe experimental mice were induced to be diabetes mellitus (DM) mice through streptozotocin (STZ) intraperitoneal injection, in order to study the effect of maternal hyperglycemia on early mouse embryo development by in vitro fertilization. MethodsICR mice aged 6~8 weeks were intraperitoneally injected with STZ to established DM models, and the normal mice were considered as control group . The model mice were superovulated by intraperitoneal injection with PMSG and hCG, then the oocytes were fertilized with sperms from normal male mice in vitro. The rates of fertilization were counted and 2-cell embryos were transferred to pseudopregnant mice. Finally 14-dold embryos were obtained to extract. total RNA. After detected by Agilent 2100 Bioanalyzer system,total RNA were reversed transcription, labeled, hybridized, eluted and the data of microarray was scanned by Affymetrix Scanner 3000. Basic data were read by Command Console Software 3.1. The experiments were repeated three times, then the expression of genes between treated group and control group were compared. ResultsThe ratio of two-cell embryo in hyperglycemia group (52.3%), was significantly lower than that in the control group (77.2%) (P<0.01). A total of 121 differentially expressed genes (P<0.05) were screened out. One hundred and nineteen genes expression levels of the experimental group was less 0.5 times than those of the control group, while 2 genes showed a more than 2-fold up regulation. ConclusionAfter oocytes of model mice fertilizing with sperms of normal male mice in HTF, the rate of embryo developing to two-cell was lower than normal mice. The higher of blood glucose level, the lower of two-cell rate. The growth and development of the oocytes were affected by maternal diabetes environment through up-regulating the metabolism-related genes and down-regulated development-relating genes .
Streptozotocin(STZ); In vitro fertilization; Microarray; Differentially expression
Q95-33
A
1674-5817(2015)02-0155-06
10.3969/j.issn.1674-5817.2015.02.014
2014-06-30
上海市科委“创新行动计划”重点项目(10140900700); 国家科技支撑计划课题(2013BAK11B02)
强苏静(1987-), 女, 硕士研究生, 研究方向: 动物学。liyang_sujing@163.com
高诚, 研究员。E-mail: gaochengdgb@126.com

