MicroRNA-21调控口腔鳞癌细胞顺铂耐药及其作用机制
陈建萍 王萍 杨庚萍 欧阳少波 黄自坤
(1江西省萍乡市湘东区人民医院口腔科萍乡337055;2江西省萍乡市湘东区中医院口腔科萍乡337016;3南昌大学附属口腔医院修复科江西南昌330006;4南昌大学第一附属医院检验科江西南昌330006)
MicroRNA-21调控口腔鳞癌细胞顺铂耐药及其作用机制
陈建萍1王萍2杨庚萍2欧阳少波3黄自坤4
(1江西省萍乡市湘东区人民医院口腔科萍乡337055;2江西省萍乡市湘东区中医院口腔科萍乡337016;3南昌大学附属口腔医院修复科江西南昌330006;4南昌大学第一附属医院检验科江西南昌330006)
目的:探讨microRNA-21(miRNA-21)在人口腔鳞癌顺铂耐药细胞中的表达及其作用机制。方法:采用实时荧光定量PCR(RT-PCR)法检测miRNA-21在口腔鳞癌细胞株Tca8113及顺铂耐药细胞株Tca8113/DDP的表达;采用体外转染法将miRNA-21模拟物(mimics)或抑制物(inhibitor)分别转染Tca8113和Tca8113/DDP细胞,采用RT-PCR检测转染前后细胞中miRNA-21的表达情况;采用CCK8实验检测转染前后细胞对顺铂敏感性的变化;并用Western blot检测转染前后细胞中PTEN的表达变化。采用双荧光素酶报告基因验证miRNA-21是否作用于PTEN基因的3'-UTR区预测靶位。结果:miRNA-21在Tca8113/DDP细胞中的表达水平是Tca8113细胞的(8.26±1.37)倍(P<0.01)。Tca8113细胞转染miRNA-21 mimics后,细胞中miRNA-21表达水平是转染前的(10.51±2.18)倍(P<0.01),顺铂对Tca8113细胞增殖的抑制率较转染前明显下降(P<0.05),细胞内PTEN表达水平较转染前明显下降(P<0.05)。Tca8113/DDP细胞在转染miRNA-21 inhibitor后,细胞中miRNA-21表达水平是转染前的(0.32±0.14)倍(P<0.01),顺铂对Tca8113/DDP细胞增殖的抑制率与转染前比较明显增加(P<0.05),细胞内PTEN表达水平较转染前明显增高(P<0.05)。经双荧光素酶报告基因验证PTEN是miRNA-21的靶基因。结论:miRNA-21在口腔鳞癌顺铂耐药细胞Tca8113/DDP中异常高表达,下调其表达可部分逆转细胞耐药性,miRNA-21可能通过作用于PTEN参与口腔鳞癌细胞顺铂耐药的发生和发展。
口腔鳞癌;微小RNA-21;顺铂;耐药;人第10号染色体缺失的磷酸酶
口腔鳞癌(Oral Squamous Cell Carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,近年来其发病率有逐年增高的趋势[1]。尽管近年来新的抗肿瘤药物不断出现,多数患者仍不能够获得有效地控制,这其中一个重要原因是口腔鳞癌细胞对化疗药物产生了耐药[2]。因此研究口腔鳞癌耐药性产生的机制及寻找逆转耐药的途径是目前亟待解决的问题。
MicroRNA(miRNA)是一种内源性的非编码的RNA序列,一般由21~23个核苷酸组成小RNA分子,广泛存在于各种生物体中,可在转录后水平负性调控基因的表达,miRNA不仅参与细胞增殖、分化、凋亡、周期调控等,对肿瘤的化疗耐药也具有重要作用[3~4]。而在业已发现的众多miRNA中,miRNA-21被认为是调控肿瘤恶性生物学行为的重要基因之一,而且还参与调控肿瘤细胞的多重耐药,下调miRNA-21可明显增加肿瘤细胞对化疗药物的敏感性[5~7]。但是miRNA-21是否参与了口腔鳞癌细胞顺铂耐药的调节及其调控机制如何,目前尚未有相关文献报道。本研究以顺铂敏感口腔鳞癌亲本细胞株Tca8113及顺铂耐药细胞株Tca8113/DDP为细胞模型,探讨miRNA-21是否参与调节口腔鳞癌顺铂耐药及其可能的分子机制,为临床口腔鳞癌化疗药物耐药的防治提供新的治疗策略。
1 材料与方法
1.1主要试剂口腔鳞癌亲本细胞株Tca8113和耐顺铂细胞株Tca8113/DDP均购自中国典型培养物保藏中心。RPMI 1640及胎牛血清购自美国Gibco公司;顺铂购自美国Sigma公司;蛋白裂解液RIPA购自碧云天公司;β-actin抗体和兔抗人PTEN单抗购自美国Abcam公司,HRP标记的二抗购于Sigma公司;ECL化学发光试剂盒购自美国Pierce公司。Lipofectamine2000 Transfection Reagent购自Life Technologies公司;Prime-scriptTM逆转录试剂盒和miRNA定量PCR试剂盒购自TaKaRa公司;CCK-8试剂盒购自南京凯基生物科技公司。双荧光素酶报告基因检测试剂盒和pGL载体购于美国Promega公司。miRNA-21 mimics、miRNA-21 inhibitor及相应对照均由上海GenePharma公司合成。
1.2细胞培养亲本细胞株Tca8113和耐顺铂细胞株Tca8113/DDP分别于含10%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的RPMI 1640培养基中,在37℃、5%CO2饱和湿度的细胞培养箱中培养。向Tca8113/DDP细胞培养液中将加入终浓度为5 μmol/L的顺铂以维持细胞耐药性。
1.3细胞转染实验设置空白对照组、阴性对照组(仅含无义序列)和实验组(miRNA-21 mimics或miRNA-21 inhibitor)。取对数生长期细胞进行细胞转染,细胞转染按照Lipofectmine 2000试剂盒说明书操作,将10 nmol/L miRNA-21 mimics或miRNA-21 inhibitor分别转染至Tca8113和Tca8113/DDP细胞中。
1.4实时荧光定量PCR(RT-PCR)法检测miRNA-
21的表达用Trizol试剂提取对数生长期的细胞总RNA,使用分光光度计测定提取的RNA吸收值,并计算RNA浓度。按照TaKaRa公司的Prime-scriptTM逆转录试剂盒说明书逆转录成cDNA,反应条件:30℃8 min,40℃25 min,-80℃保存备用。RT-PCR按照SYBR Green说明书配制反应体系(25 μl体系)。以U6作为miRNA-21内参。取cDNA进行RT-PCR,定量PCR条件如下:95℃预变性10 s,然后进行40个循环;95℃8 s,65℃10 s,然后70℃延伸10 s,绘制扩增曲线,反应结束后得到各反应管循环阈值(Ct),miRNA-21的相对表达量采用2-ΔΔCt法对基因表达量进行相对定量。1.5CCK8检测转染前后细胞对顺铂敏感性变化按照CCK8试剂盒说明书进行实验。转染24 h后,取对数期Tca8113或Tca8113/DDP细胞进行消化及收集,以5×103个细胞接种到96孔培养板中,每孔接种体积为100 μl,并设仅含培养基的空白对照。细胞贴壁后,分别加入不同浓度的顺铂,每孔加入100 μl。细胞培养48 h后,每孔CCK8与培养液以1∶10加入,继续孵育2 h,在酶标仪上采用450 nm波长测量每孔吸光度(Optical Density,OD)值。根据数据绘制细胞生长抑制率曲线,并计算顺铂对细胞的半数抑制浓度(half Inhibition Concentration,IC50)。抑制率计算公式为:生长抑制率=(1-OD用药组/OD对照组)×100%,以最小二乘法进行曲线拟合,得到IC50值,实验重复3次。
1.6Western blot检测细胞中PTEN的含量收集转染前后细胞,PBS洗涤2次,RIPA裂解液提取细胞总蛋白,加SDS-PAGE上样缓冲液,煮沸5 min离心,并用BCA法测定蛋白含量。按每孔20 μl上样,于10%聚丙烯酰胺凝胶中进行电泳,转膜1 h至PVDF膜上,5%脱脂奶粉室温封闭2 h。分别加入兔抗人PTEN抗体(1∶2 000)、鼠抗人β-actin抗体(1∶500),4℃孵育过夜。TBST洗3次,每次10 min,分别加入HRP标记的羊抗兔二抗(1∶1 000)和羊抗鼠二抗(1∶4 000),室温孵育1 h洗膜,加入ECL发光液显影,用Image J图像分析系统扫描图像的光密度,以各组目的蛋白条带光密度值与β-actin光密度值计算相对比值。
1.7双荧光素酶报告基因检测化学合成包含有与相应miRNA-21互补结合的靶基因PTEN 3' -UTR序列片段和突变的PTEN 3'-UTR序列片段,将包含预测miRNA-21结合位点的PTEN 3'-UTR和突变的PTEN 3'-UTR(mutant)的片段克隆到pGL3-Luciferase基因下游的多克隆位点中。正常培养的Tca8113细胞,以4×105个/ml均匀接种于6孔培养板,每孔体积1 ml。共转染包含PTEN 3' -UTR或突变的PTEN 3'-UTR(mutant)的荧光素酶质粒,以及miRNA-21 mimics或miRNA-21 mimics control。转染48 h后收集细胞,按照Promega提供的方法进行双荧光素酶活性检测。
1.8统计学方法采用SPSS17.0软件进行统计学分析,计量资料用(±s)表示,两组间比较采用t检验,多组间分析用单因素方差分析,当P<0.05时表示差异有统计学意义。
2 结果
2.1耐药细胞株与亲本细胞株对顺铂的敏感性经不同浓度的顺铂作用48 h后,Tca8113/DDP及Tca8113两株细胞的存活率不同;Tca8113/DDP及Tca8113对DDP的IC50分别为(22.37±3.55)μmol/L、(0.82±0.16)μmol/L(P<0.01),前者是后者的27.28倍。
2.2耐药细胞株与亲本细胞株miRNA-21的表达RT-PCR检测结果显示,miRNA-21在耐药细胞株Tca8113/DDP中的表达水平显著升高,与口腔鳞癌亲本细胞株Tca8113相比,表达升高(8.26±1.37)倍,差异有统计学意义(P<0.01)。
2.3转染miR-21 mimics或inhibitor后miRNA-21表达变化Tca8113细胞转染miRNA-21 mimics后,细胞中miRNA-21表达水平明显增高,是转染前的(10.51±2.18)倍(P<0.01)。而Tca8113/DDP细胞在转染miRNA-21 inhibitor后,细胞中miRNA-21表达水平明显下降,是转染前的(0.32±0.14)倍(P<0.01)。
2.4转染miR-21 mimics或inhibitor后口腔鳞癌细胞对顺铂敏感性变化我们进一步检测了miRNA-21改变异常是否能够影响口腔鳞癌细胞对顺铂敏感性。在Tca8113细胞中分别转染miRNA-21mimics和mimicscontrol,在Tca8113/DDP细胞中分别转染miRNA-21 inhibitor和inhibitor control。CCK8结果显示,转染miRNA-21 mimics后Tca8113细胞存活率随顺铂浓度的增加明显升高,顺铂对细胞增殖的抑制率较转染前明显下降,转染miRNA-21 mimics前顺铂对Tca8113细胞的IC50为(0.78±0.11)μmol/L;转染miRNA-21 mimics后顺铂对Tca8113细胞的IC50为(1.64±0.18)μmol/L,差异有统计学意义(P<0.05)。见图1A。Tca8113/DDP细胞转染miRNA-21 inhibitor后,顺铂对其增殖的抑制率与转染前比较明显增加,转染miRNA-21 inhibitor前顺铂对Tca8113/DDP细胞的IC50为(26.56±4.67)μmol/L;转染miRNA-21 inhibitor后顺铂对Tca8113/DDP细胞的IC50为(8.17±2.05)μmol/L,差异有统计学意义(P<0.05)。见图1B。
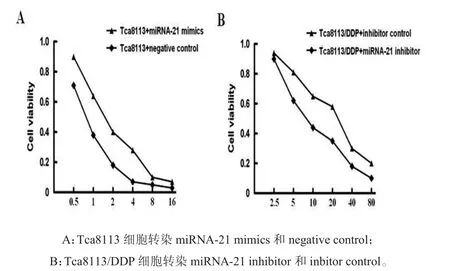
图1 Tca8113细胞和Tca8113/DDP细胞分别转染miRNA-21 mimics和miRNA-21 inhibitor后顺铂对细胞的抑制率变化
2.5口腔鳞癌细胞中PTEN是miRNA-21调节的下游靶基因为了确定miRNA-21在口腔鳞癌细胞中调节的下游靶基因,我们利用在线生物信息学软件miRanda预测发现PTEN的mRNA的3'-UTR含有能和miRNA-21成熟序列结合的位点,提示PTEN可能是miRNA-21的靶基因。为了进一步证实miRNA-21对口腔鳞癌细胞PTEN表达的调节,我们检测了口腔鳞癌细胞中miRNA-21和PTEN表达水平之间的关系。Western blot检测结果显示,在Tca8113细胞中转染miRNA-21 mimics增加miRNA-21的表达水平后,细胞内PTEN表达水平明显下降,与mimics阴性对照组和空白对照组比较,差异均有统计学意义(P<0.05);在Tca8113/DDP细胞中转染miRNA-21 inhibitor降低miRNA-21的表达水平后,细胞内PTEN表达水平明显升高,与inhibitor阴性对照组和空白对照组比较,差异均有统计学意义(P<0.05),见图2A。这一结果表明miRNA-21抑制了口腔鳞癌细胞中PTEN的表达。
为了进一步明确miRNA-21通过与3'-UTR结合调节PTEN表达,我们构建了含有PTEN的3' -UTR序列的荧光素酶报告基因表达载体WT-PTEN,同时构建了PTEN 3'-UTR区miRNA-21结合种子序列突变的载体Mut-PTEN。见图2B。Tca8113细胞中,表达野生型PTEN的3' -UTR序列的细胞中,转染miRNA-21 mimics上调miRNA-21的水平与转染miRNA对照组相比荧光素酶活性明显下降(P<0.01),说明miRNA-21抑制了荧光素酶的表达。转染突变型PTEN的3'-UTR序列的细胞中,miRNA-21 mimics上调miRNA-21的水平与对照组相比荧光素酶活性无明显差异(P>0.05),说明与miRNA-21是通过打靶并结合PTEN的3'-UTR来调节蛋白表达的。见图2C。

图2 PTEN为miRNA-21靶基因
3 讨论
miRNA是近年发现的小型非编码RNA,可特异性识别靶mRNA的3'-UTR并与之结合,促进靶mRNA的降解和(或)翻译抑制而发挥负调控基因表达的作用。近年来,大量研究表明miRNA可以调控肿瘤增殖、凋亡及耐药相关靶基因的表达,在肿瘤耐药过程中发挥着至关重要的作用[8]。近年研究发现,miRNA-21参与了肿瘤发生和发展的调节。如,在乳腺癌、结直肠癌和肺癌的肿瘤组织中,miRNA-21表达明显上调[9]。近期研究发现miRNA-21在肿瘤的耐药形成中也发挥着至关重要的作用。在对人非小细胞肺癌细胞和耐顺铂细胞的研究中发现,在耐药细胞中miRNA-21表达水平明显高于亲本细胞,且下调耐药细胞中miRNA-21的表达水平可明显逆转耐药细胞对顺铂的敏感性[6]。在食管癌EC9706细胞中,miRNA-21可降低EC9706/DDP细胞对顺铂的耐药性[10]。但是miRNA-21是否参与及通过何种机制调节口腔鳞癌细胞的耐药,目前尚未有相关文献报道。
我们的研究首次发现,miRNA-21在顺铂耐药口腔鳞癌细胞株Tca8113/DDP中表达水平明显高于其亲本细胞Tca8113;通过上调Tca8113细胞中miRNA-21的表达可促进其对顺铂的耐药,下调Tca8113/DDP细胞中miRNA-21表达可逆转其对顺铂的耐药。由此可证实,miRNA-21参与了口腔鳞癌细胞耐药的调节。
为了进一步明确miRNA-21通过何种机制调控Tca8113/DDP细胞的耐药,我们应用在线生物信息学miRNA靶基因预测软件miRanda对miRNA-21的靶基因进行了预测,结果提示PTEN可能为miRNA-21的靶基因之一。PTEN基因全长200 kb,包含有9个外显子和8个内含子,编码是一个由403个氨基酸残基组成的蛋白,是最早发现的具有磷酸酶活性的肿瘤抑制基因,能够维持正常的物质代谢和内环境自稳态。PTEN是已经公认的在人类肿瘤中最容易突变的肿瘤抑制基因之一,细胞突变后可导致易患肿瘤综合征,能够抑制磷脂酰肌醇3-激酶蛋白家族的活性,与肿瘤的发生发展关系密切[11]。研究人员在乳腺癌、肺癌、胃癌等肿瘤组织中发现PTEN低表达,且与疾病严重程度有关,在该肿瘤中起负性调节作用[12]。口腔鳞状细胞癌中亦发现PTEN低表达,PTEN蛋白的表达水平与临床分期及分化程度有关,较低PTEN水平伴淋巴结转移的风险升高[13~14]。以上研究结果提示PTEN低表达在肿瘤发生发展具有重要作用。
为了证明在口腔鳞癌中miRNA-21和PTEN基因之间的调控关系,我们对口腔鳞癌细胞株进行miRNA-21 mimics和inhibitor的转染分别促进和抑制miRNA-21的表达,Western blot实验证实通过上调或下调miRNA-21的表达,相应细胞中PTEN的表达水平也下调或上调。然后我们应用双荧光素酶报告基因检测系统验证两者之间的靶向调控关系,证明了miRNA-21可以直接调控PTEN基因,与Yang等[7]研究结果一致。在后续研究中,我们将对PTEN在口腔鳞癌细胞中发挥的生物功能进行深入研究。并将进一步研究在口腔鳞癌细胞中PTEN作为miRNA-21的靶基因是否介导了miRNA-21对口腔鳞癌细胞耐药的调节。
综上所述,miRNA-21在口腔鳞癌耐顺铂细胞Tca8113/DDP中异常高表达,下调其表达可部分逆转Tca8113/DDP对顺铂的耐药性,这可能为临床上治疗口腔鳞癌耐药提供新的靶点。miRNA-21可能通过作用于PTEN,参与调控口腔鳞癌顺铂耐药的发生发展,具体调控机制尚待进一步研究。
[1]Taghavi N,Yazdi I.Prognostic factors of survival rate in oral squamous cell carcinoma:clinical,histologic,genetic and molecular concepts[J].Arch Iran Med,2015,18(5):314-319
[2]YoshikawaK,NoguchiK,NakanoY,etal.TheHippopathway transcriptional co-activator,YAP,confers resistance to cisplatin in human oral squamous cell carcinoma[J].Int J Oncol,2015,46(6): 2364-2370
[3]Jiang F,Zhao W,Zhou L,et al.MiR-222 targeted PUMA to improve sensitization of UM1 cells to cisplatin[J].Int J Mol Sci,2014,15(12): 22128-22141
[4]Yu DD,Lv MM,Chen WX,et al.Role of miR-155 in drug resistance of breast cancer[J].Tumour Biol,2015,36(3):1395-1401
[5]吴振华,陶中华,张剑,等.MicroRNA-21调控乳腺癌对吉西他滨耐药的机制[J].中国癌症杂志,2015,25(5):326-332
[6]Dong Z,Ren L,Lin L,et al.Effect of microRNA-21 on multidrug resistance reversal in A549/DDP human lung cancer cells[J].Mol Med Rep,2015,11(1):682-690
[7]Yang SM,Huang C,Li XF,et al.miR-21 confers cisplatin resistance in gastric cancer cells by regulating PTEN[J].Toxicology,2013,306: 162-168
[8]Xue J,Niu J,Wu J,et al.MicroRNAs in cancer therapeutic response: Friend and foe[J].World J Clin Oncol,2014,5(4):730-743
[9]Shen L,Wan Z,Ma Y,et al.The clinical utility of microRNA-21 as novel biomarker for diagnosing human cancers[J].Tumour Biol,2015,36(3):1993-2005
[10]潘雪,李向楠.微小RNA-21反义寡核苷酸对食管癌顺铂耐药细胞的影响[J].中华实验外科杂志,2015,32(5):1072-1074
[11]Yang Y,Yang JJ,Tao H,et al.MicroRNA-21 controls hTERT via PTEN in human colorectal cancer cell proliferation[J].J Physiol Biochem,2015,71(1):59-68
[12]Milella M,Falcone I,Conciatori F,et al.PTEN:Multiple Functions in Human Malignant Tumors[J].Front Oncol,2015,(5):24
[13]李善昌,赵聪,姜炳华,等.PI3K与PTEN蛋白在口腔鳞癌中的表达及相关性研究[J].北京口腔医学,2015,23(3):132-134
[14]RahmaniA,AlzohairyM,BabikerAY,etal.Clinicopathological significance of PTEN and bcl2 expressions in oral squamous cell carcinoma[J].Int J Clin Exp Pathol,2012,5(9):965-971
Expressions of MicroRNA-21 in Oral Squamous Cell Carcinoma and Its Correlation with Drug Resistance by Targeting PTEN
CHEN Jian-ping1,WANG Ping2,YANG Gen-ping2,OUYANG Shao-bo3,HUANG Zi-kun4
(1Department of Stomatology,the People's Hospital of Xiangdong District of Pingxiang City,Jiangxi337055;2Department of Stomatology,the TCM Hospital of Xiangdong District of Pingxiang City,Jiangxi337016;3Affiliated Oral Hospital of Nanchang University,Jiangxi330006;4Department of Clinical Laboratory,the First Affiliated Hospital of Nanchang University,Jiangxi330006)
Objective:To investi gate the expression of microRNA-21(miRNA-21)in cisplatin-resistant oral squamous cell carcinoma cells and its mechanism.Methods:Real-time PCR(RT-PCR)was used to detect the expression of miRNA-21 in cisplatin-resistant oral squamous cell carcinoma cell line Tca8113/DDP and its parent cell line Tca8113.miRNA-21 mimics and miRNA-21 inhibitor in vitro was transiently transferred into Tca8113 and Tca8113/DDP cells respectively.The expression level of miRNA-21 was detected by RT-PCR.Cell viability was analyzed by CCK8 assay.Expression of epithelial membrane protein-1(PTEN)protein was detected by Western blot.Bioinformatics software predicted the potential target genes of miRNA-21 and dual luciferase reporter gene was used to analyze the binding between miRNA-21 and 3'-UTR of PTEN.Results:The expression level of miRNA-21 was up-regulated in Tca8113/DDP cells as compared with Tca8113 cells(P<0.01).The relative expression level of miRNA-21 in miRNA-21 mimics-transfected Tca8113 was significantly increased.Over-expression of miRNA-21 inhibited cisplatin chemosensitivity(P<0.05),and the up-regulation of miRNA-21 led to a significant decrease in the PTEN protein levels(P<0.05).The relative expression 1evel of miRNA-21 in miRNA-21 inhibitor-transfected Tca8113/DDP was significantly decreased.Low-expression of miRNA-21 promoted cisplatin chemosensitivity(P<0.05),and the down-regulation of miRNA-21 led to a significant increase in the PTEN protein levels(P<0.05).Dual luciferase reporter gene assay indicated that miRNA-21 regulated PTEN expression by binding to the 3'-UTR of PTEN mRNA.Conclusions:The expression of miRNA-21 was up-regulated in Tca8113/DDP cells.Down-regulation the expression of miRNA-21 could partially reverse the cisplatin-resistance.miRNA-21 may play a vital role in oral squamous cell carcinoma drug resistance by targeting PTEN.
Oral squamous cell carcinoma;MicroRNA-21;Cisplatin;Drug resistance;PTEN
R739.8
B
10.13638/j.issn.1671-4040.2015.12.006
2015-08-26)

