应用Talen法制备apoE基因敲除大鼠模型
徐影琪, 李晓晶, 杨 葳, 周生来, 于 洋,
王 惟1, 张婀娜1, 赵 文1, 张梅英1, 郭大勇2, 王宏宇2, 郑志红1
(1. 中国医科大学实验动物部, 沈阳 110001; 2. 南京徇齐生物技术有限公司, 南京 210061)
应用Talen法制备apoE基因敲除大鼠模型
徐影琪1, 李晓晶2, 杨葳1, 周生来1, 于洋1,
王惟1, 张婀娜1, 赵文1, 张梅英1, 郭大勇2, 王宏宇2, 郑志红1
(1. 中国医科大学实验动物部, 沈阳110001; 2. 南京徇齐生物技术有限公司, 南京210061)
目的应用转录激活因子样效应因子核酸酶(Talen)法制备载脂蛋白E(apoE)基因敲除大鼠模型,为进一步研究apoE基因功能,动脉粥样硬化(AS)疾病发病机制及治疗方法奠定基础。方法设计并合成针对大鼠apoE基因的Talen序列,应用原核显微注射方法制备子代鼠。通过PCR-测序及TA克隆-测序法检测仔鼠中apoE的突变,经传代及兄妹交配获得纯合型仔鼠,并对其基因型进行鉴定。应用Western blot方法检测apoE-/-仔鼠各组织中ApoE蛋白表达水平; 血清学分析血脂总胆固醇(CHO)及甘油三酯(TG)含量; 应用RT-PCR方法检测脂质代谢相关基因三磷酸腺苷结合盒转运体A1(ABCA1)的表达。结果经鉴定选取在第二外显子处缺失1 bp,造成开放阅读框移码突变的大鼠为阳性F0代仔鼠,该鼠经传代及筛选,最终获得apoE-/-大鼠。Western blot检测显示apoE-/-鼠在心、肝、肾、脑、卵巢组织中未见ApoE蛋白的表达, 表明在该模型中成功实现了apoE基因的敲除。apoE-/-鼠血脂CHO、TG均高于野生SD大鼠,其中CHO水平呈现显著性差异(P<0.05)。在apoE-/-鼠肝组织中ABCA1的表达降低,可能起到促进AS形成的作用。结论应用Talen法成功制备apoE基因敲除SD大鼠; 经筛选获得了纯合型apoE-/-大鼠,该模型实现了apoE基因敲除,并表现为高血脂及AS性状。
转录激活因子样效应因子核酸酶(Talen); 载脂蛋白E(ApoE); 基因敲除; 大鼠
动脉粥样硬化(atherosclerosis, AS)的发生发展受多种遗传和外界因素的影响, 血脂代谢异常是导致AS的重要始动因素之一。载脂蛋白( apolipoprotein,Apo)在血浆总胆固醇( cholesterol, CHO)和甘油三酯(triglyceride, TG)的转运、代谢中起关键作用。载脂蛋白E(apolipoprotein E, ApoE) 是清除乳糜微粒和极低密度脂蛋白受体的配体,缺乏ApoE蛋白会导致血液循环中富含胆固醇的物质积累,而更加容易引起AS病灶形成。1992年,用于研究AS的载脂蛋白E(apoE)基因缺陷小鼠问世,有了研究AS较好的动物模型[1]。但由于受到大鼠胚胎干细胞培养困难的制约,利用同源重组法制备apoE基因敲除的大鼠模型比较困难。近年来,基因组编辑技术发展迅猛,为基因敲除的发展提供了良好的技术支持。转录激活因子样效应因子核酸酶(transcriptionactibator like effector nucleases, Talen)可以对DNA双链分子进行切割,形成DNA双链断裂切口(DNA double-strand break),然后激活细胞内非同源末端连接(nonhomologous end joining)修复切口[2-5],修复的结果常造成微小的基因片段插入或缺失,从而达到基因敲除目的。本研究应用Talen法制备apoE基因敲除大鼠模型,筛选出纯合子后检测ApoE蛋白表达及血清中总胆固醇及甘油三酯含量,并检测与AS发生发展相关的基因三磷酸腺苷结合盒转运体A1(ABCA1)的表达,为AS相关致病机制的更进一步研究奠定基础。
1 材料与方法
1.1实验动物
显微注射用5周龄SPF级大鼠和12~20周龄受体SD大鼠, 传代用及对照组SD大鼠均来源于北京维通利华实验动物技术有限公司[SCXK(京)2012-0001]。所有实验用SD大鼠均在SPF级动物房饲养和繁殖, 温度控制在24±2℃, 自动光控(L: D=12h∶12h,光照周期为7∶00~19∶00)[SYXK(辽)2013-0007]。
1.2试剂
矿物油(胚胎级)、M2培养基、M16培养基购自Sigma公司,孕马血清促性腺激素(PMSG)购自宁波市激素制药厂,人绒毛膜促性腺激素(hCG)购自上海生物生化制药厂。引物合成自三博远志生物公司,dNTP Mixture、DNA聚合酶及配套反应缓冲液、凝胶回收纯化kit、pMD-18T载体及DNA连接酶kit、感受态DH5α(E.coli)、质粒提取试剂盒购自大连宝生物公司。测序由南京金斯瑞公司完成。Western blot相关试剂为本室自存, ApoE抗体购自Santa cruz公司,二抗购自中杉金桥公司。总胆固醇(CHO)、甘油三脂测(TG)定试剂盒购自中生北控生物科技股份有限公司。Trizol购自Invitrogen公司; 反转录试剂盒购自大连宝生物公司。
1.3apoE基因敲除大鼠模型的建立
1.3.1显微注射选取受精卵将针对apoE基因的Talen 片段注入原核。将注射后状态良好的受精卵移植入假孕母鼠的输卵管中, 等待F0代(founder)出生。
1.3.2 F0代大鼠的检测
1.3.2.1PCR测序鉴定剪取出生15 d仔鼠尾组织,在蛋白酶K作用下55 ℃水浴摇床过夜消化,酚氯仿法抽提鼠尾基因组DNA,设计合成特异的检测引物,进行PCR反应。正向引物: 5'-ACCAGCCTAGTCTCAGCTCT-3'; 反向引物: 5'-TAGGGTGGGAGGAAACCACA-3',产物为670 bp。 反应条件为: 94℃, 5 min; 94 ℃, 30 s, 60 ℃, 45 s, 72 ℃, 45 s, 34个循环; 72℃, 10 min, 应用质量分数1%琼脂糖凝胶电泳观察结果。扩增产物送南京金斯瑞公司测序。测序引物: 5'-ACCAGCCTAGTCTCAGCTCT-3'。
1.3.2.2TA克隆测序鉴定选取PCR测序结果出现套峰的F0代仔鼠编号, 进行PCR-TA克隆实验来进一步鉴定。根据T载体说明书, 扩增PCR片段, 引物同PCR检测; 产物纯化后将该片段连接入pMD-18T载体,转化感受态DH5α, 经蓝白斑筛选出成功插入T载体中的克隆。挑取6~10个克隆,摇菌扩增,提取质粒后进行测序分析。测序引物为载体通用引物M13-47。测序结果与apoE基因野生型序列进行比对, 进而确定阳性F0代(founder)的编号。
1.4筛选纯合型apoE基因敲除大鼠
采用经典育种与PCR-测序检测相结合的方法进行apoE基因敲除鼠纯合子筛选。将阳性原代鼠(founder, F0代)与野生型SD大鼠配种进行繁殖,出生仔鼠为F1代。F1代中PCR测序结果出现套峰,并与F0代相同的鼠判定为阳性。F1代仔鼠同胞交配,出生仔鼠为F2代。F2代仔鼠经鼠尾DNA提取,PCR测序检测,结果无套峰,与野生型序列相比出现插入或缺失,并且插入或缺失的情况与原代鼠TA克隆结果一致的编号判定为纯合型。
1.5Westen blot检测ApoE蛋白的表达
apoE-/-大鼠及对照野生型SD大鼠颈椎脱臼处死后,分别取心、肝、肾、脑、卵巢组织,提取各组织总蛋白,应用Western blot方法检测各组织中ApoE蛋白的表达水平。
1.“取长”则需要“知长”。教师、学生、知识体系的三维体系极大地推动了“互动式教学模式”的运用,相比较于传统的知识传授方式,“人机互动”方式更有利于加强对教学资源的整合。而伴随着云时代成长起来的学生,则对这种教学形式有着天然的好感。他们对认识世界的需求需要大量的社会资源做铺垫,且教师也可以通过这一平台随时了解学生的学习情况。有了“人机互动”的平台,这些原本近在咫尺却很难获得的教学资源自然而然就成为学生随手可以获取的财富。
1.6apoE-/-鼠及对照野生型鼠血脂CHO及TG检测
实验组为apoE-/-大鼠, 对照组为野生型SD大鼠, 每组4只, 均为6~7月龄。眼眶静脉丛取血获得apoE-/-大鼠及野生型SD大鼠血液, 室温3 000 r/min离心20 min,取上清即为血清样品,按照血脂CHO 及TG测定试剂盒步骤进行检测,后应用独立样本t检验方法对所得数据进行统计学分析,P<0.05为差异有统计学意义。
1.7ABCA1的表达检测
应用Trizol法提取apoE-/-大鼠及野生型SD大鼠肝组织的总RNA,反转录成cDNA,后经PCR检测ABCA1的表达。PCR引物见表1。PCR反应条件为: 94℃, 5 min; 94℃,30 s,60℃,30 s,72℃,30 s,30个循环; 72℃,10 min,应用质量分数1.5%琼脂糖凝胶电泳观察结果。
2 结果
2.1apoE-/-大鼠基因型鉴定
测序结果应用NCBI Blast工具进行比对,发现apoE-/-大鼠中apoE基因在第二外显子处缺失1 bp,这将造成移码突变,进而实现了apoE基因的敲除。结果见图1,缺失部分用蓝色标识。

表1 RT-PCR引物序列及产物长度
2.2apoE-/-大鼠各组织中ApoE蛋白表达检测
Western blot结果表明, 在apoE-/-大鼠的心、肝、肾、脑、卵巢组织中, ApoE未表达, 而野生型SD大鼠中可见ApoE的表达, 这说明该模型鼠实现了apoE基因在表达水平的敲除, 证明该敲除模型良好(图2)。
apoE-/-大鼠血脂CHO水平显著高于野生型大鼠(P<0.05),TG水平略高于野生型大鼠,但无显著性差异(P>0.05)(表2)。
2.4ApoE对ABCA1的影响
RT-PCR结果显示,apoE-/-大鼠肝组织中ABCA1表达降低(图3)。
3 讨论

图1 apoE-/-大鼠测序结果与野生型序列比对结果
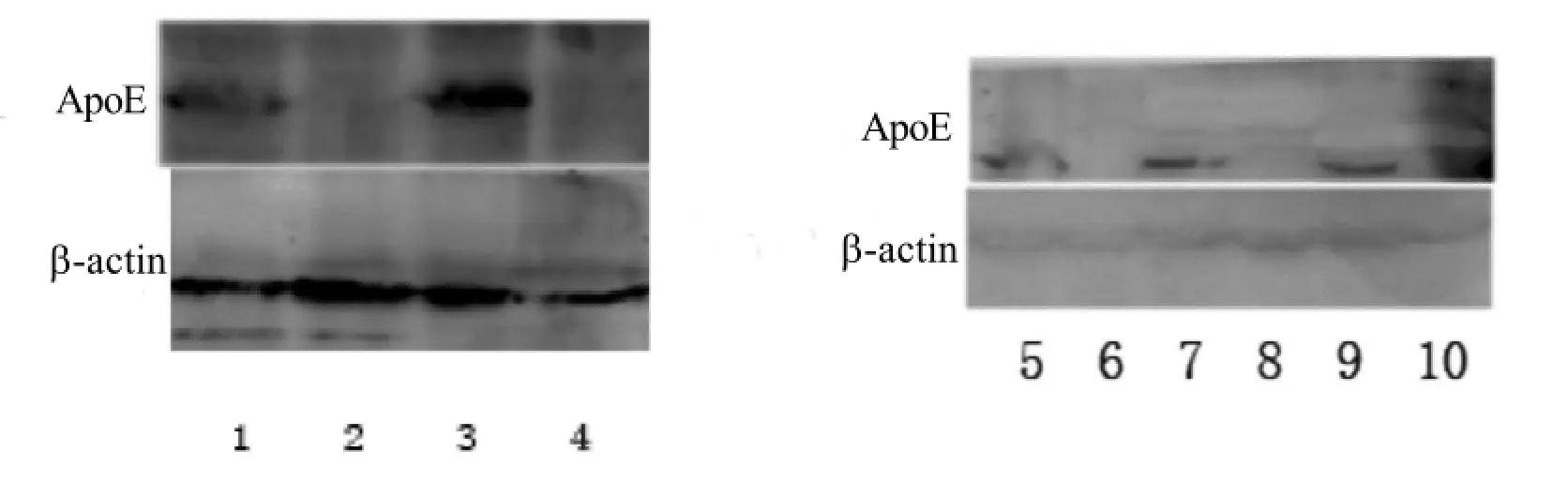
图2 apoE-/-大鼠及野生型SD大鼠各组织中ApoE蛋白的表达

表2 大鼠血脂CHO及TG含量检测

图3 apoE-/-大鼠及对照野生型SD大鼠肝组织中ABCA1 的表达
AS动物模型的建立对于AS致病机制的研究及治疗药物的筛选具有重要意义。以往的AS 动物模型多采用大量脂肪、胆固醇负荷的大鼠或小鼠制作,但由于大鼠或小鼠先天具有抵抗胆固醇的特性, 在制作模型时胆固醇负荷往往是20倍于正常膳食的急性过程,这与人类实际的慢性高脂血症情况相差甚远[6,7]。随着分子生物学和动物实验胚胎学的发展和相互渗透促进了转基因技术的快速发展,转基因小鼠动物模型被人们普遍认为是解析人类基因组功能的重要技术手段之一。而大鼠体型较大,更适合体内成像、电生理手术等操作, 尤其在生理某些行为、代谢等方面更接近人类, 所以大鼠是某些心脑血管疾病研究、毒理学研究、神经学和行为学研究理想的动物模型[8], 然而, 由于受胚胎干细胞操作的限制, 目前用于AS研究的基因缺陷大鼠模型很少。本实验中采用大鼠制备AS相关的基因缺陷模型, 以期建立一个更适于AS研究的新模型。
ApoE是脂质代谢中重要的参与者。缺乏ApoE会导致血液循环中富含胆固醇的物质积累, 总胆固醇、低密度脂蛋白和极低密度脂蛋白含量升高[9],进而形成严重的高脂血症及AS病灶。这在小鼠模型中已经被证实, 因此本实验中选择制备apoE基因敲除的大鼠模型。
近年来,位点特异性核酸切割酶技术获得飞速发展,为基因组精确编辑带来了革命性的变化,也为大鼠基因敲除模型的建立提供了新的方法。位点特异性核酸切割酶包括锌指核酸酶(ZFN)、Talen和成簇规律间隔短回文重复序列系统(CRISPR/Cas system),通过识别特定的DNA序列进行切割进而引发突变, 实现对基因组的精确修饰。Talen技术主要是应用转录激活样效应子结构域来实现与DNA的特异性结合[10]。转录激活样效应子是黄单胞菌进入植物细胞分泌的一种蛋白质,由多个能够特异性识别DNA的串联“蛋白质模块”和两侧的N 端及C 端序列组成。每一个蛋白质模块包括34个氨基酸,第12和13位氨基酸残基负责识别单个的脱氧核糖核苷酸。因此,当足够多的蛋白质模块串联在一起时,就能够特异性地识别一段DNA序列[11,12]。2011年,Tesson 等[13]通过Talen的胚胎显微注射成功获得了基因敲除的大鼠。Talen和ZFN相比,识别位点更广泛,几乎可以敲除所有的基因;剪切效率更高,在Tesson等[13]研究中,使用Talen法阳性率为59%,而相应的使用ZFN方法的成功率为19%。故本实验中应用Talen方法制备apoE基因敲除大鼠,成功获得了apoE基因移码突变的大鼠,经育种筛选出纯合型仔鼠。本研究获得的apoE-/-大鼠中ApoE蛋白在心、肝、肾、脑、卵巢等组织未见表达,初步证明该模型实现了apoE基因的剔除。
大鼠血脂总胆固醇(CHO)及甘油三酯(TG)水平与其性别、年龄、营养状况及饲养条件等均有关[14],日龄越大, 体质量越大,其CHO及TG水平越高。6~7月龄大鼠已完成发育阶段,相当于人类成年阶段[15],生理指标趋于稳定,日龄差异对血脂CHO 及TG水平的影响变小,而此时,体质量对血脂CHO及TG水平的影响变大, 故本研究中, 作者选择体质量近乎相同的野生型大鼠作为对照。经检测,apoE-/-大鼠CHO含量显著高于野生型大鼠(P<0.05),表明该模型鼠呈现高血脂状态。apoE-/-大鼠TG含量也高于野生型大鼠, 但差异无统计学意义,这可能与该模型大鼠未经高脂饮食诱导有关。
ABCA1为膜整合蛋白, 以 ATP 为能源将胞内游离胆固醇和磷脂转运到胞膜, 最终与附在细胞表面的载脂蛋白 AI (apoprotein AI, ApoAI)结合[16], 这一过程对于减少血管壁脂质蓄积泡沫细胞形成和血管壁炎症反应均具有重要意义。在C57BL/6小鼠中, Joyce等[17]最先证明了ABCA1过表达具有抗AS作用,过表达肝脏和巨噬细胞ABCA1后,明显抑制主动脉AS斑块的进展。Miranda等[18]利用低密度脂蛋白敲除小鼠, 观察了巨噬细胞过表达ABCA1对高密度脂蛋白水平和AS的影响,结果显示巨噬细胞过表达ABCA1 明显减少小鼠AS斑块的进展,但对高密度脂蛋白的水平没有明显影响。而ABCA1基因敲除动物不仅表现出低的血浆高密度脂蛋白水平,还表现出胰腺β细胞功能紊乱、体内促炎状态和AS斑块的形成。多种促AS的炎症因子和代谢产物可能通过下调ABCA1的表达, 从而促进AS相关心血管疾病的发展[19,20]。选择性地敲除巨噬细胞ABCA1可显著增加apoE敲除和低密度脂蛋白受体敲除小鼠AS的进展, 在此过程中巨噬细胞胆固醇流出的另外两个受体ABCG1和清道夫受体BI (SR-BI) 起着重要的协同作用[21,22]。本研究中,apoE-/-大鼠肝组织中,ABCA1在mRNA水平表达降低,这可能起到促进AS发展的作用。
综上,作者应用Talen方法制备apoE基因敲除的大鼠模型,并获得了纯合型仔鼠,经过一系列实验证实该大鼠模型表现出高血脂及AS表型该模型为进一步更好地研究apoE基因功能及深入了解AS致病机制奠定基础。
[1]Plump AS, Smith JD, Hayek T, et al. Severe hypercholester olemia and atherosclerosis in apolipoprotein E-deficient mic created by homologous recombinetion in ES Cells [J]. Cell 1992, 71(10):343-353.
[2]Christian M, Cermak T, Doyle EL, et al. Targeting DNA double-strand breaks with TAL effector nucleases[J]Genetics, 2010, 186(2):757-761.
[3]Urnov FD, Rebar EJ, Holmes MC, et al. Genome editing with engineered zinc finger nucleases[J]. Nat RevGenet, 2010, 11 (9):636-646.
[4]Miller JC, Tan S, Qiao G, et al.A TALE nuclease architectur for efficient genome editing[J]. Nat Biotechnol, 2011, 29(2)143-148.
[5]Mahfouz MM, Li L, Shamimuzzaman M, et al. De novo engineered transcription activator-like effector (TALE hybrid nuclease with novel DNA binding specificity create double-strand breaks [J]. Proc Natl Acad Sci U S A, 2011, 108 (6):2623-2628.
[6]Breslow JL. Mouse models of atherosclerosis [J]. Science 1996, 272(5262):685-688.
[7]刘雪梅, 吴符火. 几类高脂血症动物模型的比较[J] . 中西医结合学报, 2004, 2(2):132-134.
[8]Zheng S, Geghman K, Shenoy S, et al. Retake the cente stagenew development of rat genetics [J]. Genet Genomics 2012, 39(6):261-268.
[9]Zhang SH, Reddick RL , Piedrahita JA , et al. Spontaneou hypercholesterolemia and arterial lesions in mice lacking aopolipoprotein E[J]. Science, 1992, 258 (10):468-471.
[10] Mahfouz MM, Li L, Shamimuzzaman M, et al. De novo engineered transcription activator-like effector (TALE) hy brid nuclease with novel DNA binding specificity create double-strand breaks[J]. Proc Natl Acad Sci U S A, 2011, 108 (6): 2623-2628.
[11] Boch J, Scholze H, Schornack S, et al. Breaking the code o DNA binding specificity of TAL-type III effectors[J]. Science 2009, 326(5959):1509-1512.
[12] Moscou MJ, Bogdanove AJ. A simple cipher governs DNA recognition by TAL effectors[J]. Science, 2009, 326(5959)1501.
[13] Tesson L, Usal C, Menoret S, et al. Knockout rats generated by embryo microinjection of TALENs[J]. Nat Biotechnol 2011, 29(8):695-696.
[14] 邹移海, 陈嘉, 谢玲玲, 等. 实验性大鼠血脂检测[J] . 实验动物科学与管理, 2004, 21(1):4-5.
[15] 施新猷. 医用实验动物学[M]. 北京: 人民军医出版社, 1999: 388.
[16] Yin K, Liao DF, Tang CK. ATP-binding membrane cassettetransporterA1 (ABCA1): a possible link between inflammation and reverse cholesterol transport[J]. Mol Med,2010, 16(9-10):438-449.
[17] Joyce C, Freeman L, Brewer HB, et al. Study of ABCA1 function in transgenic mice[J]. Arterioscler Thromb Vasc Biol, 2003, 23(6):965-971.
[18] Van Eck M, Singaraja RR, Ye D, et al. Macrophage ATP-binding cassette transporter A1 overexpression inhibits atherosclerotic lesion progression in low-density lipo-protein receptor knockout mice[J]. Arterioscler Thromb Vasc Biol,2006, 26(4):929-934.
[19] Coutinho JM, Singaraja RR, Kang M, et al. Complete functional rescue of the ABCA-/-mouse by human BAC transgenesis[J]. J Lipid Res, 2005, 46(1):113-123.
[20] van Eck M, Bos IS, Kaminski WE, et al. Leukocyte ABCA1 control susceptibility to atherosclerosis and macrophage recruitment into tissues[J]. Proc Natl Acad Sci U S A, 2002,99 (6):298-303.
[21] Zhao Y, Pennings M, Hildebrand RB, et al. Enhanced foam cell formation, atherosclerotic lesion development, and inflammation by combined deletion of ABCA1 and SR-BI in bone marrow-derived cells in LDL receptor knockout mice on western-type diet[J]. Circ Res, 2010, 107(12):e20-31.
[22] Out R, Hoekstra M, Habets K, et al. Combined deletion of macrophage ABCA1 and ABCG1 leads to massive lipid accumulation in tissue macrophages and distinct atherosclerosis at relatively low plasma cholesterol levels[J]. Arteioscler Thromb Vasc Biol, 2008, 28(2):258-264.
Establishment of apoE Gene Knockout Model on SD Rat Using Talen Method
XU Ying-qi1, LI Xiao-jing2, YANG Wei1, ZHOU Sheng-lai1, YU Yang1, WANG Wei1, ZHANG E-nuo1,
ZHAO Wen1, ZHANG Mei-ying1, GUO Da-yong2, WANG Hong-yu2, ZHENG Zhi-hong1
(1. Laboratory Animal Center, China medical university, Shenyang 110001, China;2. SyncBiotech Co. Ltd, Nanjing 210061, China)
Objective To establish the apoE gene knockout-rat model using Talen method, and provide a basis for further study on the function of the apoE gene, the pathogenesis and treatment of atherosclerotic disease. Methods The Talen sequences were designed and synthesized for the rat apoE gene, and then the linearized and purified fragments were injected into fertilized eggs of SD rat through microsopic injection. Positive rats were detected by PCR-sequencing and TA clone-sequencing. The homozygous type offspring were obtained by siblings mating, and the genotype was identified. Western blot was used to detect the expression level of ApoE protein in some tissues of apoE-/-rat. The plasma levels of total cholesterol and triglyceride levels have also been detected. The expression of ATP binding cassette transporter A1 (ABCA1) which was related to the lipid metabolism was detected by reverse transcriptase polymerase chain reaction (RT-PCR). ResultsSequencing analysis indicated that there had a deletion of 1 bp in the second exon, resulting in open reading frame shift mutation in the rat, and obtained the apoE-/-rats. Western blot test showed that no expression of ApoE protein in the heart, liver,kidney, brain and ovary of apoE-/-rats, and the apoE gene was successfully knocked out. The total cholesterol and triglyceride levels of apoE-/-rats were higher than that of wild type SD rats, and the total cholesterol levels have the significantly different (P<0.05). The expression of ABCA1 in the liver of the apoE-/-rats was decreased, which may play a role of AS promoting. ConclusionsapoE-/-rats were obtained by Talen method. The apoE gene has been knocked out, and the rats can be considered as the model rats showed hyperlipemia and atherosclerosis.
Talen; Apolipoprotein E (ApoE); Gene knockout; Rat
10.3969/j.issn.1674-5817.2015.04.003
Q95-33
A
1674-5817(2015)04-0277-06
2015-05-31
国家重大科技专项(2011ZX09307-302-02), 辽宁省科技计划项目(2013408001)
徐影琪(1985-), 女, 硕士, 助教。E-mail: xuyq706@163.com
郑志红(1969-), 女, 博士, 教授, 从事实验动物转基因及基因敲除研究。E-mail: zhihongzheng@163.com王宏宇(1974-), 女, 博士, 从事基因编辑技术及代谢紊乱机制的研究。E-mail: xunqi@nbri-nju.com

