无催化剂水相下合成苯并吡喃类衍生物的研究
程益民,谢建武
(1.金鑫药业有限公司,浙江金华321004;2.浙江师范大学化学与生命科学学院,浙江金华321004)
精细化工
无催化剂水相下合成苯并吡喃类衍生物的研究
程益民1,谢建武2*
(1.金鑫药业有限公司,浙江金华321004;2.浙江师范大学化学与生命科学学院,浙江金华321004)
在无催化剂的水相下,水杨醛及丙二腈发生Knoevenagel缩合-分子内关环-M ichael加成串联反应,提供了一条简单的、原子经济性的、高效的合成苯并吡喃类衍生物的方法。
苯并吡喃衍生物;无催化剂;水相
苯并吡喃类衍生物是一类重要的杂环化合物,广泛存在于蔬菜和水果中[1]。研究发现,苯并吡喃结构单元具有防止多种疾病的功能,如消炎、抗病毒、抗高血压、抗增生、抗肿瘤、利尿、解痉等[2-4]。此外,苯并吡喃类衍生物还是一种良好的认知促进剂,可用于治疗神经退行性疾病,包括肌萎缩性侧索硬化症、帕金森氏症、亨廷顿氏病、阿尔茨海默氏病以及用于治疗精神分裂症和肌阵挛性痴呆及唐氏综合症等[5]。由于苯并吡喃类衍生物具有重要的生物活性及药理活性,其合成方法得到了广泛的研究。目前,以水杨醛与活泼的亚甲基化合物(如丙二腈、腈基乙酸乙酯)为原料反应是合成2-氨基苯并吡喃衍生物的最主要途径。研究表明,哌啶、三乙胺、二乙胺、奎宁、硫脲、NaHCO3等[6-10]都能有效催化该反应的进行。但这些方法或多或少都有一些缺点,如有的选择性较差、副产物较多,有的大量消耗有机溶剂,有的反应温度高,有的使用的催化剂无法回收利用等。因此,寻求更温和安全绿色方法来合成苯并吡喃衍生物,仍然是一个研究热点。同时,近期有多篇文献报道了水相中的Knoevenagel缩合反应[11-13],在此启发下,本文提供了一种绿色合成苯并吡喃类衍生物的方法,该方法具有以下优点:无催化剂、以水为溶剂、反应时间短、收率高等。
1 实验部分
1.1试剂与仪器
本文用的试剂均为市售CP或AR级,没有对其进一步纯化,直接使用。有机反应用薄层硅胶板(TLC)跟踪监测。核磁共振在Bruker Avance 400型核磁共振仪上测定,DMSO/CDCl3作为溶剂,四甲基硅烷为内标。在400 MHz下记录1H NMR谱,在100 MHz下的记录13C NMR谱。
1.22-亚氨基-3-腈基苯并吡喃衍生物的合成
在100 mL圆底烧瓶加入15 mL H2O及0.01mol水杨醛,接着将10mL的丙二腈(0.66 g,0.01mol)的水溶液,缓慢滴入到反应瓶中,接着搅拌反应4 h。反应停止后抽滤,所得固体依次用水洗涤2次、少量二氯甲烷洗涤2~3次,得到产物2a-2c。
化合物2a1H NMR(600 MHz,DMSO)8.87(s,1H),8.38(d,J=1.4Hz,1H),7.61~7.57(m,2H),7.27(dd,J=11.0,4.0 Hz,1H),7.21~7.18(m,1H).谱图数据与文献6报道的一致。
化合物2b1H NMR(600 MHz,DMSO)8.89(s,1H),8.29(d,J=1.5 Hz,1H),7.81~7.82(m,1H),7.70~7.73(m,1H),7.16(d,J=9.0 Hz,1H)。谱图数据与文献6报道的一致。
化合物2c1H NMR(600 MHz,DMSO)8.87(s,1H),8.18(d,J=1.5 Hz,1H),7.78~7.80(m,1H),7.70~7.71(m,1H),7.16(d,J=9.0 Hz,1H)。谱图数据与文献6报道的一致。
1.32-氨基-3-腈基苯并吡喃衍生物的合成
在100mL圆底烧瓶中加入20mLH2O、0.01mol水杨醛及1.32 g(0.02 mol)丙二腈,接着在室温下搅拌反应5 h。反应停止后抽滤,所得固体依次用水洗涤2次、少量二氯甲烷洗涤2~3次,得到产物3a~3d。
化合物3a1H NMR(600 MHz,DMSO)7.60~7.50(m,2H),7.52~7.39(m,2H),7.28(tt,J=5.9,2.9 Hz,1H),7.15(d,J=8.2 Hz,1H),5.09(d,J= 4.0 Hz,1H),4.61(d,J=4.0 Hz,1H)。谱图数据与文献8报道的一致。
化合物3b1H NMR(600 MHz,DMSO)7.72(d,J=2.3 Hz,1H),7.68~7.57(m,3H),7.13(d,J=8.8 Hz,1H),5.16(d,J=3.9 Hz,1H),4.63(d,J=3.8 Hz,1H)。谱图数据与文献8报道的一致。
化合物3c1H NMR(600 MHz,DMSO)7.64(s,2H),7.59(d,J=2.5 Hz,1H),7.49(dd,J= 8.8,2.6 Hz,1H),7.19(d,J=8.8 Hz,1H),5.16(d,J=3.9 Hz,1H),4.63(d,J=3.8 Hz,1H)。谱图数据与文献8报道的一致。
化合物3d1H NMR(600 MHz,DMSO)7.86(d,J=65.3 Hz,3H),7.58(s,1H),5.20(s,1H),4.69(s,1H)。谱图数据与文献8报道的一致。
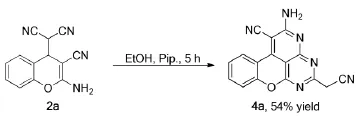
1.4稠杂环吡啶衍生物的合成
在25 mL圆底烧瓶中,以乙醇为反应溶剂,加入0.5 mmol化合物3a、0.5mmol丙二腈,搅拌下滴入一滴哌啶,回流5 h。反应结束后,用硅胶柱色谱分离提纯产物。(洗脱剂V(乙酸乙酯):V(石油醚)=1/5)分离得目标产物4a。
化合物4a棕黄色固体,熔点>300℃;1H NMR(600 MHz,DMSO)7.22(ddd,J=17.9,8.2,4.0 Hz,2H),7.11(td,J=7.5,1.1 Hz,1H),6.97(dd,J=8.1,0.8 Hz,1H),6.81(s,2H),5.77(s,1H),3.46(s,2H)。13C NMR(600MHz,DMSO)161.33(s),149.7,129.2,128.3,124.8,120.1,116.39(s),40.4,40.2,40.1,39.9,39.8,39.7,39.5,24.1. ESI-HRMS:calcd.for C16H8N6O+H 301.0832,found 301.0837。
2 结果与讨论
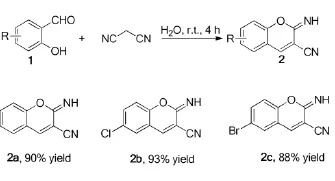
表1 水相中2-亚氨基-3-腈基苯并吡喃衍生物的合成
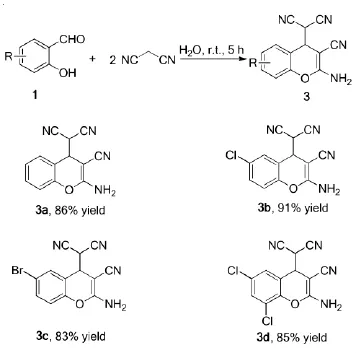
表2 水相中2-氨基-3-腈基苯并吡喃衍生物的合成
考虑到水是一种廉价易得,无污染的溶剂,并且在许多有机反应中得到了广泛的应用。同时,水杨醛由于存在有羟基、醛基,在水中有比较大的溶解度。再者,丙二腈在水中也有较好的溶解度。另外,水也可以以氢键的形式对羰基化合物或者腈基化合物进行活化。基于以上考虑,我们直接以水为溶剂,无催化剂条件下,尝试水杨醛与丙二腈的反应。正如我们意料之中,该反应能够顺利进行,在水中反应4 h之后,原料完全消失,分离得到产物2a,收率高达90%。接着对其他水杨醛进行了尝试,例如5-氯水杨醛及5-溴水杨醛,以水为溶剂,无催化剂条件下,室温搅拌4 h,同样获得很高的收率(如表1)。该反应特别要注意的是,必须将丙二腈水溶液缓慢滴入水杨醛溶液中。
为了进一步拓展该方法的应用,相同的反应条件下,水杨醛与丙二腈的反应摩尔比调整为1:2。从表2中可以看出,反应可以顺利进行。很明显,该反应经历了Knoevenagel缩合、分子内关环、Michael加成串联反应,得到了产物3。底物扩展中发现,电子基团对收率的影响不明显,都能获得较好的收率(83%~91%)。
本文实验所得到的杂环氨基腈衍生物是制备多种稠杂环吡啶时的有用底物,可以与多种活泼亚甲基化合物反应构建杂环体系。于是,我们也尝试在一定溶剂下,将化合物2a继续与过量的丙二腈反应,观察是否能得到稠杂环化合物。实验结果表明,将化合物2a溶于乙醇中,加入哌啶作为催化剂,回流5 h,接着柱层析,可以分离得到主要产物4a,收率约为54%。
3 结论
本文报道了一种合成2-亚氨基-3-腈基苯并吡喃衍生物和2-氨基-3-腈基苯并吡喃衍生物的绿色合成方法。该方法以水为溶剂,无催化剂条件下,等当量的水杨醛与丙二腈发生Knoevenagel缩合反应-分子内环化串联反应,顺利得到目标产物2-亚氨基-3-腈基苯并吡喃衍生物2;而水杨醛与丙二腈的摩尔比为1:2时,该反应发生Knoevenagel缩合反应-分子内关环Michael加成串联反应,得到目标产物2-氨基-3-腈基苯并吡喃衍生物3。化合物可以在哌啶促进下,进一步与丙二腈发生反应得到稠杂环化合物4a。该反应具有条件吻合、操作简单、环境友好等优点,为合成苯并吡喃衍生及稠杂环化合物提供了一条新的途径。
[1]CuriniM,Cravotto G,Epifano,et al.Chemistry and biological activity of natural and synthetic prenyloxycoumarins[J].Curr.Med.Chem.,2006,13:199-222.
[2]Thumar N J,Patel,M P.Synthesis and in vitro antim icrobial evaluation of 4H-pyrazolopyran,-benzopyran and naphthopyran derivativesof1H-pyrazole[J].ARKIVOC,2009,(XIII):363-380.
[3]KemnitzerW,Jiang,S,Kasibhatla S,et al.Discovery of 4-aryl-4H-chromenes as a new series of apoptosis inducers using a cell-and caspase-based HTSassay.Part5:Modifications of the 2-and 3-positions[J].Bioorganic&Medicinal Chemistry Letters.,2008,18:603-607.
[4]孙宏斌,华维一,陈玲,等.反式-4-氨基-3-羟基-3,4-二氢-2,2-二甲基-2-氢-1一苯并吡喃类化合物的合成及其心血管活性[J].高等学校化学学报,1997,18:730-733.
[5]Abdolmohammadi S,Balalaie S.Novel and efficient catalysts for the one-pot synthesis of 3,4-dihydropyrano[c]chromene derivatives in aqueousmedia[J].Tetrahedron Lett,2007,48:3299-3303.
[6]Volmajer J,Toplak R,Leban I,et al.Synthesis of new im inocoumarins and their transformations into N-chloro and hydrazono compounds[J].Tetrahedron,2005,61:7012-7021.
[7]Costa M,Areias F,Abrunhosa L,et al.The Condensation of Salicylaldehydes and Malononitrile Revisited:Synthesis of New Dimeric Chromene Derivatives[J].J.Org.Chem.,2008,73:1954-1962.
[8]Kulkarni M A,Pandit K S,et al.Diethylamine:A smart organocatalyst in eco-safe and diastereoselective synthesis ofmedicinally privileged 2-amino-4H-chromenes at ambient temperature[J].Comptes Rendus Chimie,2013,16:689-695.
[9]Ren Q,Siau W Y,Du Z,et al.Expeditious assembly of a 2-amino-4H-chromene skeleton by using an enantioselective mannich intramolecular ring cyclization-tautomer ization cascade sequence[J].Chem.Eur.J.,2011,17:7781-7785.
[10]Yang G,Luo C,Mu X,et al.Highly efficient enantioselective three-component synthesis of 2-amino-4H-chromenes catalysed by chiral tertiary amine-thioureas[J].Chem.Commun.,2012,48:5880-5882.
[11]史达清,张姝庄,庄启亚,等.水中苯并[h]色烯衍生物的洁净合成[J].有机化学,2003,23(12):1419-1421.
[12]荣良策,李小跃,史达清.水中苯并[h]吡喃衍生物的洁净合成[J].徐州师范大学学报(自然科学版),2005,23(4):60-63.
[13]靳通收,王爱卿,张建设,等.水相中一些有机合成反应的研究进展[J].有机化学,2006,26:1723-1732.
[14]王香善,曾兆森,李玉玲,等.水中取代水杨醛和氰乙酸酯的反应研究[J].有机化学,2006,26:1379-1383.
Catalyst-Free,Synthesis of Benzo[h]chrom ene Derivatives in W ater
CHENG Yi-m in1,XIE Jian-wu2*
(1.Jinxin Phamaceutical Co.,Ltd.,Jinhua,Zhejiang 321004;2.College of Chem istry and Life Science,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)
A simple,atom economical and highly efficient green protocol has been developed for the catalyst-free synthesis of benzo[h]chromene derivatives by the domino Knoevenagel condensation-cyclization-Michaeladdition ofmalononitrile to salicylic aldehydes in water.
benzo[h]chromene;catalyst-free;water
1006-4184(2015)6-0031-04
2015-03-21
程益民(1972—),男,浙江东阳人,工程师,研究方向:农药合成。
谢建武E-mail:xiejw@zjnu.cn。

