甲烷的取代反应实验改进
罗 鹏
(南京市临江高级中学 江苏 南京 211102)
在实际教学工作中,笔者发现对于人教版《化学2》中甲烷与氯气的取代反应的演示实验,相当部分的教师都是“讲”实验,并没有实际动手“做”。其原因大致为:课时进度问题、氯气的污染问题等等。导致学生很难理解该反应详细过程,包括反应的进度、产物的种类等问题。因此,笔者通过简单的实验设计,比较影响该反应的主要因素,增强实验的观察效果,使得学生对该反应有更加深入的理解。
一、实验原理
无水醋酸钠与碱石灰共热,生成甲烷,用球型分液漏斗[1],排水法收集甲烷(图 1 中 A),倒置分液漏斗。换一个玻璃塞,在玻璃塞上放置少量的高锰酸钾固体,重新塞上。在分液漏斗的玻璃管中,加入少量的浓盐酸。打开活塞,浓盐酸滴入,与高锰酸钾反应,制得氯气。这样就得到甲烷和氯气的混合气体(图1中B),能最大程度地减少实验过程中氯气的污染。
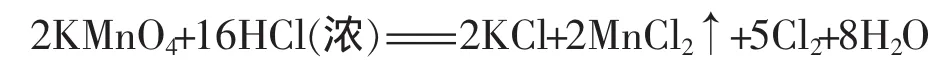
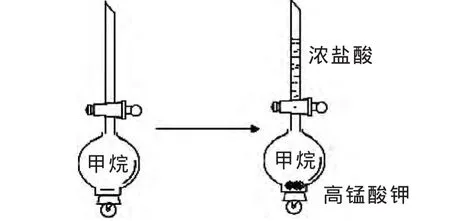
图1 甲烷和氯气反应的装置示意图
二、实验仪器与试剂:
球型分液漏斗若干只、蒸发皿、硬质试管、酒精灯;无水醋酸钠、碱石灰、高锰酸钾、浓盐酸(约12 mol/L)(所用试剂为分析纯)
三、实验步骤
1.将无水醋酸钠放在蒸发皿里加热融化,除去水分;给碱石灰加强热,冷却后分别研细密封保存备用。[1]在硬质试管里依次加入 6g无水醋酸钠,3.5g碱石灰,加热制取甲烷。(实验条件为0℃、1atm。)
2.取一个密封性好的球型分液漏斗,使用排水法,将甲烷收集在分液漏斗中。倒置备用。
3.在倒置分液漏斗的玻璃导管中,加入一定量的浓盐酸。
4.取与分液漏斗中相似的玻璃塞倒置,在上面小心的放约0.5g左右的高锰酸钾粉末。小心替换原来球型分液漏斗的玻璃塞,并拧紧。
5.缓慢的滴入浓盐酸,试管内就会产生氯气。形成甲烷和氯气的混合气体。在不同的条件下开展定量的实验。
四、结果与讨论
1.不同光源对反应的影响
取制备好的甲烷和氯气的混合气体,用不同光源进行实验。
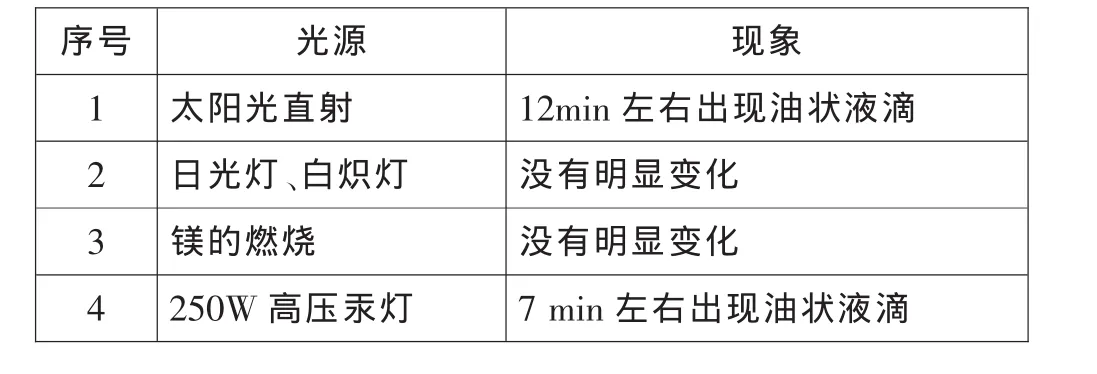
表1 不同光源催化下氯气与甲烷反应的比较
由于这是一个由光量子引发的链式反应,需要具有一定能量的光源照射才能进行。资料显示,Cl2分子的键能为 242.4kJ/mol, 若使 Cl2分子离解成氯游离基,必须给予 242.4kJ/mol的能量。波长为 400nm 的可见光,其能量为 298.9kJ/mol,能满足该反应的能量要求。太阳光中不同颜色的光是波长(频率)范围不同的电磁波,是比较理想的光源。但从课堂演示实验的时效性和安全性以及排除天气等因素的干扰,我们选择250W高压汞灯作为激发光源,做为实验的最佳条件。
2.不同量的氯气与甲烷反应
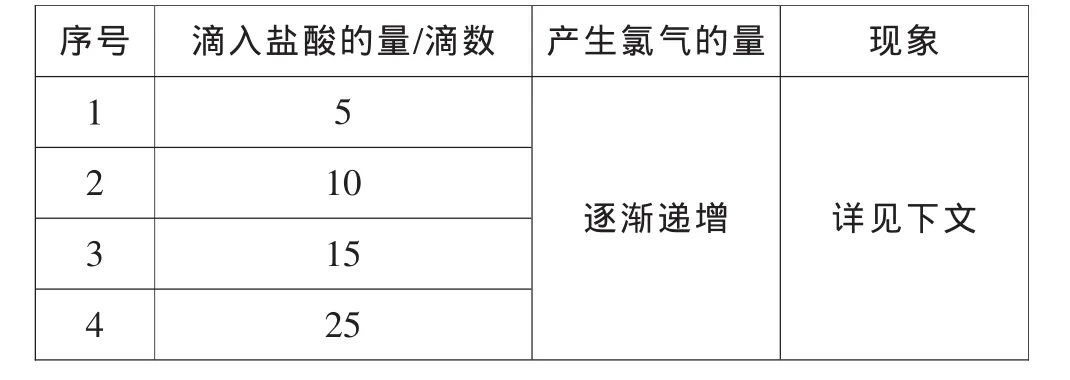
表2 氯气与甲烷反应的定量比较
现象:转动活塞,随着盐酸的滴入,试管中逐渐生成黄绿色的气体。250W高压汞灯激发下,管壁上出现油状液滴,黄绿色变浅。振荡分液漏斗,发现又有黄绿色气体生成,液面上有少量油状液体生成。再次光照后,管壁上再次出现油状液体。随着加入盐酸量增加,分液漏斗内的现象始终都类似。说明在实验条件下,产物都与反应物的量无关。验证了甲烷和氯气反应的特性。
本实验的装置简单易操作,适合学生操作,能排除氧气等对反应的干扰,定量的研究甲烷和氯气的反应。验证包括反应产物及种类、反应进度等在内的问题。使学生对该反应有更加深入的认识。
[1] 项云.分液漏斗在高中化学实验创新中的妙用[J].化学教学,2009,(10):63

