洁妇尔洗剂的质量标准研究
谭静玲,宋爱华,覃金玲,祝汪洋,丁晓萍*
(1.湖北省食品药品监督检验研究院,湖北 武汉 430064;2.马应龙药业集团股份有限公司,湖北 武汉 430064;3.湖北四环制药有限公司,湖北 武汉 430056)
·中药工业·
洁妇尔洗剂的质量标准研究
谭静玲1,宋爱华2,覃金玲2,祝汪洋3,丁晓萍1*
(1.湖北省食品药品监督检验研究院,湖北 武汉 430064;2.马应龙药业集团股份有限公司,湖北 武汉 430064;3.湖北四环制药有限公司,湖北 武汉 430056)
目的:对洁妇尔洗剂的质量标准进行研究。方法:采用薄层色谱(TLC)法对苦豆子、蛇床子、冰片进行定性鉴别,采用高效液相色谱法对苦参碱的含量进行定量测定。结果:TLC鉴别方法专属性强,HPLC含量测定方法准确,重复性好。结论:该标准可有效控制洁妇尔洗剂的质量。
洁妇尔洗剂;质量标准;苦参碱;苦豆子;蛇床子;冰片
洁妇尔洗剂属民族中药复方制剂,由民间古方开发研制而成。该处方由苦豆子、蛇床子、冰片、花椒、没食子等6味中药组成,具有清热解毒、止痒、抗菌消炎之功能[1]。临床广泛应用于各种细菌性、霉菌性、滴虫性外阴炎、阴道炎所致妇女阴部红肿、瘙痒和白带过多等症状。洁妇尔洗剂原标准收载于卫生部药品标准分册,为了更有效地控制本品质量,根据处方药味、相关文献[2-5]及试验研究结果,笔者在原标准的基础上进一步完善其质量标准,即采用薄层色谱(TLC)法对苦豆子、蛇床子、冰片进行鉴别;采用高效液相色谱法对君药苦豆子中的有效成分苦参碱进行含量测定。
1 仪器与试药
1.1 仪器
岛津10 AT-VP型高效液相色谱;岛津SPD-10 AVP紫外检测器;AT-930柱温箱(上海民仪电子有限公司);紫外分光光度仪UV 1101 (上海天美科学仪器有限公司);KQ-100 DE型数控超声波清洗器(100 W,40 KHz,昆山市超声仪器有限公司);SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂);MS204S/Z、AG135电子天平(梅特勒-托利多仪器上海有限公司)。
1.2 试药
苦参碱对照品、槐定碱对照品、冰片对照品、蛇床子对照药材(中国食品药品检定研究院,批号分别为110805-200507,110784-200303,110743-200303,121030-200405);洁妇尔洗剂(自制,批号分别为20100801~20100803,20101201~20101204,20110101~20110103);甲醇、乙腈为色谱纯;水为二次重蒸水;其他试剂均为分析纯。
2 鉴别
2.1 苦豆子的薄层色谱鉴别
取本品5 mL,分别加氨试液3 mL、水15 mL,后加三氯甲烷振摇提取3次,每次15 mL,分取三氯甲烷层,合并,回收溶剂至干,残渣加乙醇1 mL,使其溶解,作为供试品溶液。另取槐定碱对照品,加乙醇制成质量浓度为1 mg·mL-1的溶液,作为对照品溶液。按处方比例,制备缺苦豆子的阴性样品,同法制成阴性供试品溶液。照薄层色谱法(《中华人民共和国药典》2010版一部附录Ⅵ B)试验,吸取上述3种溶液各2 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-氨水(5∶0.6∶0.2)为展开剂,展开,取出,晾干,喷以稀碘化铋钾试液。供试品色谱中,在与对照品色谱相应的位置上显相同的橙色斑点,阴性供试品无干扰。见图1。
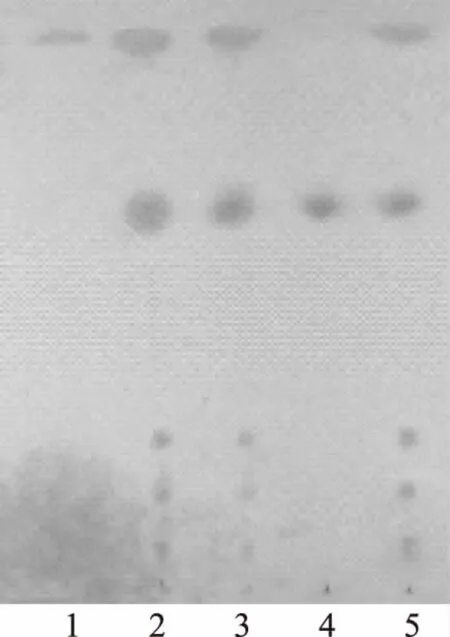
注:1.苦豆子阴性供试品;2.供试品(批号:20100801);3.供试品(批号:20100802);4.槐定碱对照品;5.供试品(批号:20100803)。图1 洁妇尔洗剂中苦豆子的TLC鉴别图
2.2 蛇床子的薄层鉴别
取本品20 mL,加乙醚振摇提取2次,每次40 mL,分取乙醚液,合并,挥干,残渣加无水乙醇1 mL,使其溶解,作为供试品溶液。另取蛇床子对照药材1 g,加水20 mL,超声提取1 h,过滤,取滤液,加乙醚振摇提取,同法制成对照药材溶液。按处方比例,制备缺蛇床子的阴性样品,同法制成阴性供试品溶液。照薄层色谱法(《中华人民共和国药典》2010版一部附录Ⅵ B)试验,吸取上述3种溶液各15 μL,分别点于同一硅胶G薄层板上,以石油醚(30~60 ℃)-乙酸乙酯-甲酸(15∶5∶2)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性供试品无干扰。见图2。
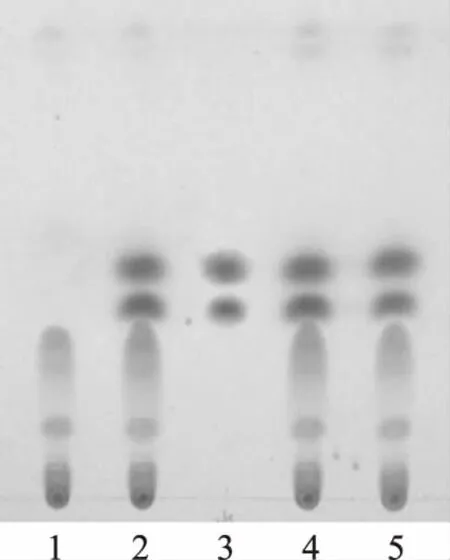
注:1.蛇床子阴性供试品;2.供试品(批号:20100801);3.蛇床子对照药材;4.供试品(批号:20100802);5.供试品(批号:20100803)。图2 洁妇尔洗剂中蛇床子的TLC鉴别图
2.3 冰片的薄层鉴别
取2.2项下的供试品溶液,另取冰片对照品,加乙酸乙酯制成质量浓度为0.5 mg·mL-1的溶液,作为对照品溶液。按处方比例,制备缺冰片的阴性样品,同法制成阴性供试品溶液。照薄层色谱法(《中华人民共和国药典》2010版一部附录Ⅵ B)试验,吸取上述3种溶液各5 μL,分别点于同一硅胶G薄层板上,以环己烷-乙酸乙酯(17∶3)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,阴性供试品无干扰。见图3。
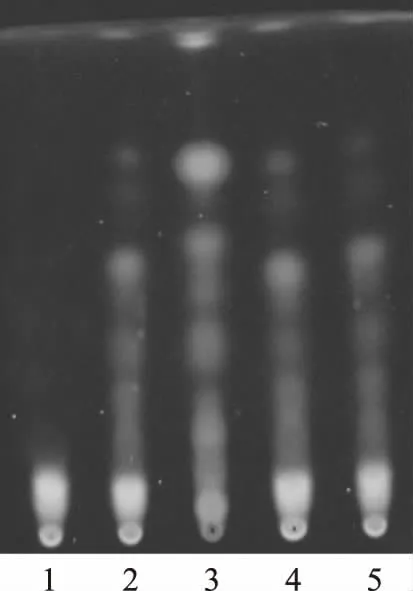
注:1.冰片阴性供试品;2.供试品(批号:20100801);3.冰片对照品;4.供试品(批号:20100802);5.供试品(批号:20100803)。图3 洁妇尔洗剂中冰片的TLC鉴别图
3 含量测定
3.1 色谱条件与系统适用性试验
色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-磷酸盐缓冲液(取0.2 moL·L-1磷酸二氢钾溶液250 mL,加0.2 moL·L-1氢氧化钠溶液118 mL,加水稀释至1000 mL,再加入三乙胺0.5 mL)(11∶89);流速:1.0 mL·min-1;检测波长:220 nm。理论板数按苦参碱色谱峰计,不得低于4000。
3.2 对照品溶液的制备
精密称取苦参碱对照品适量,加流动相制成质量浓度为0.15 mg·mL-1的溶液,即得。
3.3 供试品溶液的制备
精密量取本品5 mL,置分液漏斗中,加氨水2 mL,用三氯甲烷(20、20、15、15、10 mL)振摇提取5次,合并三氯甲烷层,回收溶剂至干,残渣用甲醇溶解,转移至10 mL容量瓶中,定容,摇匀,精密量取5 mL置25 mL容量瓶中,用流动相稀释至刻度,摇匀,即得。
3.4 阴性供试品溶液的制备
取按处方比例及工艺制备的缺苦豆子阴性对照样品,按3.3项下方法制成阴性供试品溶液。
3.5 专属性试验
精密吸取对照品溶液、供试品溶液和阴性供试品溶液各10 μL,分别注入液相色谱仪,依法测定,阴性供试品溶液在与苦参碱对照品色谱峰相应保留时间处无吸收峰。结果表明,其他组分对测定无干扰。见图4。
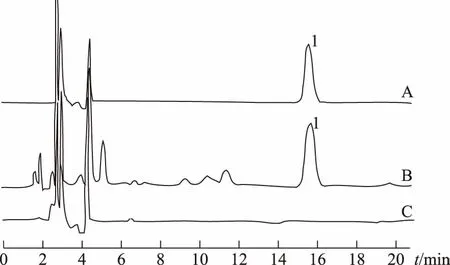
注:A.对照品;B.洁妇尔洗剂供试品;C.阴性供试品;1.苦参碱。图4 苦参的HPLC图谱
3.6 线性关系的考察
精密称取苦参碱对照品32.55 mg,置25 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为苦参碱对照品储备液。精密量取对照品储备液1、2、4、6、8 mL,分别置100 mL量瓶中,加甲醇稀释至刻度,摇匀。精密吸取上述对照品溶液及对照品储备液各10 μL,分别注入高效色谱仪,按3.1项下色谱条件进行测定,记录色谱图,以苦参碱对照品溶液浓度为横坐标X,峰面积为纵坐标Y,绘制标准曲线,计算,得回归方程:Y=14 679 485.52X+150 357.06,r=0.999 5。结果表明,苦参碱质量浓度在0.013~1.30 mg·mL-1具有良好的线性关系。
3.7 精密度试验
取3.2项下的苦参碱对照品溶液10 μL,按上述色谱条件测定,连续进样6次,测定苦参碱峰面积,计算RSD为1.5%,表明仪器精密度良好。
3.8 稳定性试验
取同一份洁妇尔洗剂(批号:20100801)供试品溶液,分别在制备后第0、1、2、4、8、24 h进样,测定苦参碱峰面积并计算RSD。结果,供试品溶液中苦参碱峰面积的RSD为1.2%,表明供试品溶液在制备后24 h内稳定。
3.9 重复性试验
取同批洁妇尔洗剂(批号:20100801),按3.3项下方法平行制备6份供试品溶液,在上述色谱条件下测定苦参碱峰面积,经计算,洁妇尔洗剂中苦参碱的平均质量浓度为1.49 mg·mL-1,RSD为1.1%,表明该方法的重复性良好。
3.10 中间精密度试验
取同批洁妇尔洗剂(批号:20100801),由不同分析人员,于不同时间按3.3项下方法平行制备6份供试品溶液,在同一仪器上测定,计算得洁妇尔洗剂中苦参碱的平均质量浓度为1.48 mg·mL-1,RSD为1.2%,经与重复性试验结果比较,α=0.88%。
3.11 加样回收试验
精密量取已知含量的洁妇尔洗剂(批号:20100801)2 mL,分别加入苦参碱对照品溶液(1.514 mg·mL-1,溶媒为三氯甲烷)2 mL,加水1 mL,加氨水2 mL,其余按3.3项下方法制备样品溶液,平行6份,测定苦参碱含量。计算平均回收率为97.1%,RSD为1.7%。结果见表1。
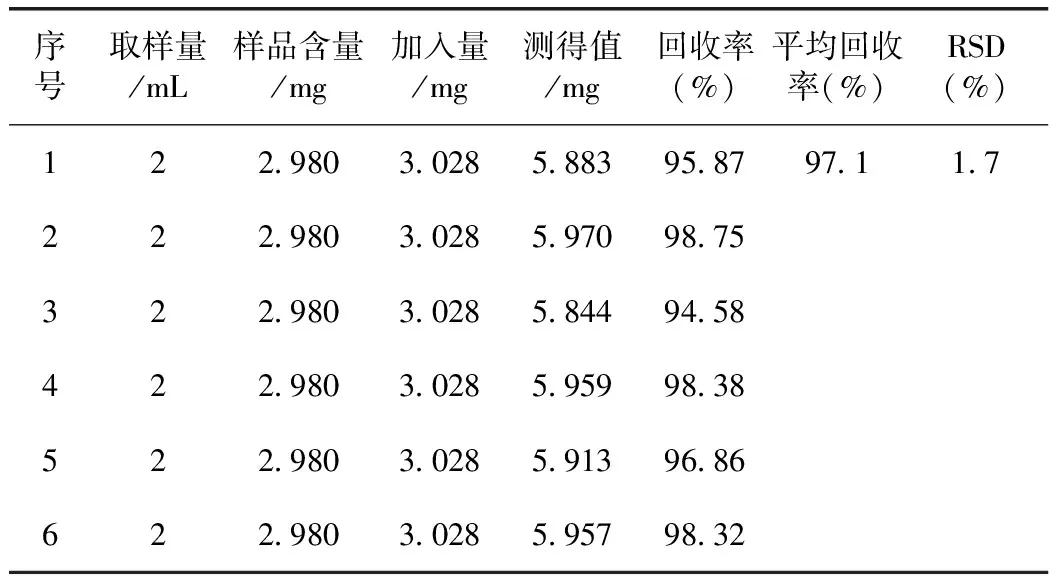
表1 加样回收试验结果(n=6)
3.12 样品测定
按上述色谱条件对10批样品进行含量测定,测定结果见表2。
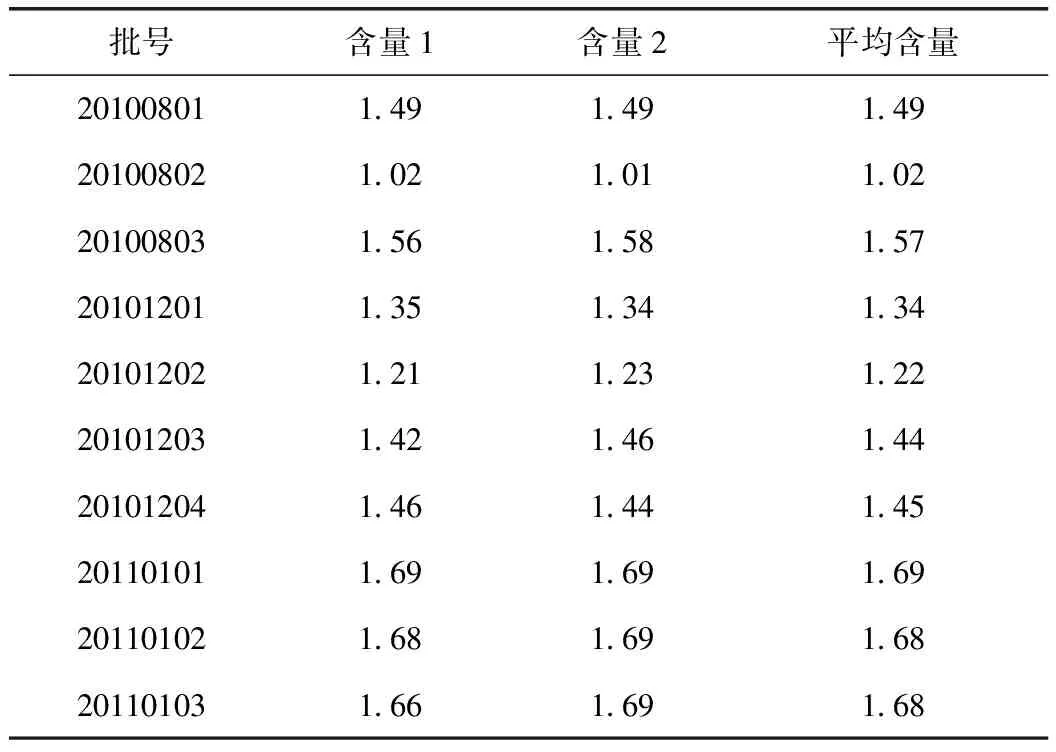
表2 洁妇尔洗剂中苦参碱含量测定结果(mg·mL-1,n=2)
由表2可知,10批样品中苦参碱的平均含量为1.46 mg·mL-1,按平均含量的80%折算成含量限度,暂定洁妇尔洗剂每mL含苦豆子以苦参碱(C15H24N2O)计,不得少于1.2 mg。待收集到更多来源的药材和更多批次的样品后,再结合制剂生产、贮藏等因素对限度值进行更深入的研究。
4 讨论
4.1苦豆子主要有效成分为生物碱类,在以槐定碱为对照品进行鉴别过程中,对参考文献[6]的展开剂系统进行了筛选优化,改善了原鉴别条件下的分离度低和易拖尾现象,最终以三氯甲烷-甲醇-氨水(5∶0.6∶0.2)为展开剂,结果表明,薄层色谱斑点清晰,分离度良好。
蛇床子的TLC鉴别试验中,分别比较了乙醚直接提取、加氨水后以乙酸乙酯萃取和加氨水后以三氯甲烷萃取3种不同的提取方法,以及石油醚(30~60 ℃)-乙酸乙酯-甲酸(15∶5∶2)、甲苯-乙酸乙酯-正已烷(3∶3∶2)、甲苯-乙酸乙酯(30∶1)等不同的展开系统。结果表明,采用乙醚直接提取,以石油醚(30~60 ℃)-乙酸乙酯-甲酸(15∶5∶2)为展开剂分离效果最佳,且阴性供试品无干扰。
冰片的薄层鉴别试验中,分别选用三氯甲烷、乙酸乙酯、乙醚3种不同的提取溶媒,采用甲苯-丙酮(9∶1)、甲苯-乙酸乙酯(19∶1)、环已烷-乙酸乙酯(17∶3)等不同的展开剂分别进行展开,并以5%香草醛硫酸溶液进行显色。试验结果表明,以乙醚萃取,环已烷-乙酸乙酯(17∶3)为展开剂时斑点清晰,耐用性好,且阴性供试品无干扰。
本研究亦对组方中其他药味如花椒的薄层色谱进行研究,但在多次尝试后,无法取得满意效果(薄层图色带较重,无特征斑点,且阴性供试品有干扰),因此未进行鉴别。
4.2本标准制定过程中,考虑已对苦豆子中的槐定碱进行薄层色谱鉴别,故选择其含量较高的特征性活性成分[7-8]苦参碱作为指标成分进行HPLC的含量测定。参考了相关文献[9-10]对色谱条件进行优化1)检测波长的选择:采用紫外分分光光度法对苦参碱对照品的甲醇溶液进行全波长扫描,根据光谱图,选择220 nm作为测定波长;2)流动相优化:先后以乙腈-0.1%磷酸(20∶80)、乙腈-0.1%磷酸(10∶90)、甲醇-0.04%三乙胺溶液(61∶39)、乙腈-磷酸盐缓冲液(取0.2 moL·L-1磷酸二氢钾溶液250 mL,加0.2 moL·L-1氢氧化钠溶液118 mL,加水稀释至1000 mL,再加入0.5 mL三乙胺)(11∶89)、乙腈-甲醇-磷酸盐缓冲液(16∶7∶77)等分别进行试验。结果表明,以乙腈-磷酸盐缓冲液(11∶89)进行试验,结果最为理想。对色谱条件进行耐用性考察,如色谱柱、流动相比例、流速等,结果表明,该色谱条件下耐用性良好;3)含量测定中供试品溶液的制备方法考察:分别对氨水用量(1、2、3、4 mL)及三氯甲烷萃取次数(1、2、3、4、5、6次,依次以20、20、15、15、10、10 mL)进行考察,结果表明,氨水用量2 mL,萃取5次时苦参碱提取较完全,且含量测定结果稳定。
[1] 王伟萍,曹艳玲,刘砥威.阿娜尔妇洁液体外抑菌试验及杀菌曲线测定[J].新疆中医药,2006,24(1):42-44.
[2] 杨巧丽,顾政一,黄华.中药苦豆子的研究进展[J].西北药学杂志,2011,26(3):232-234.
[3] 张琳娜,白洁.苦豆子药理作用的研究进展[J].宁夏医学院学报,2004,26(3):214-216.
[4] 陈艳,张国刚,余仲平.蛇床子的化学成分及药理作用的研究进展[J].沈阳药科大学学报,2006,23(4):256-259.
[5] 吴寿荣,程刚,冯岩.冰片药理作用的研究进展[J].中草药,2001,32(12):1143-1145.
[6] 黄韶光,韩友林,罗志刚.阿娜尔妇洁液的质量研究[J].农垦医学,2002,24(3):213-215.
[7] 张为民,张彦明,张涛,等.苦豆子生物碱抑菌抗炎作用研究[J].动物医学进展,2005,10(26):82-85.
[8] 郑立卿,张力,董晓华.蛇床子素药理作用研究进展[J].神经药理学报,2013,3(6):29-35.
[9] 韩刚,翟丽,王炳强.高效液相色谱法测定不同产地苦参中生物碱的含量[J].华北煤炭医学院学报,2005,7(2):140-141.
[10] 史银基,刘砥威,石雪,等.HPLC测定阿娜尔妇洁液中苦参碱的含量[J].中国实验方剂学杂志,2012,18(14):119-121.
StudyonQualityStandardofJiefuerLotion
TANJingling1,SONGAihua2,QINJinling2,ZHUWangyang3,DINGXiaoping1*
(1.HubeiInstituteforFoodandDrugControl,HubeiWuhan430064,China;2.WuhanMayinglongPharmaceuticalGroupStockCo.,Ltd,HubeiWuhan430064,China;3.HubeiSihuanPharmaceuticalCo.,Ltd,HubeiWuhan430056,China)
Objective:To study the quality standard for Jiefuer lotion.Methods:Sophoraalopecuroides,Cnidiummonnieriand borneol was qualitative identified by TLC.Quantitative determination of matrine performed by HPLC.Results:The method of identification by TLC was highly specific,the established HPLC method was accurate and repetitive.Conclusion:The proposed standards can effectively control the quality of Jiefuer lotion.
JJiefuer Lotion;quality standard;matrine;Sophoraalopecuroides;Cnidiummonnieri;borneol
2015-03-01)
*
丁晓萍,副 主任药师,研究方向:中成药质量控制研究;Tel:(027)87272513,E-amil:dxp2888@126.com
10.13313/j.issn.1673-4890.2015.10.021

