熟三七配方颗粒的质量分析研究
曾恕芬,陈金东*,任杨帆,陈荣洁
(1.云南维和药业股份有限公司,云南 玉溪 653100;2.云南省植物提取物工程研究中心,云南 玉溪 653100)
·中药工业·
熟三七配方颗粒的质量分析研究
曾恕芬1,2,陈金东1,2*,任杨帆1,2,陈荣洁1,2
(1.云南维和药业股份有限公司,云南 玉溪 653100;2.云南省植物提取物工程研究中心,云南 玉溪 653100)
目的:进行熟三七配方颗粒的质量标准研究,建立质量评价方法,为科学评价其质量提供依据。方法:采用薄层色谱法(TLC)对熟三七配方颗粒中人参皂苷Rh1、Rg3进行鉴别,采用高效液相色谱法(HPLC)对其三七皂苷R1,人参皂苷Rg1、Re、Rb1、Rd进行含量检测分析。结果:建立了熟三七配方颗粒中人参皂苷Rh1、Rg3的薄层鉴别方法;建立了检测熟三七配方颗粒中三七皂苷R1,人参皂苷Rg1、Re、Rb1、Rd的含量测定方法。结论:该方法简单、准确、专属性好,能有效对熟三七配方颗粒的质量进行评价。
熟三七配方颗粒;高效液相色谱;薄层色谱法
三七为五加科植物三七Panaxnotoginseng(Burk.)F.H.Chen的干燥根和根茎,具有散瘀止血、消肿定痛的作用。临床上多用于治疗咯血、吐血、便血、崩漏、外伤出血、胸腹刺痛、跌打肿痛[1]。三七中的主要成分是达玛烷型四环三萜类皂苷,主要有三七皂苷R1、人参皂苷Rg1、Re、Rb1、Rd[1-2]。三七经蒸制后变成熟三七,有部分原生皂苷成分将转化成人参皂苷20(R)-Rh1、20(S)-Rh1、20(R)-Rg3、20(S)-Rg3、Rh4、Rk3、Rg5、Rk1[3-4]。试验研究表明,转化后形成的次生皂苷中人参皂苷Rh1、Rg3的化学性质比较稳定。本文采用高效液相色谱法与薄层色谱鉴别方法相结合的方式,对熟三七配方颗粒的质量进行分析研究,为中药配方颗粒的质量评价提供参考。
本文中使用的三七原料采购于文山中药材市场,经中国科学院昆明植物研究所杨崇仁研究员鉴定为五加科植物三七Panaxnotoginseng(Burk.)F.H.Chen 的干燥根。经检验各指标成分符合《中华人民共和国药典》2010版一部中中药材三七的质量标准。本文中使用同一批号的三七,经炮制加工,制备成不同批次的熟三七饮片,经检验熟三七饮片符合国家标准WS-11219(ZD-1219)-2002-2012Z的规定。再用不同批次熟三七饮片制备成不同批次的熟三七配方颗粒。
1 仪器与试药
1.1 仪器
高效液相色谱仪(Agilent1200型);MILLIPORE超纯水器(美国密理博公司);美国丹佛双量程电子天平(TB-215D);天津恒奥超声波清洗器(HU10260 B);硅胶板(山东青岛海洋化工)。
1.2 试药
熟三七配方颗粒(自制,批号分别为20131105,20131109,20131111,20131010,20131021,20131030,20131204,20131216,20131229,20140110);10%的硫酸乙醇溶液、乙酸乙酯、三氯甲烷、甲醇、乙腈(德国默克公司);水为超纯水;乙腈为色谱纯;其余试剂均为分析纯;人参皂苷Rg1、Rb1、Re、Rd、三七皂苷R1(中国食品药品检定研究院,批号分别为110745-200312,110703-200322,110703-200322,110704-200319,110704-200319)。
2 方法
2.1 薄层色谱法
试验前,首先通过对样品不同提取方法、纯化方法、展开系统、展开剂、硅胶G板、点样量、温湿度、平衡时间、重复性试验等进行系统考察,最终建立以下鉴别试验方法。
2.1.1 供试品溶液的制备 取本品2.5 g,加水50 mL,超声处理10 min,使之充分溶解,加入50 mL乙酸乙酯溶液进行萃取,取乙酸乙酯层浓缩至干,残渣加入1~2 mL甲醇溶解,作为供试品溶液备用。
2.1.2 对照品溶液的制备 分别称取适量人参皂苷Rh1、Rg3,加甲醇配制成质量浓度为1 mg·mL-1的混合对照溶液备用。
2.1.3 鉴别方法 分别取对照品溶液和供试品溶液各5~10 μL,点于同一硅胶G板上,用不加入熟三七提取物的空白颗粒作为阴性对照,以三氯甲烷-甲醇-水(8∶2∶0.2)为展开剂展开,展距为7~8 cm,取出晾干,喷以10%的硫酸乙醇溶液,于105 ℃下烘至斑点显色清楚即可,薄层色谱图见图1。
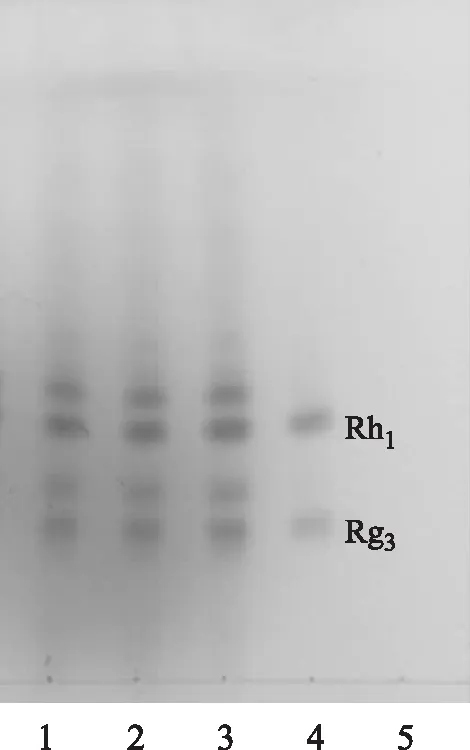
注:1.供试品20131105;2.供试品20131109;3.供试品20131111;4.人参皂苷Rh1、Rg3;5.阴性对照。图1 三批熟三七配方颗粒的TLC图
2.2 高效液相色谱法
2.2.1 色谱条件 色谱柱:Agilent SB C18柱(250 mm× 4.6 mm,5 μm);检测波长:203 nm;流速:1.0 mL·min-1;柱温:25 ℃;进样体积5~10 μL,以乙腈-水为流动相梯度洗脱,见表1。
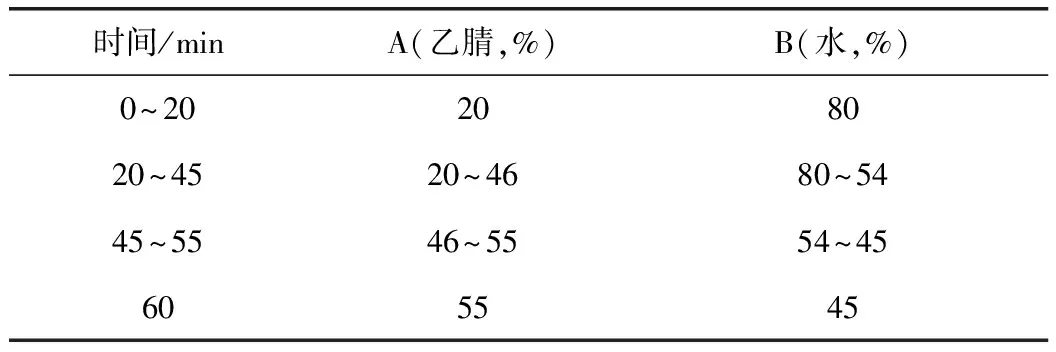
表1 流动相洗脱条件
2.2.2 对照品溶液的制备 精密称取三七皂苷R1,人参皂苷Re、Rd对照品适量,加甲醇制成每1 mL含三七皂苷R10.2 mg、人参皂苷Re 0.2 mg、人参皂苷Rd 0.2 mg的混合溶液,用0.45 μm的微孔滤膜过滤,即得;精密称取人参皂苷Rg1、Rb1对照品适量,加甲醇制成每1 mL含人参皂苷Rg10.5 mg、人参皂苷Rb10.5 mg的混合溶液,用0.45 μm的微孔滤膜过滤,即得。
2.2.3 供试品溶液的制备 取本品1.25 g,置25 mL量瓶中,加水溶液适量,超声处理10 min,使之全部溶解,用水定容至刻度线,摇匀,过滤,取续滤液用0.45 μm微孔滤膜过滤,即得。
2.2.4 线性关系考察 分别精密吸取上述对照品溶液1.0,2.0,4.0,8.0,10.0,15.0,20.0 μL,按2.2.1色谱条件测定峰面积,以进样量(μg)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,计算回归方程。见表2。结果表明,本法线性关系良好,符合含量测定要求。
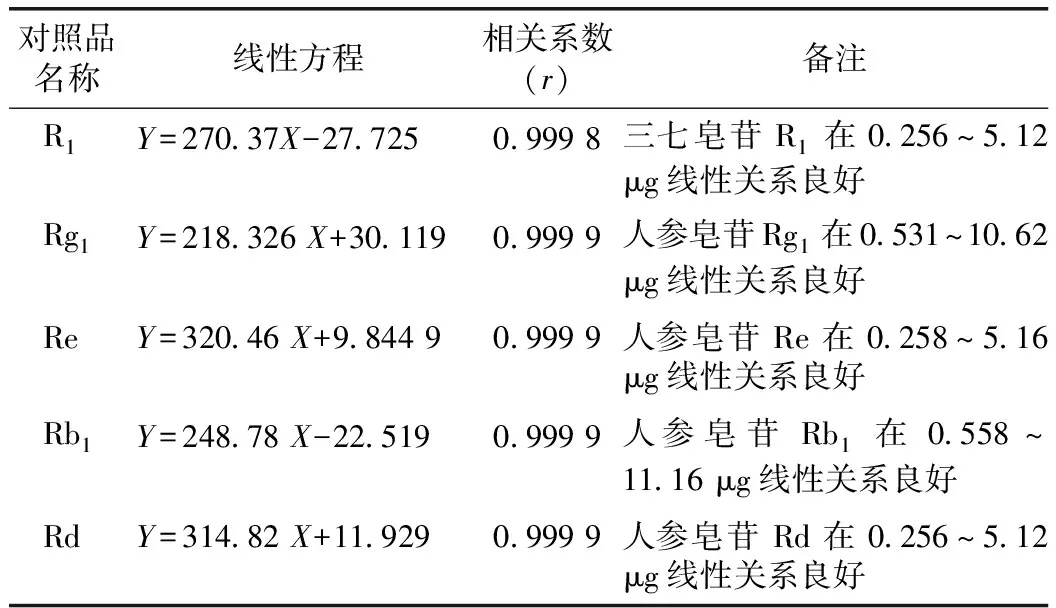
表2 线性测定结果
2.2.5 精密度试验 精密吸取2.2.2中混合对照品溶液10 μL,重复进样6次,记录色谱图与峰面积,测定结果显示,RSD值都小于2%(n=6),表明本法精密度良好,符合含量测定要求。见表3。
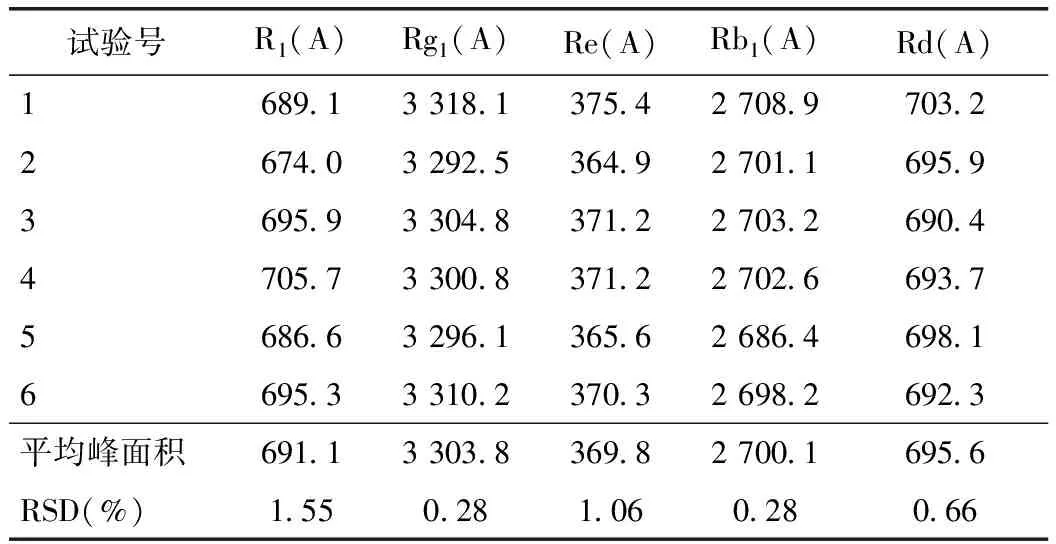
表3 精密度试验结果
2.2.6 重复性试验 分别精密称取6份样品(批号:20131109),按2.2.3项下操作,依法测定,结果三七总皂苷含量以干燥品计为6.73%,测定结果显示RSD值都小于2%,表明本法重复性良好。见表4。
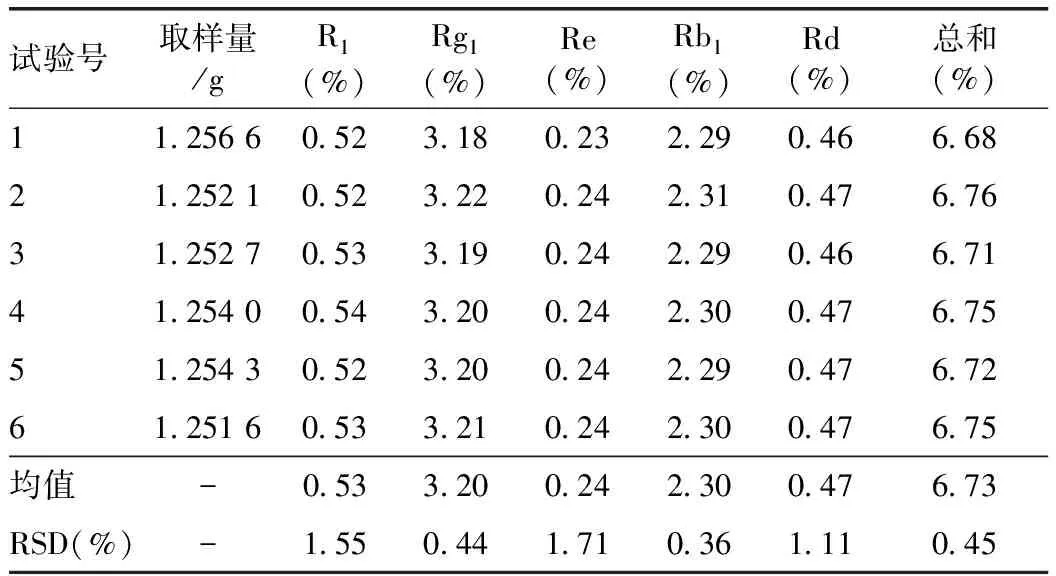
表4 重复性试验结果(n=6)
2.2.7 稳定性试验 取同一供试品溶液,分别在0、4、8、12、24、36 h 各进样10 μL,以5个指标成分的峰面积计算RSD值。计算结果显示,RSD值均小于2.0%,表明供试品溶液在36 h内稳定。见表5。
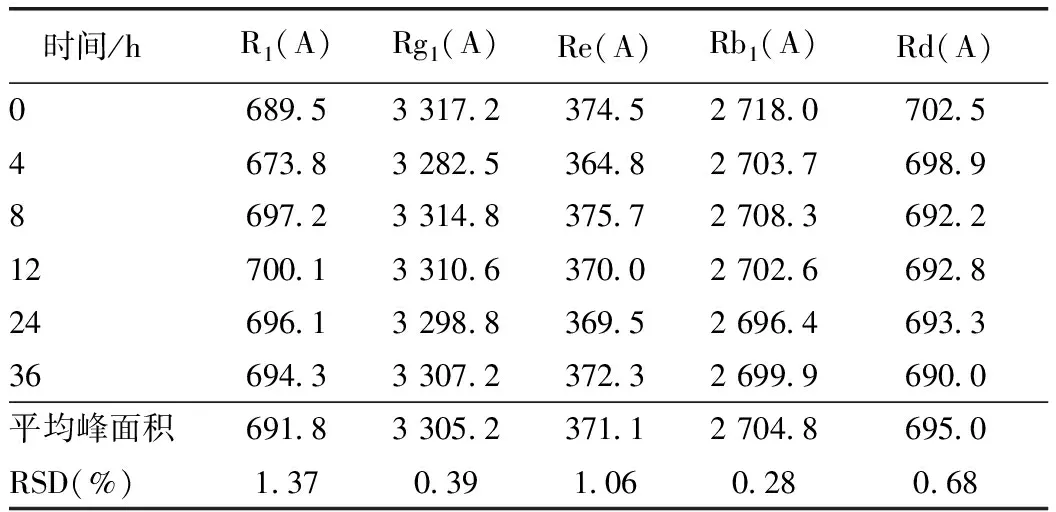
表5 稳定性试验结果(n=6)
2.2.8 准确度试验 取同一批供试品(批号:20131111,含三七皂苷R10.49%、人参皂苷Rg13.04%、人参皂苷Re 0.23%、人参皂苷Rb12.20%、人参皂苷Rd 0.44%)适量,各6份,精密称定,分别置25 mL容量瓶中,分别加入干燥至恒重的三七皂苷R1约3 mg、人参皂苷Rg1约19 mg、Re约1.4 mg、Rb1约13.8 mg、Rd约2.8 mg,依含量测定项下方法处理,测定计算回收率。结果见表6。
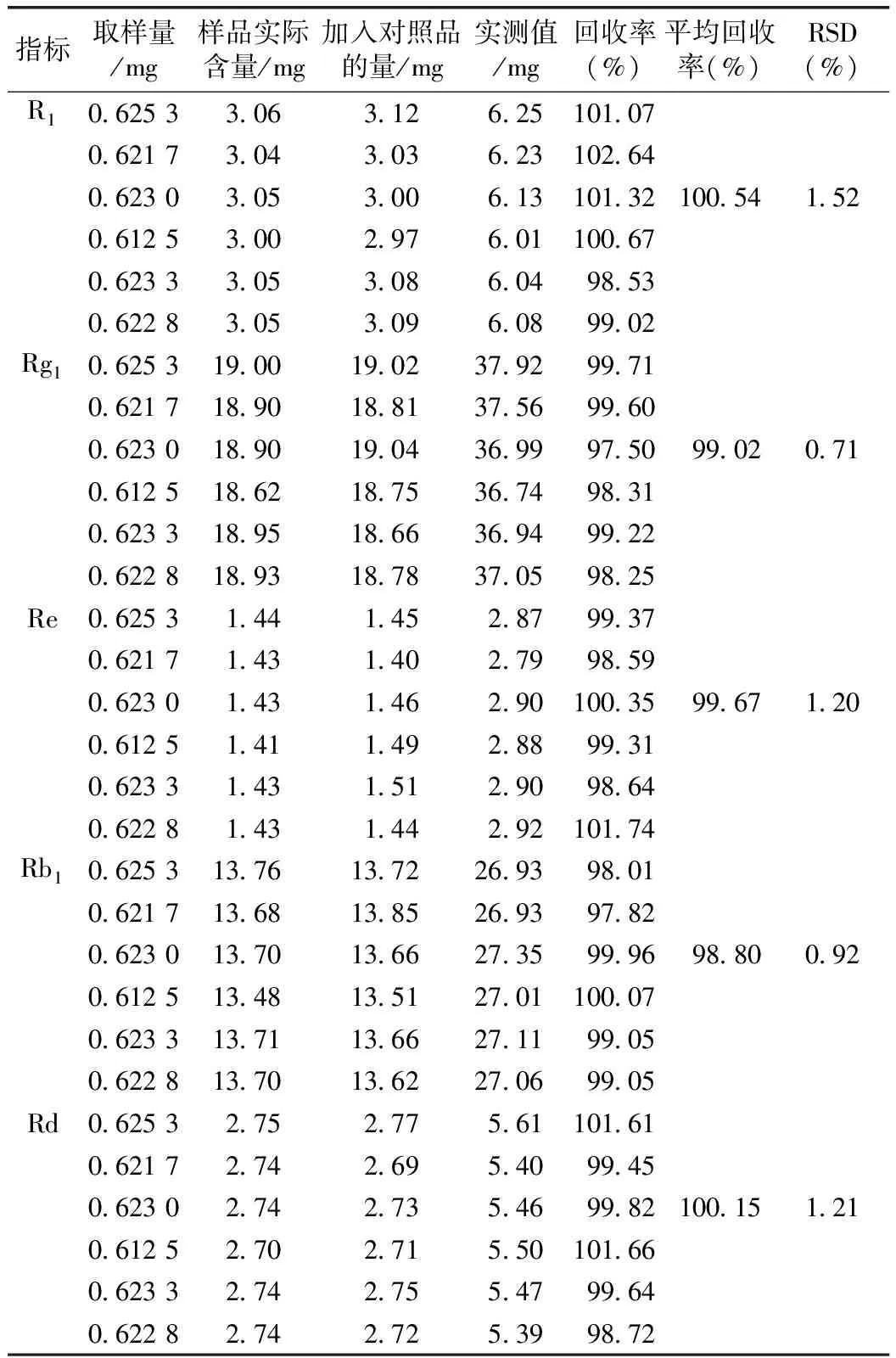
表6 准确度试验(n=6)
2.2.9 样品含量测定 取10批样品,按拟定的含量测定方法操作。结果表明,本法稳定、可行,能对产品质量进行评价。测定结果见表7,熟三七配方颗粒及对照品的HPLC图见图2。
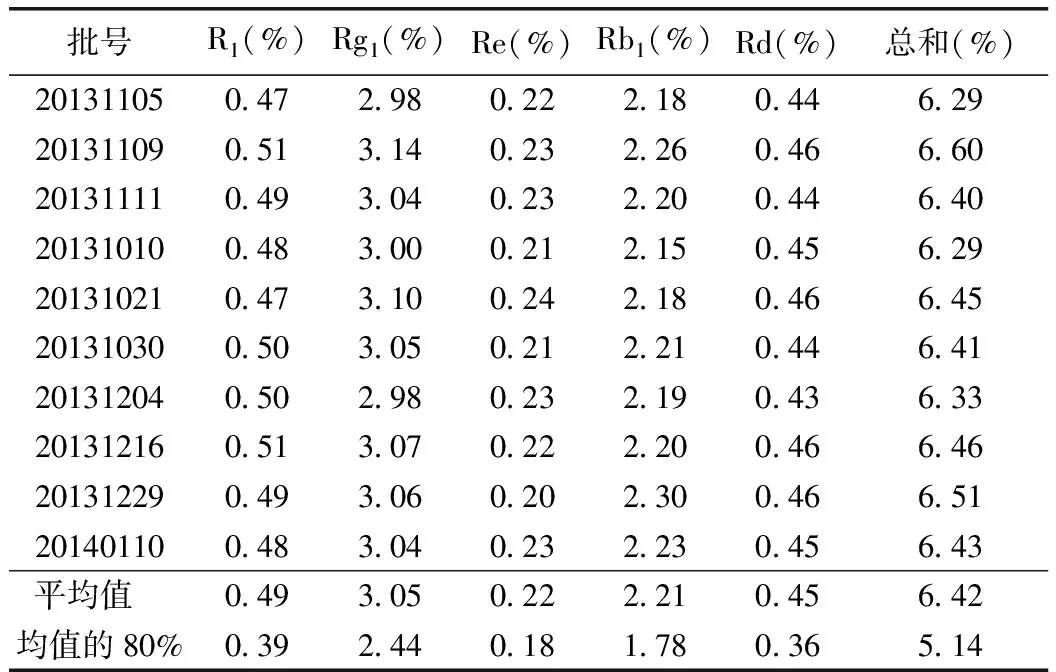
表7 含量测定结果(n=10)
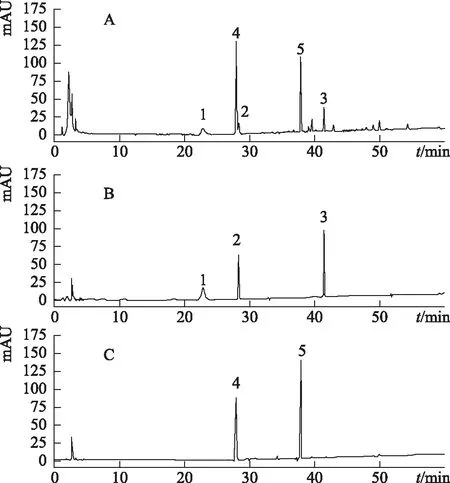
注:A.熟三七配方颗粒;B.对照品;C.对照品;1.三七皂苷R1;2.人参皂苷Re;3.人参皂苷Rb1;4.人参皂苷Rg1;5.人参皂苷Rb1。图2 熟三七配方颗粒及对照品HPLC图
由表7可知,本品10批样品含量稳定,含量限度按测定结果平均值的80%计算。本品按干燥品计算,含人参皂苷Rg1(C42H72O14)不得少于2.50%、人参皂苷Rb1(C54H92O23)不得少于1.70%、三七皂苷R1(C47H80O18)不得少于0.40%、人参皂苷Re(C48H82O18)不得少于0.15%、人参皂苷Rd(C48H82O18)不得少于0.30%,且人参皂苷Rb1(C54H92O23)、人参皂苷Rg1(C42H72O14)、三七皂苷R1(C47H80O18)、人参皂苷Re(C48H82O18)、人参皂苷Rd(C48H82O18)的总量不得低于5.00%。
3 讨论
3.1中药配方颗粒突破了传统中药饮片需要煎煮的服用模式,具有免煎易服、易储存、携带方便等优点[5-6]。但中药配方颗粒已不具备中药饮片的外形、性状及显微鉴别,因此,建立切实可行的中药配方颗粒质量分析标准是保证产品质量的关键环节。
3.2本文所述熟三七配方颗粒为由符合炮制规范的熟三七饮片经提取、浓缩、干燥、制粒等工序制成的新型饮片。云南省地方标准YPBZ-0193-2013、国家标准WS-11219(ZD-1219)-2002-2012Z分别收载有熟三七粉(蒸制)、熟三七散质量标准,两份标准中都有其功能性成分三七皂苷R1、人参皂苷Rg1、人参皂苷Rb13个成分的总量不得低于4.5%的限定。目前,熟三七配方颗粒并无相关法定标准。本研究对熟三七配方颗粒的质量标准研究具有一定的参考价值。
3.3三七经蒸制后,部分原生皂苷成分将会转化成次生皂苷[4]。云南省地方标准YPBZ-0193-2013、国家标准WS-11219(ZD-1219)-2002-2012Z质量标准项下并未对降解皂苷进行定性或定量分析,本文引入薄层色谱法对人参皂苷Rh1和Rg3进行鉴别,方法准确简便,可有效控制制剂质量,弥补上述标准之不足。
3.4由方法学考察结果可见,本方法线性关系良好,重复性良好。回收率结果表明,此方法可靠性良好,稳定性满足测定时间的要求。该方法简单、准确、专属性好,能有效对熟三七配方颗粒的质量进行评价。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010.
[2] 杨崇仁,崔占和,周俊,等.生三七和熟三七皂苷成分的分离和鉴定[J].中药通报,1985,10(9):417-418.
[3] 余河水,张丽娟,宋新波,等.三七炮制品化学成分研究[J].中国中药杂志,2013,38(22):3910-3917.
[4] Liao P Y,Wang D,Zhang Y J,et al.Dammarane-type glycosides from the steamed notoginseng[J].Journal of Agricultural & Food Chemistry,2008,56(5):1751-1756.
[5] 张建眷,王少臣,胡浩,等.中药颗粒剂研究概况[J].中国现代医学与临床,2005,3(2):30-31.
[6] 李松林,宋景政,徐宏喜.中药配方颗粒研究浅析[J].中草药,2009,40(增刊):1-7.
StudyonQualityStandardofSteamedNotoginsengFormulaGranules
ZENGShufen1,2,CHENJindong1,2*,RENYangfan1,2,CHENRongjie1,2
Objective:To establish the quality standard for steamed Notoginseng formula granules,and provide a basis for scientific evaluation of its quality.Methods:Ginsenosides Rh1and ginsenoside Rg3in steamed Notoginseng formula granules were identified by TLC,and the contents of notoginsenoside R1,ginsenosides Rg1,Re,Rb1,Rd in steamed Notoginseng formula granules were determined by HPLC.Results:To established a method to identify Panax ginseng saponin Rh1and ginsenoside Rg3in Steamed Notoginseng Formula Granules by TLC;to establish a method to detect the content of Panax notoginsenoside R1,ginsenosides Rg1,Re,Rb1,Rd in Steamed Formula Notoginseng Granules.Conclusion:The established method is simple,accurate,reproducible,and it can be used as a quality control method for steamed Notoginseng formula granules.
Steamed Notoginseng formula granules;HPLC;TLC
(1.YunnanWeihePharmaceuticalsco.,Ltd,YuxiYunnan,653100,China;2.YunnanEngineeringResearchCenterofPlantExtracts,YuxiYunnan,653100,China)
2014-07-02)
*
陈金东,工程师,研究方向:天然药物分析研究;Tel:(0877)2666733-2101,E-mail:chenjindong_2005@163.com
10.13313/j.issn.1673-4890.2015.7.018

