成人表皮干细胞和汗腺细胞的体外分离和培养
陈甫寰,宋慧锋,岳晓彤,刘玲英,王统民,何秀叶
(解放军总医院第一附属医院烧伤整形五病区北京100048)
·基础研究·
成人表皮干细胞和汗腺细胞的体外分离和培养
陈甫寰,宋慧锋,岳晓彤,刘玲英,王统民,何秀叶
(解放军总医院第一附属医院烧伤整形五病区北京100048)
背景:人表皮干细胞和汗腺细胞的分离培养及鉴定,为探讨人表皮干细胞再生汗腺的可行性打下基础。目的:探讨体外分离培养人表皮干细胞及汗腺细胞的有效方法。方法:采集不同年龄段的泌尿外科患者术后包皮组织,充分清洗消毒后去除皮下组织,将其修剪成0.5cm×0.5cm的皮片,用Ⅳ型胶原纯化、富集成人表皮干细胞,倒置相差显微镜观察细胞形态:使用免疫荧光染色对成人表皮干细胞表型进行分析;CCK-8检测细胞的增殖曲线;采用胶原酶消化法从人全层无损伤皮肤中分离提取汗腺细胞,并进行扩增和鉴定。结果:倒置相差显微镜下见分离培养的成人表皮干细胞呈卵圆形、细胞之间紧密相连,呈铺路石状,免疫荧光染色显示细胞表达CK19、β1整合素。倒置相差显微镜下见汗腺细胞呈扁平多角形,表达汗腺细胞标志细胞CK7、18、19及CEA。结论:本实验结果说明胶原酶消化法分离培养成人表皮干细胞及汗腺样细胞是可行的。
汗腺细胞;表皮干细胞;培养;分离;鉴定
干细胞及组织工程学科最近几年的发展,为大面积烧、创伤患者的修复开辟了新的途径。2006年,Moore KA和Lemischka IR等人[1]发现:表皮干细胞(Epidermal Stem Cells,ESCs)来源于胚胎的外胚层,是属于皮肤的一种专能干细胞,也是一种成年组织的干细胞,其增殖和分化成表皮中各种细胞的能力维持着皮肤正常表皮结构,并且可以在一定诱导条件下表现出胚胎干细胞性能的双向分化能力,是一种潜在的多能干细胞,对于组织工程学科而言是很有前景的一种细胞。
皮肤作为人体面积最大的器官,担负着非常重要的生理功能,对于整形外科大夫而言,一个完整并且具有功能的皮肤对于维持外观也是有着十分重要的作用。然而烧、创以及战伤中,皮肤是首当其冲被损坏的器官。严重的皮肤损伤会导致皮肤附属器损伤后再生困难,然而汗腺作为皮肤重要的附属器官之一,对于机体有着分泌和排泄汗液,而且可调节体温的功能;缺失汗腺等附属器的瘢痕组织则很难完成这一任务,因而导致烧、创以及战伤的患者生活质量严重下降,也伴随着生理及心理的严重障碍。因此如何有效地在体外培养人汗腺细胞对于从细胞水平深入研究汗腺的结构和功能有着重大的意义,并且也为后期的表皮干细胞分化实验提供实验基础。
研究成人表皮干细胞和汗腺细胞(Sweat Gland cells;SGCs)的体外分离培养和增值及鉴定,可为观察ESCs和SGCs共培养前后细胞形态、细胞表型改变;探讨ESCs再生SGCs的可行性提供前提条件并且打下坚实的实验基础。
1 材料和方法
1.1设计与取材
2014年10月-2015年3月,在解放军总医院第一附属医院实验室进行细胞学的体外观察及鉴定实验。标本选自无损伤全层成人正常皮肤及不同年龄段成人包皮,分别由解放军总医院第304临床部烧伤整形五病区及泌尿外科门诊提供,均取得患者知情同意。
1.2主要试剂及材料
DMEM/F12基础培养基(Gibco公司),FBS(Gibco公司),PBS,青霉素/链霉素/俩性霉素B三抗(美国PAA公司)、胰酶-乙二胺四乙酸(EDTA)、K-SFM培养基,重组人表皮生长因子(rh-EGF)、Dispase酶(Gibco公司),Ⅳ型胶原(美国Sigma公司);Ⅱ型胶原酶;β1整合素(β1-integrin)受体单克隆抗体(英国Abcam公司),CK19受体单克隆抗体,癌胚抗原(CEA)单克隆抗体,倒置显微镜(德国Leica公司)、离心机(日本Kubota公司)。生物净化工作台(北京伟达净化研究所)。
1.3方法
1.3.1成人表皮干细胞的分离培养:包皮组织碘伏浸泡5~10min,酒精脱碘。紫外线灭菌工作台上利用无菌外科手术器械去除皮下组织。将剩余组织修剪出1cm×1cm大小的皮片,Dispase酶4℃避光消化12~14h后分离表皮和真皮层,尽可能的剪碎表皮,0.125%的胰蛋白酶(内含0.04%EDTA)37℃消化10~15min。加入完全培养液终止消化,仔细吹打。200目筛网过滤。滤液通过离心机(1 300r/min离心5min),弃去上清液,收集细胞。倒置相差显微镜下观察细胞,计数后决定重悬细胞的培养基量,加入适当K-SFM培养基并且缓慢吹打细胞制成单细胞悬液,接种于预先使用Ⅳ型胶原铺板的六孔板中,恒温箱孵育过夜,24h后换液。置于37℃、5%CO2培养箱中继续培养,以后每2~3d换液,当细胞生长融合到70%时传代。
1.3.2成人表皮干细胞鉴定:β1整合素和CK19免疫荧光染色法鉴定:将2代ESCs接种于96孔板中培育24h,用PBS洗涤细胞3次后,4%多聚甲醛固定40min,PBS清洗3次;加入0.3%Triton进行通透化处理;正常山羊血清封闭30min后,倾倒。免洗,加入稀释后的一抗,4℃过夜。隔日使用PBS清洗后加入异硫氰酸荧光素(FITC)标记二抗,避光孵育30min。使用倒置荧光显微镜拍照记录。
1.3.3 CCK-8检测ESCs增殖:分离成人的ESCs,选择生长状态良好的ESCs;胰酶消化,离心后,弃去上清,制作细胞悬液,接种于96孔板中,每孔接种5×103个细胞,分别于1、2、3、4、5、6、7d相应时间点取出一个培养板,相应制作空白对照组,每孔加入CCK-8溶液10μl,培养3h后,在酶标仪上测定吸光度(A)值,根据A450nm值绘制细胞增殖曲线。
1.3.4汗腺细胞的分离培养:将全层无损伤正常全层皮肤,置于PBS中反复漂洗,去除皮下脂肪、血管及肌肉等组织,在25mm2培养皿中将皮肤剪成1mm×1mm左右的组织块,加入内皮消化液3ml,置于37℃、体积分数5%CO2的培养箱中过夜(约10~12h),次日,在紫外线消毒的倒置相差显微镜(50×)下挑取汗腺组织,放置在PBS中清洗汗腺组织,10min后再次挑选出汗腺组织,放置在汗腺培养基中,置于培养箱箱中培养。汗腺培养基汗腺培养基以DMEM/F12作为基础培养液,配以体积分数10%胎牛血清、15μg/L重组人表皮生长因子、4μg/L三碘甲状腺原氨酸、0.5mg/L半琥珀酰氢化可的松、体积分数5%胰岛素转铁蛋白-亚硒酸钠及100U/ml三抗。2~3d,等待汗腺组织贴壁后,补加1~1.5ml汗腺培养液,继续培养,每3~4d换1次培养基。
1.3.5去除混杂的成纤维细胞:培养SGCs过程中,如挑选汗腺组织的过程中PBS清洗不彻底,少量成纤维细胞混杂生长,需及时去除混杂的成纤维细胞,否则影响SGCs的生长;采用低浓度的胰蛋白酶(0.05%)消化成纤维细胞,纯化汗腺细胞,步骤为:PBS洗2次,6孔板中加入2~3ml的0.05%胰蛋白酶,随时在倒置相差显微镜观察,当成纤维细胞开始收缩变圆至脱落,加入内皮完培终止消化,仔细吹打事先标记的成纤维细胞区域,PBS冲洗3次,加入1.5ml汗腺培养基继续培养。
1.3.6汗腺细胞的免疫荧光鉴定:CK7、CK18、CK19和CEA免疫荧光染色法鉴定:将1代SGCs接种于事先放置有载玻片的6孔板中培育24h,PBS洗涤3次,4%多聚甲醛固定40min,PBS清洗3次;0.3%Triton通透化处理;正常山羊血清封闭30min,倾倒。免洗,加入稀释后的一抗,4℃过夜。隔日,PBS清洗后加入异硫氰酸荧光素(FITC)标记二抗,避光孵育30min。倒置荧光显微镜拍照记录。
1.4主要观察指标
培养的ESCs和汗腺细胞的形态及鉴定结果。
1.5统计学分析
采用SPSS2.0统计软件进行数据分析,数据以均数和标准差表示,样本之间比较采用组间t检验,以Sig=0.000<0.05为差异有统计学意义。

图1A2 4h时表皮干细胞还未贴壁,呈圆盘透亮化(100×)

图1B 3d后,表皮干细胞开始贴壁(100×)

图1C 10d后,表皮干细胞长满六孔板(100×)

图1D 第5代表皮干细胞开始分化、衰老,形态相差大(200×)
2 结果
2.1分离培养的表皮干细胞的形态
倒置相差显微镜下观察发现,采用酶消法分离细胞,Ⅳ型胶原酶筛选法培养的人表皮干下细胞,培养24h开始贴壁(图1A),呈卵圆形且透亮。换液后可以发现部分未贴壁漂浮细胞被冲洗掉,其余的细胞3d后基本全部贴壁生长(图1B),10d左右长满六孔板约80%(图1C)。细胞之间连接紧密,呈铺路石状。继续培养,克隆逐渐扩大部分中央会出现细胞复层生长。传代后生长速度极为迅速,一般5d左右便可以传代一次,到第五代时表皮干细胞开始衰老死亡(图1D)。
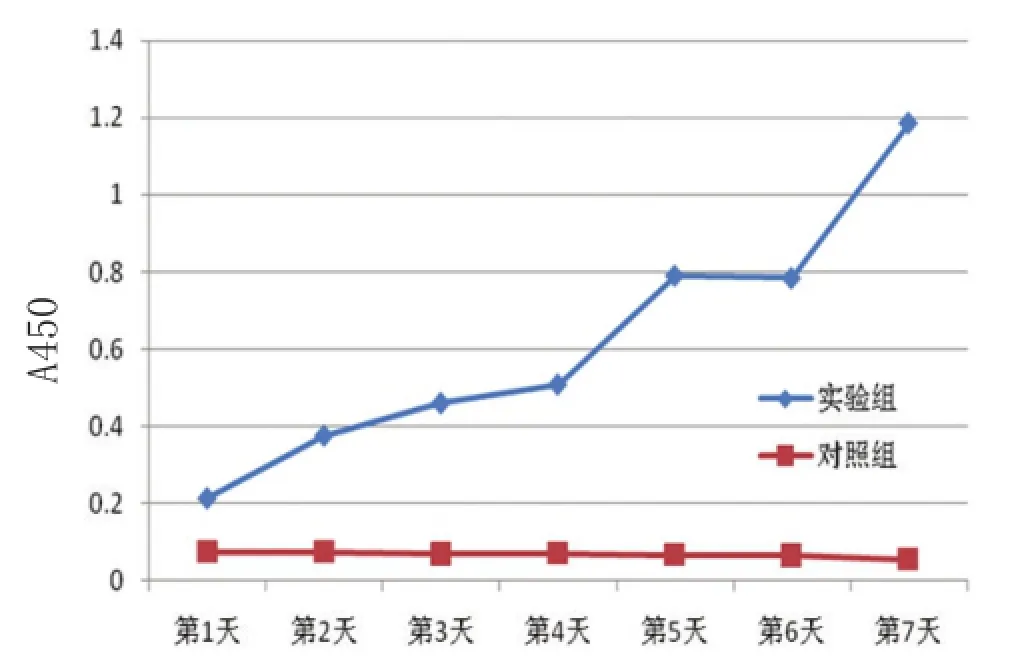
图2 表皮干细胞CCK-8增殖曲线
2.2 CCK-8法检测细胞增殖
实验组增殖曲线(图2)近似S形。细胞接种后1~2d处于潜伏期,第3天开始进入对数增殖生长,第7天达到高峰,而第6天生长不明显,细胞在96孔板中长满板的速度明显快于六孔板,第7天达到高峰。
从统计学角度来讲,F统计量的sig0.000小于0.05,所以拒绝了方差相等的假设。t检验中,双侧sig值0.000小于0.05,因此,在0.05置信度水平时,可认为两者存在显著性差异。因此,实验组的细胞增殖显著高于对照组(表1、表2)。
2.3表皮干细胞免疫荧光表型结果
第三代的人表皮干细胞荧光免疫细胞化学检测结果:β1整合素、p63和CK19强烈表达(图3A~C)。符合表皮干细胞表面标记物,证明所分离培养细胞为表皮干细胞。
2.4分离培养汗腺细胞形态
Ⅱ型胶原酶消化剪碎的皮肤组织,可见汗腺组织游离,呈盘曲状(图4A),消化过度的汗腺组织则呈颗粒状(图4F)。细胞接种于六孔板,2~3d可见贴壁的汗腺组织,并且向外生长汗腺细胞(图4B),培养汗腺细胞的期间有成纤维细胞妨碍汗腺细胞的生长(图4C)。汗腺细胞从游离的完整汗腺组织中生长,呈多边形,持续分裂2周,部分细胞可在后期依然保持分裂能力,在原有的细胞基础上持续生长,可叠加生长,出现类似铺路石样改变(图4D)。
培养汗腺细胞的过程中,显微镜下可以观察到有转运功能的上皮细胞在培养过程中会出现其特有的“Dome”结构形成[2](图4G),其形成可能与腺上皮液体跨膜运输有关。培养4周左右,汗腺细胞显示衰老,细胞空泡样变并且停止继续分裂生长(图4E)。
2.5汗腺细胞免疫荧光结果
免疫荧光细胞化学染色法检测可见本实验组所培养的汗腺细胞强烈表达CEA,符合汗腺细胞的表面标记物,且CK7、CK18、CK19也有明显表达(图5A~D)。

表1 SPSS组间比较结果
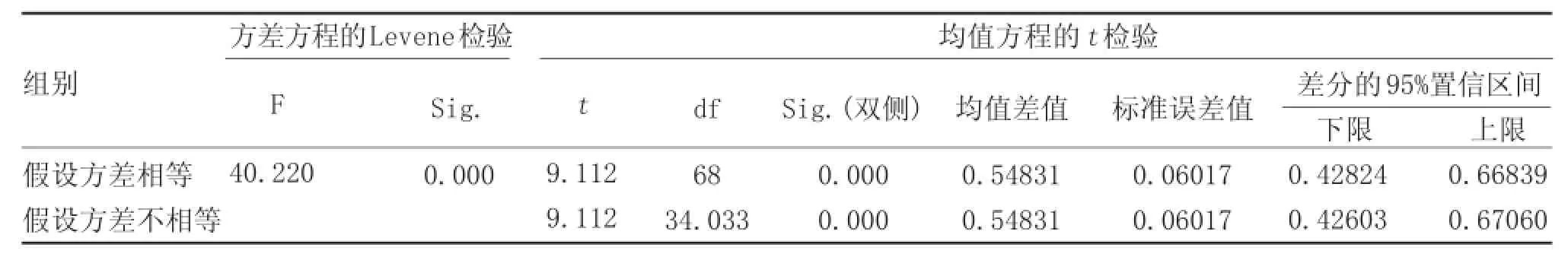
表2 独立样本检验

图3A β-integrin(200X)

图3B p63(200X)
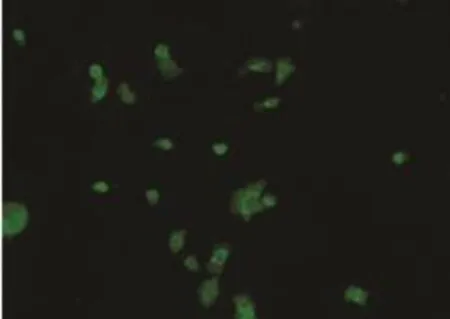
图3C CK19(200X)

图4A 汗腺组织团块(50×)
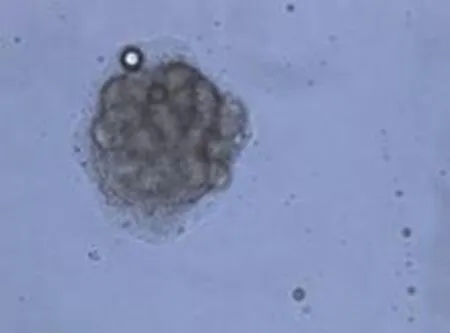
图4B 2d后开始贴壁,SGCs向外生长(100×)
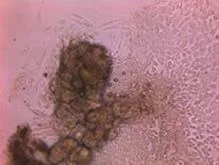
图4C 培养10d后发现成纤维细胞混杂生长(100×)
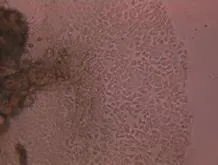
图4D 15后SGCs长满六孔板(100×)

图4E 衰老的SGCs(100×)

图4F 消化过度的汗腺组织(100×)

图4G “Dome”结构(200×)

图5A CK7(200×)
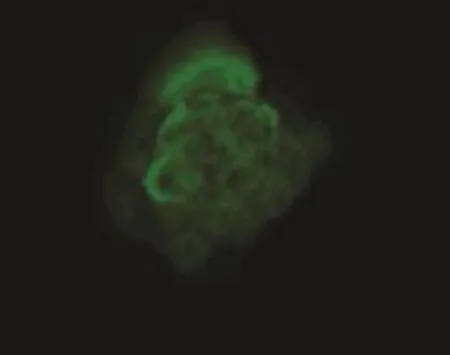
图5B CK18(200×)

图5C CEA(200×)
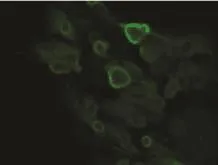
图5D CK19(200×)
3 讨论
3.1成人ESCs的分离培养及鉴定
培养成人表皮干细胞的培养基成分、种植细胞的密度、培养的温度以及Ⅳ型胶原铺板浓度的掌握,对于其体外增殖和分化特性可产生很大的影响。就ESCs而言,随着年龄的不断增长,人体ESCs的含量也会随着减少,同时也会集中于表皮隆突部或者真皮乳头顶部的基底层内,这有可能是儿童皮肤损伤修复能力强于成人的生理依据之一[3]。因此,将体内的表皮干细胞在体外条件下进行分离培养及鉴定,显得十分重要。本实验采用了胰酶消化、高浓度Ⅳ型胶原筛选法提取ESCs。传代时所需时间减少,降低了多次离心对细胞的损伤和丢失等特点。
在表皮干细胞研究中,发现表皮干细胞的标记物种类非常之多,但目前应用最多的则为β1整合素、CK19、p63等[4],ESCs的β1-整合素表达水平是短暂扩增细胞的2倍,由此判断β1-integrin可作为ESCs的表面标记物之一[5]。ESCs表达CK19与CK15[6],但CK15表达减少较早出现,因此认为CK15和CD34是毛囊干细胞的标志物[7],毛囊根鞘膨隆凸部存在CK19阳性细胞,也是ESCs存在的部位,并且CK19阳性细胞同时高度表达α3β1整合素;这些都可以证明CK19是ESCs的另一个重要标记物。还有一种可能成为ESCs表面标记物的是p63,维持ESCs生物特性及增殖分化中起决定性的作用[8]。
3.2汗腺细胞的体外分离培养增殖和鉴定
以前一般采用组织块培养法来取得SGCs[9],但其生长周期较长、传代困难并且掺杂成纤维细胞污染SGC问题严重。本实验利用‖型胶原酶消化法,通过显微镜观察汗腺组织,微量移液器吸取汗腺的方法来分离培养汗腺细胞,但仍需注意以下问题:①选择汗腺丰富的全层无损伤正常皮肤组织如双手、双脚以及额部皮肤等;②皮肤漂洗的时间不宜过长,消毒液浓度不宜太高;这些都是导致汗腺质量下降的原因;③Ⅱ型胶原酶使用浓度及其消化时间:加入含有Ⅱ型胶原酶(2g/L)消化过夜,时间不宜过长,10~12h为宜;④汗腺组织贴壁时添加培养基量:初始汗腺培养基添加过少,不能提供足够的湿度和营养;过多,挑取的汗腺漂浮其中无法贴壁,初始六孔板中加入600~800μl汗腺培养基为宜;⑤皮肤组织处理大小:皮肤离体24h内,无菌手术器械反复剪碎新鲜皮肤组织,1mm×1mm大小为宜,过大不利于汗腺游离,过小则易消化过度,导致其崩解(图D6);⑥随时严密观察汗腺游离情况;⑦使用微量移液器挑取汗腺时,先放入事先准备的PBS中,每挑取一个汗腺置于其中洗涤,尽可能去除混有的成纤维细胞以及多余的‖型胶原酶,然后接种于六孔板中,尽可能避免细胞污染。
目前对汗腺细胞表面标志物缺乏特异且排他性的表面标志物[10-15]。但CEA、CK19、CK18以及CK7对于汗腺细胞有着重要的意义[16-18],因此本实验组通过这四个标记物来证实所分离培养的细胞为汗腺细胞,而不是皮肤组织中的其他上皮细胞。
表皮干细胞作为皮肤组织中的专能干细胞,既可通过迁移分化成为表皮基底层,进一部生成汗腺、毛囊等皮肤附属器官,又可通过最终分化成为各种表皮细胞[19],适宜用作皮肤组织工程的种子细胞。表皮干细胞具有体内周期慢以保证其巨大的增殖潜能及减少DNA复制时的出错几率,且数量相对稀少[20],因此体外分离培养表皮干细胞显得至关重要。
干细胞壁龛学说认为:干细胞所处微环境有较好的诱导分化作用。干细胞进入某种特定的微环境后,其分化信号会有反应并且已分化细胞也会对其他未分化细胞有影响,导致其向某些特定细胞分化[21]。干细胞壁龛学说对于定义细胞种类、特定调控因子及其细胞间的作用有着开创性的框架作用,并且处于生理状态下的干细胞的壁龛对于组织的损害修复,老化以及疾病的进展目前了解甚少,主要是因为体内环境的特殊性,微环境诱导的具体机制及其基因水平的调控等各方面尚不明确,多种因素都对于干细胞的分化均有可能有作用,体内微环境的改变是很难实现的,但体外模拟体内微环境是可行的;由此诱导干细胞体外分化的研究成为热门。采取的方法主要有用目的细胞培养的上清液诱导和与目的细胞共培养两种方式。因此体外分离培养SGCs和ESCs,诱导增殖能力强、具有多种分化能力潜能并且免疫原性低的ESCs分化为汗腺细胞等皮肤附属器相关细胞,为建造一个理想的组织工程皮肤有着很大的帮助。
人工构建包含皮肤附属器的组织工程皮肤是最终发展的方向,由于皮肤损伤导致的皮肤附属器缺失的患者,生活质量严重下降;选择免疫原性低且包含功能的人工皮肤对于严重烧、创以及战伤的患者而言是十分重要且迫切的。因此构建可再生皮肤附属器的种子细胞就显得十分重要。笔者实验组认为:ESCs可作为汗腺组织工程种子细胞的重要来源,前期的分离培养ESCs及SGCs为以后继续探索和阐明ESCs向SGCs分化的机制做出有力铺垫,也为进一步研究提供了有力条件。
[1]Moore KA,Lemischka IR.Stem cells and their niches[J]. Science,2006,311(5769):1880-1885.
[2]JiangT,KumbarSG,NairLS,etal.Biologicallyactive chitosan systems for tissue engineering and regenerative medicine[J].Curr Top Med Chem,2008,8(4):354-364.
[3]董蕊,金岩,刘源,等.表皮干细胞在成人及胎儿不同部位皮肤中的比较研究[J].第四军医大学学报,2003,24(18):1640-1642.
[4]王联群,蓝蔚,黄培信,等.IV型胶原快速黏附法体外分选人胎儿表皮干细胞[J].中国组织工程研究与临床康复,2008,12(43):8535-8538.
[5]Inoue K,Aoi N,Sato T,et al.Differential expression of stemcell-associated markers in human hair follicle epithelial cells[J].Lab Invest,2009,89(8):844-856.
[6]孙晓燕,付小兵.表皮干细胞的研究进展[J].感染、炎症、修复,2008,9(1):52-54.
[7]Nanashima N,Ito K,Ishikawa T,et al.Damage of hair follicle stem cells and alteration of keratin expression in external radiation-induced acute alopecia[J].Int JMol Med,2012,30(3):579-584.
[8]Suzuki D,Senoo M.Increased p63 Phosphorylation marks early transition of epidermal stem cells to progenitors[J].J Invest Dermatol,2012,132(10):2461-2464.
[9]Zhuang Y,Chen X,Xu M,et al.Chemo kine stromal cellderivedfactor1/CXCL12increaseshomingof mesenchymalstemcellstoinjuredmyocardiumand neovascularization following myocardial infarction[J].Chin Med J,2009,122(2):183-187.
[10]蔡飒,潘宇,赵安东.不同剂量PDGF-BB凝胶剂促进糖尿病大鼠创面愈合的实验研究[J].解放军医学杂志,2010,35(10):1201-1203.
[11]Li HH,Zhou G,Fu XB,et al.Antigen expression of human eccrine sweat glands[J].Pifu Binglixue Zazhi,2009,36(3):318-324.
[12]Li H,Fu X,Zhang L,et al.Research of PDGF-BB gel on the wound healing of diabetic rats and its pharmacodynamics[J].Surg Res,2008,145:41-48.
[13]Sheng ZY,Fu XB,Cai S,et al.Regeneration of functional sweat gland-like structures by transplanted differentiated bone marrow mesenchymal stem cells[J].Chuangshang Huifu Yu Zaisheng,2009,17(3):427-435.
[14]SilvaGV,LitovskyS,AssadJA,etal.Mesenchymalstemcells differentiate into an endothelial phenotype,enhance vascular density,and improve heart function in a canine chronic ischemiamodel[J].Circulation,2005,111(2):150-156.
[15]Buchanan JA,Yeger H,Tabcharani JA,et al.Transformed sweat gland and nasal epithelial cell lines from control and cystic fibrosis individuals[J].Cell Sci,1990,95(Pt):109-123.
[16]Li TS,Komota T,Ohshima M,et al.TGF-beta induces the differentiation of bone marrow stem cells into immature cardiomyocytes[J].Biochem Biophys Res Commun,2008,366(4):1074-1080.
[17]HashemiSM,GhodsS,KolodgieFD,etal.Aplacebo controlled,dose-ranging,safetystudyofallogenic mesenchymalstemcellsinjectedbyendomyocardial delivery after an acute myocardial infarction[J].Eur Heart J,2008,29(2):251-259.
[18]Li L,Zhang ZY,Lin HY,et al.Combined transplantation of bone marrow mesenchymal stem cells and pedicled greater omentum promotes locomotor function and regeneration of axons after spinal cord injury in rats[J].Neural Regen Res,2008,3(4):358-362.
[19]Charruyer A,Ghadially R.What’s new in dermatology:epidermal stem cells[J].GItal Dermatol Venereol,2011,146(1):57-67.
[20]Jeans SM,Lowell S,Hutter C.Epidermal stem cells[J].J Pathol,2002,197(4):479-491.
[21]Voog J,Jones DL.Stem cells and the niche:a dynamic duo[J].Cell Stem Cell,2010,6(2):103-115.
编辑/张惠娟
Isolation and culture of human epidermal stem cells and sweat gland cells in vitro
CHEN Fu-huan,SONG Hui-feng,YUE Xiao-tong,LIU Ling-ying,WANG Tong-min,HE Xiu-ye
(The Fifth Ward of Burn and Plastic Surgery,The First Affiliated Hospital of PLA General Hospital,Beijing 100048,China)
Background Research on the culture and identification of human Epidermal Stem Cells(ESCs)and Sweat Gland Cells(SGCs)In vitro,Which can provide the foundation for the feasibility of Epidermal Stem Cells(ESCs)to regenerate Sweat Gland.Objective To study the effective method on isolation and culture of sweat gland cells(SGCS)and human Epidermal Stem Cell(ESCs)in vitro. Methods Foreskin tissue with different ages were collected by Urology Department,after being fully cleaned and disinfected,we removed the subcutaneous tissue;then We trimmed left tissue to 0.5cm× 0.5cm size;with the help ofⅣcollagen to purify and enrich adult's Epidermal stem cells(ESCs). EpidermalStemCells'formwereobservedbyinvertedphasecontrastmicroscope: Immunofluorescence staining to analysis adult's epidermal stem cells'phenotype;CCK-8 was used to detect proliferation curve;We used collagenase digestion to isolate sweat gland from intact skin,and than amplified and identified Sweat Gland Cells(SGCs).ResultsUsing inverted phase contrast microscope to observe isolated adult Epidermal Stem Cells,finding out that Epidermal Stem Cells were cultured like oval,and closely linked among each other,like cobblestone;Immunofluorescence stain was used to find that Epidermal Stem Cells expressed CK19,β1-integrin.We observed that Sweat Gland Cells were cultured like flat polygonal and expressing markers like CK7,CK18,CK19 and CEA.Conclusion In a word,it is feasible to separate and culture Epidermal Stem Cells with adherent method and Sweat Gland Cells with collagenase digestion method.
Sweat Gland Cells(SGCs);Epidermal Stem Cells(ESCs);culture;isolation;identification
Q813.1
A
1008-6455(2015)14-0036-07
国家自然科学基金资助项目(项目编号:81171821)
宋慧锋,主任医师;主要研究方向:美容整形、瘢痕整形以及组织工程等;E-mail:song_huifeng@126.com
2015-05-02
2015-06-29

