L-肉碱的生理功能、生物学制备及检测方法研究进展
杨月英,黄娇芳,顾金杰,史吉平,王红英,*
(1.大连工业大学生物工程学院,辽宁大连116034;2.中国科学院上海高等研究院,生物炼制实验室,上海201210;3.上海科技大学物质科学与技术学院,生物灵感工程实验室,上海201210)
L-肉碱的生理功能、生物学制备及检测方法研究进展
杨月英1,黄娇芳2,3,顾金杰2,史吉平2,王红英1,*
(1.大连工业大学生物工程学院,辽宁大连116034;2.中国科学院上海高等研究院,生物炼制实验室,上海201210;3.上海科技大学物质科学与技术学院,生物灵感工程实验室,上海201210)
L-肉碱即左旋肉碱,又叫维生素BT,是一种广泛存在于动物、植物以及部分微生物体内的活性异构体,其主要功能是参与脂肪酸的代谢。近年来,L-肉碱越来越广泛地用于新型的功能食品和降血脂新药的开发,因此,其生产方法和检测都面临更高的技术要求。文章重点综述了L-肉碱的生理功能、生物法制备以及检测方法,并对其未来发展方向进行展望。
L-肉碱;脂肪酸代谢;生物合成法;活性异构体;检测
L-肉碱即左旋肉碱,化学名为β-羟基-γ-三甲铵丁酸,分子式为C7H15NO3,相对分子质量为161.20,分子结构见图1。
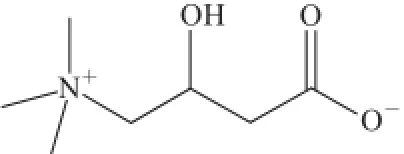
图1 1L-肉碱的分子结构Fig.1Molecular structure of L-carnitine
L-肉碱是无色结晶,易吸潮,是肉碱左(L型)、右(D型)旋异构体之一,动物体内只有左旋肉碱具有生理活性,它与动物体内脂肪酸代谢相关,主要功能是作为载体将长链脂肪酸从线粒体膜外运送到膜内以促进脂肪酸的β氧化,促进脂肪代谢转变为能量[1-2]。
D-肉碱是L-肉碱的竞争性抑制剂,美国食品药品监督管理局于1993年禁止销售D型和DL型(混旋型)肉碱,在制药和保健品配方方面,2006年欧洲药典和2008年美国药典分别对其旋光性进行测定,规定了其用量不得超过4%[3]。因此对通过化学拆分DL-肉碱生产L-肉碱的方法提出了更高的要求[4]。
目前,国内L-肉碱的用途极为广泛,包括添加到多种食品及保健品中:如婴儿奶粉中、运动员饮料中、减肥健美食品中;添加到猪、鸡饲料和鱼饵料等饲料中;医疗用药物中可作为治疗肉碱缺乏症、高血脂、肥胖症等疾病[1,5-6]。
1 1L-肉碱的生理功能
1.1L-肉碱的抗疲劳功能
糖在无氧条件下产生的乳酸在血液中的积累和蛋白质代谢(主要是氧化脱氨基作用)产生的副产物氨类物质的积累是致疲劳的主要原因,左旋肉碱具有抗疲劳作用,周筱燕等[7]研究发现,给小鼠胃内注射左旋肉碱后,小鼠负重游泳时间明显长于对照组,其作用机理是左旋肉碱可以增加肌肝糖原储备,减少运动后肌肝糖原的消耗,抑制乳酸生成,并将脂肪β氧化后产生的脂酰辅酶A排出体外,避免与有机酸结合而导致代谢性酸中毒。此外,L-肉碱还与氨类物质结合后以尿液形式排出体外,防止氨中毒。因此,L-肉碱能延缓运动性疲劳的产生,也可使运动员快速从疲劳中恢复[8-9]。
1.2神经保护作用
L-肉碱不仅在脂肪氧化过程中起重要作用,而且还是一种保护组织免受氧化损伤的有效抗氧化剂(自由基清除剂),图2显示了L-肉碱在人体细胞内的生物合成、分布及主要的生理功能[9]。此外,L-肉碱也具有通过血脑障壁的能力,虽然目前对于L-肉碱在大脑中的调控方式并未完全明了,但确定的是乙酰肉碱在神经元中是乙酰胆碱合成的乙酰基载体,并且影响信号转导途径和相关基因的表达。Virmani等[10]从患有遗传性神经代谢疾病的病症中观察到在这些紊乱的调节中L-肉碱参与了不完全的氧化还原反应。因此,补充L-肉碱不仅能防止组织中L-肉碱的缺乏,也能预防神经方面的疾病。国内外许多研究已发现乙酰肉碱可以减缓神经元的衰退和加快再生[11-13]。

图22L-肉碱在人体正常生理条件下在细胞内的生物合成、分布以及主要生理功能Fig.2L-Carnitine biosynthesis,distribution and main functions in cells under physiological conditions
1.3抗氧化性能
最近国内外研究报道,L-肉碱具有清除过氧化氢、超氧游离子和螯合过渡金属离子的能力[9,14],且对于内源性抗氧化防御系统也起保护的作用,包括谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)的活性免受过氧化伤害,且能避免因随着年龄的增长而发生的过氧化损伤[15]。研究表明,乙酰-L-肉碱能提高老龄动物的学习能力,改善老年痴呆症症状,减轻脑缺血后的神经损伤和再灌注[16],且能提高严重肝性脑病患者的认知能力[13],对肾脏病、心血管病和糖尿病等疾病也能起到预防作用[17-18]。Calò[6]、Calvin[19]等报道,在一些病例中丙酰-L-肉碱能保护人体内皮细胞不被氧化,其主要途径是通过降低脂质过氧化反应和黄嘌呤氧化酶活性,并且刺激亚铁血红素氧合酶-1和内皮一氧化氮合成酶等氧化标记的基因表达。
1.4治疗遗传病中的L-肉碱缺乏症
有机酸血症是由于氨基酸、碳水化合物、脂质及其在线粒体内积累的有机酸和酰基化代谢物而引起分解代谢中的特定酶失活的一种先天性代谢异常病[20]。其临床病症是由于酰基辅酶A化合物的积累而阻断了上述3 种物质的分解代谢途径,酰基辅酶A化合物水解为游离酸而导致的严重酸中毒,这些积累的有机酸不但会导致游离肉碱的活性下降,并且致使其结合一些化合物以尿的形式排出体外[21]。大量实验表明,有机酸血症中积累的代谢产物可能会干扰体内能量和氧化还原反应的平衡[22]。在有机酸败血症和脂肪酸氧化缺陷症中,也发现了中链酰基辅酶A脱氢酶(medium-chain acyl-coenzyme A dehydrogenase,MCAD)、长链酰基辅酶A脱氢酶(long-chain acyl-CoA dehydrogenase,LCAD)、超长链酰基辅酶A脱氢酶(very-long-chain acyl-CoA dehydrogenase,VLCAD)和长链3-羟基-CoA脱氢酶(long-chain 3-hydroxyacyl-CoA dehydrogenase,LCHAD)的缺乏,有研究人员提出在肝脏中积累的这些有机酸有毒化合物将会导致肝功能病变,此外,它们也会被释放到其他组织如大脑中。因此,有机酸血症和脂肪酸氧化缺陷症的实质原因是L-肉碱的缺乏[22-23]。
1.5治疗遗传性的神经代谢疾病
L-肉碱不仅被应用于许多遗传性的神经代谢障碍的治疗,其还具有抑制过量的乙酰CoA积累的作用,在医疗中通常用口服和注射的方式应用于治疗。大量研究表明,在一些有机酸败血症中的生化检测和临床诊断可以用L-肉碱治疗法,其原理是通过中心代谢中L-肉碱的标准组分化疗来进一步确定病症。因此,患者应补充L-肉碱,以促进排除乙酰类等有毒物质并补充细胞内外缺少的游离肉碱,同时能及时释放出对其他氧化途经有用的乙酰CoA。根据病人的年龄、营养状况及代谢情况,每天摄取的L-肉碱的剂量范围在50~300 mg/kg之间[24-25]。也有研究发现,L-肉碱对丙酸血症、甲基丙二酮症、异戊酸血症、3-羟基-3-甲基戊二酸血症和戊二酸尿症Ⅰ型等患者也有利[26]。
2 2L-肉碱的制备方法
2.1L-肉碱的生物制备方法与合成途径
L-肉碱的生产方法主要有化学合成法、直接提取法、微生物发酵法和酶转化法等。目前,国内主要采用化学合成法生产,即先合成DL-混旋肉碱,然后进行拆分得到L-肉碱,该方法环境污染较大,并且废弃副产物D-肉碱而造成资源浪费[5]。生物转化法能比化学合成法减少排放50%的有机废物、减排25%的废水和减排90%的焚烧废物[27],因此生物转化法生产L-肉碱成为研究的热点,目前主要研究是用巴豆甜菜碱为底物合成L-肉碱。大部分微生物都有将一些前体物质转化为L-肉碱的能力,如细菌、放线菌、霉菌、酵母菌中几十个属的上百种微生物,产量比较显著的微生物有:大肠杆菌(Escherichia)、变形杆菌(Proteus)、醋酸杆菌(Acetobacter)、不动杆菌(Acinetobacter)、假单胞菌(Pseudomonas)、酿酒酵母(Saccharomyces cerevisiae)、产朊假丝酵母(Candida utilis)、泡盛曲霉(Aspergillus awamor)、米曲霉(Aspergillus oryzae)、红曲霉(Monascus anka)、黑曲霉(Aspergillus niger)等[28]。表1列出了能将一些底物转化为L-肉碱的微生物及其相关的酶[27],图3显示了微生物体内L-肉碱的合成代谢途径。

表1 转化手性或非手性底物为L-肉碱的微生物及其转化过程中相关的酶Table1Microorganisms used fordfor L L-carnitine production from chiral iral and achiral substrates and the enzyme activities involved
不同底物采用的代谢途径及涉及的酶不同,主要采用的底物有巴豆甜菜碱、γ-丁基甜菜碱和D-肉碱,涉及的酶包括:1)以γ-丁基甜菜碱为底物的代谢酶有γ-丁基甜菜碱羟化酶、γ-丁基甜菜碱CoA连接酶、γ-丁基甜菜碱CoA脱氢酶和L-肉碱脱水酶等[29];2)以巴豆甜菜碱为底物涉及的代谢酶有巴豆甜菜碱CoA连接酶、巴豆甜菜碱CoA水和酶和巴豆甜菜碱CoA还原酶等[27,30];3)以D-肉碱为底物的代谢途径涉及的酶主要是D-肉碱消旋酶[31]。 2.2 利用巴豆甜菜碱为底物转化生成L-肉碱

图3微生物体内L-肉碱的合成代谢途径Fig.3L-carnitine metabolism in bacteria

图4微生物体内转化巴豆甜菜碱生成L-肉碱的途径Fig.4Biotransformation pathway from crotonobetaine to L-carnitine in bacteria
此过程中巴豆甜菜碱在水溶性胞内酶巴豆甜菜碱水合酶(CaiD)的作用下生成L-肉碱,由于是胞内酶,所以此过程需要巴豆甜菜碱转移酶(CaiT)的协助,也有研究报道细胞经破碎后其转化率大大提高,但此方法对产物后处理并不利。巴豆甜菜碱还原酶(CaiA)只在有氧或厌氧条件下电子受体量多于巴豆甜菜碱时存在,催化巴豆甜菜碱转化成γ-丁基甜菜碱,因此在基因改造过程中通常将编码巴豆甜菜碱CoA还原酶(CaiA)的基因(caiA)删除来提高L-肉碱的产量,目前研究较清楚的有大肠杆菌E. coli O44 K74,其肉碱的代谢与位于染色体上的操纵子caiTABCDE有关[32-33]。1995年,Eiehler等[34-35]将大肠杆菌中caiD(编码巴豆甜菜碱水和酶CaiD的基因)、caiE基因克隆并获得转基因工程菌E. coli K38,其肉碱消旋酶含量大增,活性显著提高,更有利于转化DL-肉碱为L-肉碱。
最近也有研究人员将E. coli BW25113菌株进行了基因改造,当微生物以巴豆甜菜碱为底物进行转化时,主要有两个去路,一个是在巴豆甜菜碱CoA水和酶CaiD(由caiD基因编码)的作用下生成L-肉碱,而另一个去路是在巴豆甜菜碱CoA还原酶CaiA(由caiA基因编码)的作用下生成了γ-丁基甜菜碱,这一途径对产L-肉碱很不利,因此若阻断这一途径,必须敲除caiA基因[27,30]。目前也发现延胡索酸具有抑制CaiA酶活性的作用,特别是在三羧酸循环(tricarboxylic acid cycle,TCA)过程中产生的延胡索酸可以作为电子受体来抑制caiA基因(表达巴豆甜菜碱CoA还原酶CaiA)的表达。菌体内L-肉碱的生成是一种耗能过程,而基因aceK与aceA基因分别编码阻遏异柠檬酸脱氢酶活性的蛋白和异柠檬酸裂解酶,两种酶对TCA循环都不利,因此在实验中通过敲除这两种基因来促使TCA循环的顺利进行,产生较多的能量[30]。另外,有研究者用人工合成的启动子p37替换了内源性启动子pcai后,可以消除E. coli BW25113菌的厌氧依赖性,最终得到BWΔaceK ΔcaiA p37cai突变体,它几乎能使底物达到完全转化的水平[30]。
在菌体转化过程中通过对一些文献中的实验结果比较来看,用休止细胞生产L-肉碱好于用生长细胞,一种休止细胞的固定方法是将培养后的菌体与卡拉胶溶液和KCl溶液硬化制备而成,固定化细胞可反复利用,从而能降低成本的投入[36]。报道的上述大肠杆菌野生型BW25113在含有延胡索酸的培养基中经厌氧生长后,收集菌体转移到含有50 mmol/L巴豆甜菜碱的磷酸盐溶液中,产率可达4.6 g/(L·h),而通过基因改造得到的突变株BWΔaceK ΔcaiA p37cai的产率约为10 g/(L·h)左右[30]。
2.3利用γ-丁基甜菜碱为底物转化生成L-肉碱
γ-丁基甜菜碱是L-肉碱生物合成的直接前体,在动物体内由赖氨酸、甲硫氨酸等物质转化合成。图5显示了微生物利用γ-丁基甜菜碱为底物,经过底物-CoA合成酶、CoA脱氢酶和CoA水解酶等几步反应得到L-肉碱的途径,虚线框内表示假单胞菌利用γ-丁基甜菜碱在γ-丁基甜菜碱羟化酶(gamma-butyl betaine hydroxylase,BBH)的作用下生成L-肉碱的过程[37]。
早在21世纪80年代初就有人选育出将γ-丁基甜菜碱高效转化为L-肉碱的菌株,转化率可达99%以上。1992年瑞士Hoeks等[38]报道了突变株HK1349在400 L反应器中试规模下,用细胞循环方法连续转化γ-丁基甜菜碱底物制备L-肉碱,其转化率能保持在95%以上,同年中山清等也筛选到无色杆菌、假单胞菌属的微生物也具有将γ-丁基甜菜碱生成L-肉碱的能力。尽管通过γ-丁基甜菜碱转化来生产L-肉碱的转化率及产量都较高,但γ-丁基甜菜碱本身价格昂贵,成本高,且用此法生产L-肉碱过程中,还需要很多辅助因素,因此在工业化生产中有一定难度,但用它作为前体物得到的转化率是目前最高的,目前也有一种方法用巴豆甜菜碱在其还原酶的作用下生成γ-丁基甜菜碱的合成方法正在研究。
很多业主挑选越厚越重的瓷砖是觉得它的强度和抗折性更好。瓷砖的强度取决于它的密度,而不全在于它的厚薄。目前,国际建筑陶瓷产品的发展方向是轻、薄、结实、耐用、个性化。鉴别瓷砖强度的高低,可查看瓷砖背面颗粒的细腻程度。一般情况下,瓷砖颗粒越细腻,致密度越高,其破坏强度就越高。
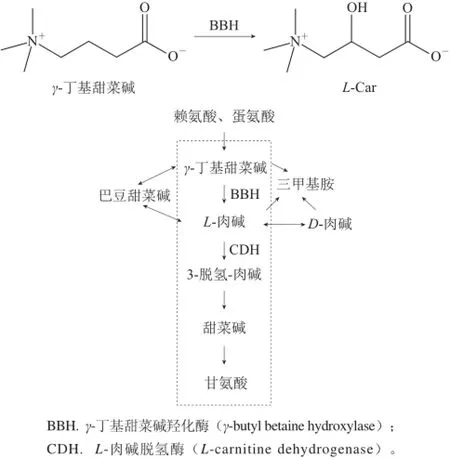
图5微生物体内转化γ-丁基甜菜碱生成L-肉碱的途径Fig.5Biotransformation pathway fromγ-butyrobetaine to L-carnitine in bacteria
2.4利用D-肉碱为底物转化生成L-肉碱
从D-肉碱到L-肉碱可以有两种方法,一种是直接在肉碱消旋酶的作用下相互转化生成,另一种是在D-肉碱脱氢酶和L-肉碱脱氢酶共同作用下,首先在D-肉碱脱氢酶的作用下将D-肉碱转化为3-脱氢肉碱,然后由L-肉碱脱氢酶进一步转化为L-肉碱[39]。如:国外已有专利称E. coli O44 K74中存在着一种由caiD基因编码的肉碱消旋酶能将D-肉碱直接转化为L-肉碱,此方法的弊端是制备得到的L-肉碱中D-肉碱的转化率必须接近100%,否则此方法不具备产业化价值[31]。
3 3L-肉碱的检测方法
L-肉碱的检测也是在使用L-肉碱过程中的一个主要环节。据目前报道,瘦肉类产品是L-肉碱的最好来源,奶制品及海鲜中含量相对较低,在果蔬中的含量几乎为零,所以对一些素食者来说,必需定时的补充L-肉碱才能保证体内的L-肉碱不缺乏从而避免代谢疾病[3]。在医疗方面,L-肉碱及肉碱脂的检测对有关脂肪代谢疾病的治疗起着重要作用;在制药方面,由于D-肉碱是L-肉碱的竞争性抑制剂,甚至具有毒性作用,所以在L-肉碱的浓度及纯度检测方面提出了很高的要求,要求检测方法具有高效性、安全性和准确性。本文主要阐述以下几种检测方法:酶法(兼紫外-可见分光光度计法)、色谱法、质谱法、电泳法、电化学法、放射分析法。
3.1酶法检测
L-肉碱的酶法检测法是Marquis等[40]于1964年建立的,其原理是在HEPES-EDTA缓冲体系中乙酰辅酶A首先与L-肉碱在肉碱乙酰转移酶(carnitine acetyltransferase,CAT)的作用下生成游离辅酶A,生成的辅酶A与巯基试剂5,5’二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)反应生成黄色的TNB-,TNB-在412 nm波长处有很强的吸收峰,且辅酶A与L-肉碱之间是等摩尔关系,所以利用比色法于412 nm波长处测定即可间接测定出L-肉碱的含量,有关反应式:
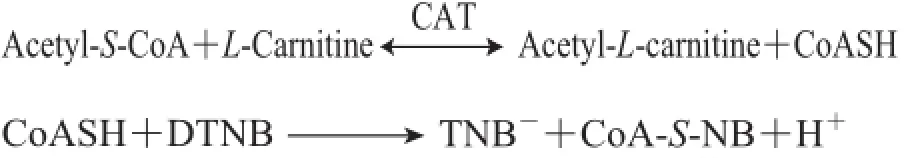
此反应须具备两个条件:1)有较多的乙酰辅酶A能与L-肉碱反应;2)加入的CAT和DTNB量恒定。
此法具有诸多优点:1)缓冲液HEPES-EDTA提供了一个良好的缓冲体系,使反应环境很好的保持在pH 8.0中,因为当pH>8.0时,乙酰辅酶A本身就会分解产生辅酶A,从而使412 nm波长处的吸光度增加;2)灵敏度较高,检测限可达到5 nmol;3)重复性和回收率较好,肉碱的回收率在97.5%以上。此法的不足之处:DTNB作为巯基试剂,与菌体中任何含巯基物存在的CoASH均可反应而使吸光度增加,此外涉及到的酶和催化剂都是比较昂贵的试剂[41-42]。
3.2色谱法检测
L-肉碱的色谱法检测有高效液相色谱法(highperformance liquid chromatography,HPLC)和气相色谱法,色谱法具有检测速度快、高灵敏度和高准确性的特点。
3.2.1高效液相色谱法检测
由于DTNB法容易受硫醇物质的影响,所以有人采用HPLC法直接检测L-肉碱的含量。用C18柱和C8柱可以分离γ-丁基甜菜碱和L-肉碱,但不能分离巴豆甜菜碱和L-肉碱,因此有学者研究采用衍生HPLC法,即首先将样品用衍生试剂处理后再进行HPLC测定,使用硅胶柱就可以成功地将游离肉碱、乙酰肉碱、丙酰肉碱、己酰肉碱、辛酰肉碱和总肉碱等分开[43]。HPLC具有的高精密度、高准确度和高灵敏度等特点而被广泛应用于医学方面的L-肉碱分析。
3.2.2气相色谱法
Monika等[3]建立的气相色谱测定方法的原理是将含有NaOH和NaBH4的肉碱化合物经过160 ℃高温分解后,再进行测定。
3.3质谱法
质谱法是用来分析许多未知化合物中的成分,从而确定物质的分子结构和化学组分。过去10年内,串联质谱法因其较高的灵敏性和准确性而很受欢迎。但由于质谱仪昂贵的价格而还未完全普及到实验室,所以一般在先天性代谢缺陷病的鉴定中使用[44-45]。
3.4放射性分析法
放射性分析法是一种非常灵敏的方法,但有放射性同位素,因此对其操作方法和环境有着严格的要求,此法是在酶促反应中将游离的肉碱转变成含有放射性的乙酰肉碱来进行检测。总肉碱也需要通过碱水解后生成乙酰肉碱来测定,因此游离肉碱和总肉碱水解后计算的乙酰肉碱浓度会不同。Seline等[46]对此法做了进一步验证,其参数包括残留的现象、测定时存在的一些非肉碱放射性物质等,此方法可被用于测定肉类和蔬菜类中的总肉碱、游离肉碱和乙酰肉碱的量。目前西方一些国家报道:已将此法应用在了各种食品中L-肉碱的测定,包括肉类、奶制品和果蔬等日常消费品方面,测定方法是在含有Tris-HCl(pH 7.3)、连四硫酸钠、[3H-甲基]乙酰CoA和肉碱乙酰转移酶的混合液中加入样品,37 ℃反应后,再装入Dowex树脂管中4 ℃温浴,上清液中就会产生含有亮点物质的混合溶液,用闪烁计数器即可计算,计算出鲜牛肉中的含量为40~540 μmol/100 g,牛奶中26 μmol/100 mL[47]。
3.5电泳法
在普遍的色谱分析技术中,电泳法也有其优势,但与HPLC相比,其很少被应用到,电泳法检测系统与紫外分光检测有着直接或间接的联系。一种电泳法测定L-肉碱的方法是在含有奎宁的缓冲体系中间接测定L-肉碱量,而不需要复杂的衍生化反应[48-49]。
3.6电化学法
电化学分析开创了用不同的连续系统来同时分析各种化合物的可能性,且这些连续系统是以具有良好精度的电化学传感器作为探测器的,目前报道的有流动注射分析仪(fl ow injection analysis,FIA)技术和顺序注射分析(sequential injection analysis,SIA)技术[3]。
此外,朱加进等[50]发现用酶联高效液相色谱仪法能更好的避免硫醇物质的影响,也可以准确的检测出L-肉碱而不受D-肉碱的影响,此法简单的原理是在酶法反应的第一步结束后无需加入DTNB,生成的中间物CoASH直接用高效液相色谱仪测定,从而间接计算出L-肉碱的量。
目前,国内采用的检测方法也有多种,比如郑璞等[41]用酶法测定微生物中的L-肉碱量;赵亚明等[51]用高效液相色谱法检测血浆中的L-肉碱量;竺琴等[52]用高效液相色谱-质谱联法用测定了婴幼儿配方奶粉中的左旋肉碱量。
4 结语
L-肉碱在脂肪氧化过程中起重要的载体作用,对神经类疾病有良好的预防作用,并且有一定的抗氧化作用。目前L-肉碱的巨大市场需求对其生产方法和技术提出了更高的要求,许多研究者都在探索除化学合成法之外更先进、安全、高效的方法。L-肉碱的生物制备方法主要有直接提取法、微生物发酵法和酶转化法等,而从生物组织直接提取L-肉碱的方法具有含量低、成本高的特点而难以得到推广。因许多微生物中存在L-肉碱,比如酵母菌、曲霉、青霉、根霉等,将这些微生物通过液体深层培养或固体发酵,可以积累L-肉碱,虽然目前通过发酵得到L-肉碱的水平还比较低,但此法是最具研究价值和应用潜力的制备方法。目前也只有瑞士、意大利和日本等实现了商业化生产,我国利用生物法制备L-肉碱的研究起步较晚,尚未形成商业化,因此利用微生物生产L-肉碱与检测L-肉碱的精确方法都需亟待研究,对增加我国在此领域的知识产权优势具有重要意义。国内
L-肉碱问世以后,将部分或完全替代进口,并进一步扩大其应用范围,推广前景十分看好。
[1] 向忠权, 蒲国荣, 韦志明, 等. 左旋肉碱的合成与应用[J]. 化工技术与开发, 2013, 42(2): 15-21.
[2] LONZA Ltd. A process for the production of carnitine from β-lactones: EP20100007568[P]. 2012-01-25.
[3] MONIKA D, MALGORZATA S. Analytical approaches to determination of carnitine in biological materials, foods and dietary supplements[J]. Food Chemistry, 2014, 142: 220-232.
[4] 曾云, 丁峰. 左旋肉碱合成与前景浅析[J]. 广东化工, 2012, 39(1): 71-72.
[5]于士淋. L-肉碱的应用及其合成方法[J].化学工程与装备, 2011(11): 145-146.
[6] CALÒ L, PAGNIN E, DAVIS P, et al. Antioxidant effect of L-carnitine and its short chain esters: relevance for the protection from oxidative stress related cardiovascular damage[J]. International Journal of Cardiology, 2006, 107(1): 54-60.
[7]周筱燕,陈静,刘常秀,等. 左旋肉碱抗疲劳实验研究[J]. 热带医学杂志, 2011, 11(7): 740-742.
[8] ULUISIK D, KESKIN E. The effects of L-carnitine on some hematological parameters in rats fed a cholesterol-rich diet[J]. Biotechnic and Histochemistry, 2014, 89(5): 393-397.
[9] GRAZIELA S R, CARMEN R V, MOACIR W. L-carnitine supplementation as a potential antioxidant therapy for inherited neurometabolic disorders[J]. Gene, 2014, 533(2): 469-476.
[10] VIRMANI A, GAETANI F, IMAM S, et al. The protective role of L-carnitine against neurotoxicity evoked by drug of abuse, methamphetamine, could be related to mitochondrial dysfunction[J]. Annals of the New York Academy of Sciences, 2002, 965: 225-232.
[11] ABDUL H M, BUTTERFIELD D A. Involvement of PI3K/PKG/ ERK1/2 signaling pathways in cortical neurons to trigger protection by cotreatment of acetyl-L-carnitine and alpha-lipoic acid against HNE-mediated oxidative stress and neurotoxicity: implications for Alzheimer’s disease[J]. Free Radical Biology and Medicine, 2007, 42(3): 371-384.
[12] BIANCHI E, di CESARE MANNELLI L, MENICACCI C, et al. Prophylactic role of acetyl-L-carnitine on knee lesions and associated pain in a rat model of osteoarthritis[J]. Life Sciences, 2014, 106(1/2): 32-39.
[13] MALAGUAMERA M, VACANTE M, MOTTA M, et al. Acetyl-L-carnitine improves cognitive functions in severe hepatic encephalopathy: a randomized and controlled clinical trial[J]. Metabolic Brain Disease, 2011, 26(4): 281-289.
[14]杨静.左旋肉碱的生理功能及在功能性食品中的应用[J].农业工程, 2012(1): 54-59.
[15] AGNIESZKA A, ELZBIETA S. The influence of L-carnitine supplementation on the antioxidative abilities of serum and the central nervous system of ethanolinduced rats[J]. Metabolic Brain Disease, 2010, 25(4): 381-389.
[16] XIE Jiang, ZENG Qiutang, WANG Le. The protective effect of L-carnitine on ischemia-reperfusion heart[J]. 华中科技大学学报: 医学英德文版, 2006, 26(2): 188-191.
[17] MESCKA C P, WAYHS C A, VANZIN C S, et al. Protein and lipid damage in maple syrup urine disease patients: L-carnitine effect[J]. International Journal of Developmental Neuroscience, 2013, 31(1): 21-24. [18] MESCKA C, MORAES T, ROSA A, et al. in vivo neuroprotective effect of L-carnitine against oxidative stress in maple syrup urine disease[J]. Metabolic Brain Disease, 2011, 26(1): 21-28.
[19] CALVIN W, KAMAKSHI V G, ERNEST J M. Antioxidants L-carnitine and D-methionine modulate neuronal activity through GABAergic inhibition[J]. Journal of Neural Transmission, 2014, 121(7): 683-693.
[20] WAJNER M, LATINI A, WYSE A T, et al. The role of oxidative damage in the neuropathology of organic acidurias: insights from animal studies[J]. Journal of Inherited Metabolic Disease, 2004, 27(4): 427-448.
[21] REUTER S E, EVANS A M. Carnitine and acylcarnitines: pharmacokinetic, pharmacological and clinical aspects[J]. Clinical Pharmacokinetics, 2012, 51(9): 553-572.
[22] WAJNER M, GOODMAN S I. Disruption of mitochondrial homeostasis in organic acidurias: insights from human and animal studies[J]. Journal of Bioenergetics and Biomembranes, 2011, 43(1): 31-38.
[23] SPIEKERKOE U, WOOD P A. Mitochondrial fatty acid oxidation disorders: pathophysiological studies in mouse models[J]. Journal ofInherited Metabolic Disease, 2010, 33(5): 539-546.
[24] BURLINA A, WALTER J. Management of organic aciduria[C]// The 34thEuropean Metabolic Group Meeting, Publication of Workshop Results, 2002: 34-38.
[25] EVANGELIOU A, VLASSOPOULOS D. Carnitine metabolism and defi cit: when supplementation is necessary?[J]. Current Pharmaceutical Biotechnology, 2003, 4(3): 211-219.
[26] KOLKER S, CHRISTENSEN E, LEONARD V, et al. Diagnosis and management of glutaric aciduria type Ⅰ-revised recommendations[J]. Journal of Inherited Metabolic Disease, 2011, 34(3): 677-694.
[27] BERNAL V, SEVILLA Á, IBORRA J L, et al. Production of L-carnitine by secondary metabolism of bacteria[J]. Microbial Cell Factories, 2007, 6: 31.
[28]郑璞,孙志浩.产L-肉碱微生物及发酵法生产L-肉碱研究概况[J].食品与发酵工业, 1997, 24(4): 63-68.
[29] EICHLER K, SCHUNCK W H, KLEBER H P, et al. Cloning, nucleotide sequence, and expression of the Escherichia coli gene encoding carnitine dehydratase[J]. Journal of Bacteriology, 1994, 176(10): 2970-2975.
[30] ARENSE P, BERNAL V, CHARLIER D, et al. Metabolic engineering for high yielding L(-)-carnitine production in Escherichia coli[J]. Microbial Cell Factories, 2013, 12: 56.doi:10.1186/1475-2859-12-56.
[31] CANOVAS M, CASTELLAR M R, OBON J M, et al. Racemisation of D(+)-carnitine into L (-)-carnitine by Escherichia coli strains[J]. Process Biochemistry, 2003, 39: 287-293.
[32] ENGEMANN C, KLEBER H P. Epigenetic regulation of carnitine metabolizing enzymes in Proteus sp. under aerobic conditions[J]. FEMS Microbiology Letters, 2001, 196: 1-6.
[33] MULLER D M, SEIM H, KISEE W, et al. Effercts of oral L-carnitine supplementation on in vivo long-chain fatty acid oxidation in healthy adults[J]. Metabolism Clinical and Experimertal, 2002, 51(11): 1389-1391.
[34] CASTELLAR M R, OBON J M, MARAN A, et al. L(-)-Carnitine production using a recombinant Escherichia coli strain[J]. Enzyme and Microbial Technology, 2001, 28: 785-791.
[35] SEVILLA A, SCHMID J W, MAUCH K, et al. Model of central and trimethylammonium metabolism for optimizing L-carnitine production by E. coli[J]. Metabolic Engineering, 2005, 7(5/6): 401-425.
[36] 孙志浩, 郑璞, 王蕾, 等. L-肉碱的酶法制备: 中国, 96117166.9[P]. 1997-10-15.
[37]卢向锋,张鹏程,李倩延, 等.一株假单胞菌(Pseudomonas sp.) L-1菌株γ-丁基甜菜碱羟化酶基因bbh的克隆、表达及酶学性质[J].微生物学报, 2012, 52(5): 602-610.
[38]HOEKS F W J M M,KULLA H,MEYER H P.Continuous cellrecycle process for l-carnitine production:performance,engineering and downstream processing aspects compared with discontinuous processes[J].Journal of Biotechnology,1992,22(1/2):117-127.
[39] IANNELLA V. Process for the preparation of L-carnitine hydrochloride of L(-)-carnitine inner salt: US, US 07/099633[P]. 1990-06-12.
[40] MARQUIS N R, FRITZ I B. Enzymological determination of free carnitine concentrations in rat tissues[J]. Journal of Lipid Research, 1964, 5: 184-187.
[41] 郑璞, 孙志浩, 王蕾, 等. 微生物中L-肉碱的酶法测定[J]. 工业微生物, 2000, 30(1): 40-41.
[42] 金世梅, 赵志红, 朱慧, 等. 分光光度法检测保健茶中左旋肉碱[J].粮食与食品工业, 2011, 18(5): 54-57.
[43]LONGO A,BRUNO G,CURTI S,et al.Determination of L-carnitine,
acetyl-L-carnitine and propionyl-L-carnitine in human plasma by highperformance liquid chromatography after per-column derivatization with1-aminoanthracene[J].Journal of Chromatography B,1996,686:129-139.[44]HARDY D T,PREECE M A,GREEN A.Determination of plasma free carnitine by electrospray tandem mass spectrometry[J].Annals of Clinical Biochemistry,2001,38:665-670.
[45]黄芳, 黄晓兰, 吴惠勤, 等. 液相色谱-质谱法快速测定婴幼儿配方食
品中L-肉碱的亲水相互作用[J]. 分析实验室, 2011, 30(10): 111-114. [46] SELINE K G, JOHEIN H. The determination of L-carnitine in several
food samples[J]. Food Chemistry, 2007, 105(2): 793-804.
[47] DEMARQUOY J, GEORGES B, RIGAULT C, et al. Radioisotopic determination of L-carnitine content in foods commonly eaten in western countries[J]. Food Chemistry, 2004, 86(1): 137-142.
[48] PROMSILA W, MORAND R, KKAHENBUHL S, et al. Determination of carnitine in food and food supplements by capillary electrophoresis with contactless conductivity detection[J]. Electrophoresis, 2010, 31(13): 2186-2191.
[49]LAURA S H,MARIA C P,CARMEN G R,et al.Determination of L-and D-carnitine in dietary food supplements using capillary electrophoresis-tandem mass spectrometry[J].Food Chemistry,2010,120(3):921-928.
[50]朱加进, 童玲, 冯盘, 等. 奶粉中L-肉碱含量和纯度的测定方法: 中国, 201010274573.5[P]. 2010-09-07.
[51]赵亚明, 李任, 王得新, 等. 高效液相色谱法检测血浆左旋肉碱方法的建立[J].中国临床神经科学, 2006, 14(5): 528-532.
[52]竺琴, 苏流坤, 郑家概, 等. 高效液相色谱-质谱联用测定婴幼儿配方奶粉中的左旋肉碱[J]. 分析测试学报, 2012, 31(3): 355-358.
Advances in Physiological Functions,Biotransformation and Detection of L-Carnitine
YANG Yueying1,HUANG Jiaofang2,3,GU Jinjie2,SHI Jiping2,WANG Hongying1,*
(1.College of Biological Engineering,Dalian Polytechnic University,Dalian116034,China;2.Laboratory of Biorefinery,Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai201210,China;3.Integrative Bio-inspired Molecular Engineering Laboratory,School of Physical Science and Technology,ShanghaiTech University,Shanghai201210,China)
L-Carnitine,also named vitamin BT,is an active compound found in animals and vegetal tissues,as well as in micr oorganisms. L-carnitine plays an important role in fatty acid metabolism.In recent years,L-carnitine has been increasingly used as a novel food additive and clinically applied in reducing blood fat,so that the demand for L-carnitine is increasing in the worldwide market,and the development of manufacturing and detection methods is needed.Herein,the physiological functions,biotransformation and detection methods of L-carnitine are summarized,and the future directions of L-carnitine are put forward in this review.
L-carnitine; fatty acid metabolism; biotransformation; active isomer; detection
TS201.2
A
1002-6630(2015)05-0205-07
10.7506/spkx1002-6630-201505039
2014-05-09
国家自然科学基金青年科学基金项目(31400042)
杨月英(1989—),女,硕士研究生,研究方向为微生物基因工程。E-mail:qhyyy0323@163.com
王红英(1968—),女,副教授,硕士,研究方向为微生物资源利用。E-mail:2002wanghongying@163.com

