高中化学核心概念教学的实践与思考
——以“强电解质和弱电解质”为例
张金怡
(江苏省常州高级中学 江苏 常州 213000)
高中化学核心概念教学的实践与思考
——以“强电解质和弱电解质”为例
张金怡
(江苏省常州高级中学江苏常州213000)
以“强电解质和弱电解质”的教学为例,分析了通过情境的创设、实验的探究、问题的设置以及历史的视角来认识化学学习中核心概念的过程,实现了基于学科思想、学科特点和内在价值的教学。
核心概念;强电解质和弱电解质;知识价值
一、问题的提出
美国著名课程专家埃里克森提出:“核心概念应该是居于学科中心,且有超越课堂的持久和迁移价值的关键性原理、方法和概念。同时,它们还具有广阔的解释空间,能为相关领域的发展提供深入的视角,并加强学科之间的联系。”
那么,化学核心概念则是建立在化学发展的过程中,在化学学科体系中有着重要的地位,体现了化学运动规律、本质属性,是一种能对化学现象和事实概括与抽象的思维形式,更是化学学科体系的精髓和命脉[1]。
在《化学反应原理》模块中,就包含着大量的化学核心概念和原理知识。据有关调查显示,师生普遍反映高中化学中最难教和最难学的就是《化学反应原理》。这个模块的学习,需要学生从宏观到微观、从定性到定量、由静态到动态等多个角度观察、思考化学变化的问题;学会建立和转换不同概念之间的关系;更需要通过对纷繁复杂的化学现象背后共同规律的认识,体会现象背后的统一性。因此,在对学生的思维能力和思维品质基础较高要求的同时,也对教师教学提出了高要求[2]。
基于对化学核心概念涵义的界定及有关师生的调查,笔者就怎样通过课堂教学来帮助学生建构化学核心概念,在认知得到发展的基础上,从而改变对化学物质及变化的认识方式,进行了关于化学核心概念的教学实践和探索,以《化学反应原理》模块中“强电解质和弱电解质”一节为例。
二、高中化学核心概念“强电解质和弱电解质”的教学实践与思考
1.教学分析
“强电解质和弱电解质”位于苏教版《化学反应原理》专题三“溶液中的离子反应”。溶液是很多化学反应发生的场所以及所需的介质,与我们的生命活动也息息相关。通过对强弱电解质的学习,能促使学生学会从微观的角度,认识物质在水溶液中的存在状态,从而为后续理解溶液中化学反应的实质奠定基础,初步建立起研究水溶液系统的思维方法,因而属于化学核心概念。
在认识强弱电解质概念之前,学生已经知道了酸、碱、盐在溶液中能发生电离,能书写强酸、强碱和大部分可溶性盐等强电解质的电离方程式。此外,化学反应速率和化学平衡的学习,使学生建立了对化学反应速率、化学平衡状态等概念的基本认知,这也有助于他们更好地理解弱电解质电离的特征。
2.教学目标
结合生活中的实例,理解电解质的概念,感受电解质在生活、生产中的重要作用。
通过方案解读与实验探究,在提升实验技能的同时,认识到强电解质和弱电解质的差异是它们在水溶液中的电离程度不同,从而培养科学研究的精神和严谨的科学态度。
通过强、弱电解质概念的学习,体会学习概念性知识常用的“归纳法和演绎法”。
3.教学过程
(1)通过情境的设置,体现知识的应用价值
教学情境的创设是教学设计的关键。在化学概念教学中,教学情境更有利于学生主动建构化学概念知识,为学生提供一个发现问题并自主解决问题的机会,最终建立概念知识体系,取得更好的教学效果。
教学片段(一)
[师]军训是高中生活中一段难忘的时光,同学们是否还记得,我们在烈日下训练得汗流浃背时喝过的那一杯盐开水么?为什么此时来点淡盐水比糖水,更加利于我们的身体健康呢?
[投影]图片:军训时喝过的盐开水。
[生]大量流汗后,汗液中含有的电解质氯化钠随之流失,所以应补充淡盐水,维持人体平衡。
[师]糖水中的蔗糖是不是电解质呢?怎样的物质我们可以称之为电解质?
[生]蔗糖溶于水不能电离,所以是非电解质。只有在水溶液中或熔融状态下能够导电的化合物才能称之为电解质;如果在两种情况下都不能导电的化合物,则是非电解质。
[师]电解质与我们的生活密切相关:
①我们经常能看到这样的安全警告标志。不能用潮湿的手触摸正在工作的电器,否则易发生触电。
②在电解水时,常常向水中加入少量的氢氧化钠或硫酸溶液,从而更快地得到氢气和氧气。
能否尝试用你所学的知识说说其中的原因?
[生]①人体的体液也是电解质溶液,潮湿的手触碰工作的电器形成回路,引发触电。
②纯水导电能力弱,加入少量氢氧化钠和硫酸溶液可以增强导电性,但不影响电解产物。
[师]如果改成加氨水或醋酸能不能增强水溶液的导电性?
[生]可以。
[师]同样是酸和碱,为什么我们一般选择加氢氧化钠和硫酸,而不是氨水和醋酸呢?
[生]可能与加入物质后溶液导电性变化有关。
设计意图:首先从学生熟悉的生活场景出发,引发学生求知的兴趣,并唤起对原有概念的认知。接着,依然选取了生活中的实际案例,使学生进一步体会到“电解质”和我们生活生产的密切关系,并从中逐步引出这节课的研究重点——对“弱电解质”概念的认识。学生以原有概念为基础,从情境中发现问题,并分析解决问题,同时引出了实验探究的主题,符合一般的认知规律。
(2)通过实验探究,加深对概念的直观认识和理解
实验是过程方法教学的重点。通过实验,学生在学习了数据测定、条件控制等实验方法的过程中,也领悟了化学知识。更让学生认识到,实验也是一种重要的科学研究方法,有助于加深对客观事实的理解。从而使概念的形成过程不仅仅停留于表面,而是发生了质的转变。
“强电解质和弱电解质”两个概念只有两句话,但怎样让学生来更好地理解和“完全电离”和“部分电离”的差异是本节课需要突破的难点。本节课通过传统实验和数字实验相结合,分别直接和间接地论证了强电解质“完全”电离和弱电解质“部分”电离的存在,将原本抽象的概念直观地呈现出来,使学生自发地总结出强电解质和弱电解质的概念,体会科学研究的过程。而探究性实验活动又有一定的灵活性,开放程度也大,尽管学生的能力水平不同,但同样得到了发展。
教学片段(二)
[师]电解质溶液导电性的强弱又与什么有直接关系?
[生]和单位体积内自由移动的离子的数目有关,其值越大,溶液的导电性越强。
[师]现有浓度均为0.1mol/L的盐酸和醋酸溶液,你有哪些方法可以来比较两种溶液的导电性?
[生]交流讨论,设计方案,完成实验、交流分享(见表1)。
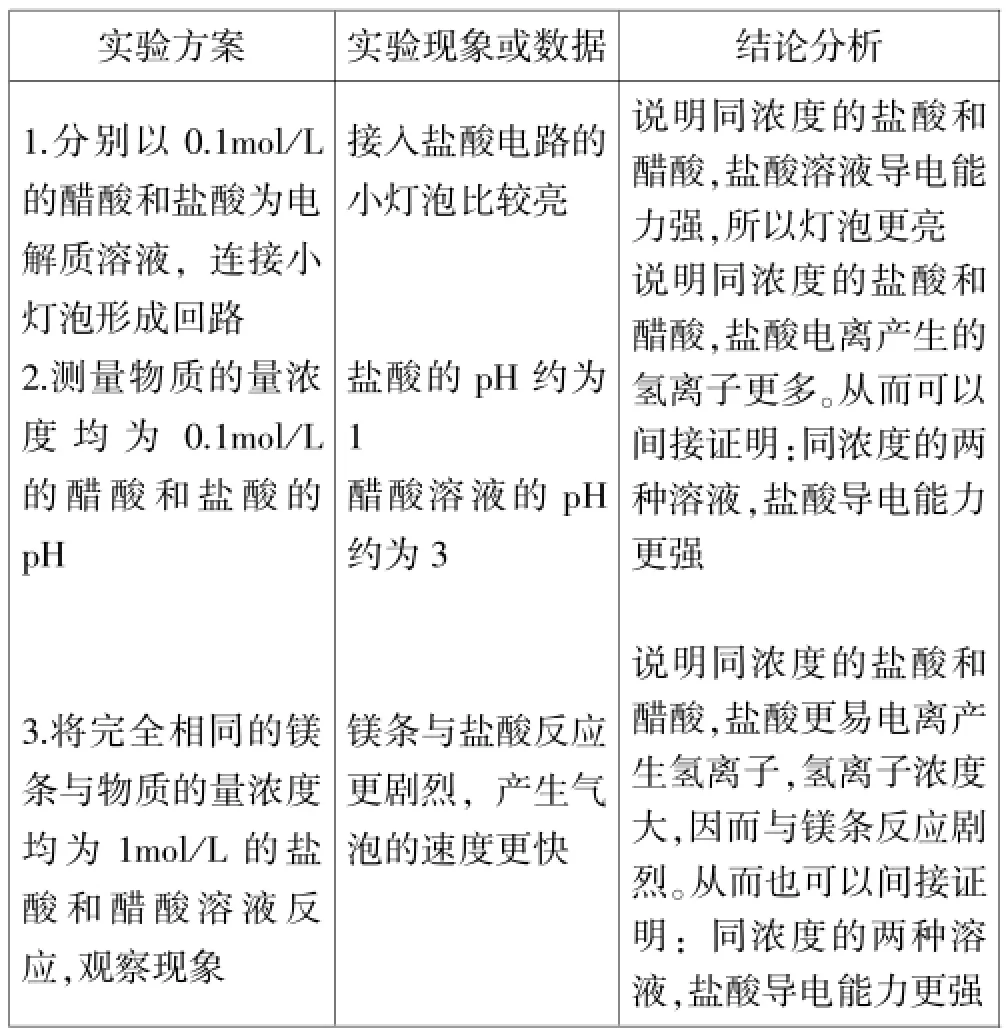
表1 实验验证与探究一
[师]借助于DIS实验系统,我们也可以通过电导率的直接测量来比较两种溶液导电性。
(电导率:以数字表示的溶液传导电流的能力。电导率越大,溶液导电能力越强。)
[演示实验]
DIS实验:测定0.1mol/L的盐酸和醋酸溶液的电导率。
0.1mol/L的盐酸的电导率已超出量程,而0.1mol/L的醋酸电导率约为0.334ms/cm。
[学生总结]同浓度的两种一元酸的电离程度越大,溶液中自由移动的离子的浓度越大,导电性越强。
[师]所以说,不同的电解质在水中的电离程度并不相同,盐酸中氢离子的浓度与酸的浓度相当,说明已经完全电离,而醋酸中氢离子的浓度远小于酸的浓度,说明只是部分电离。观察课本P63页图3-2、图3-3,进一步比较HCl和CH3COOH在水中的电离,你能说说在CH3COOH溶液中除了H+和CH3COO-之外,还存在哪类微粒?
[生]CH3COOH分子和H2O分子。
[师]你能进一步通过实验来确证在醋酸溶液中还存在醋酸分子么?
[生]交流讨论、设计方案。
[师]DIS实验:

[师]对于上述实验结果,你能尝试作出分析么?
[生]盐酸被稀释10倍,其氢离子的浓度也变为原来的1/10,稀释的过程并没有更多氢离子产生。而醋酸溶液稀释之后ΔpH远小于1个单位,则说明有更多氢离子产生了。
[追问]氢离子来源于哪里?
[生]未电离的醋酸分子。
[师]从而我们也间接证明了,醋酸溶液中醋酸分子的存在,而在盐酸中则没有氯化氢分子了。
[师]若将盐酸和醋酸换成是相同浓度的氢氧化钠和氨水,它们的电离程度有无差异?在这两者的溶液中又各自存在哪些微粒?你能否同样设计实验来验证?
[生]模仿对盐酸和醋酸的研究设计实验并论证。
设计意图:结合实验,一方面,引导学生从不同的角度来比较和认识同浓度的盐酸与醋酸电离程度的差异,从而引起导电能力的变化。另一方面,帮助学生理解弱电解质溶液中所含的微粒并设计实验论证,借助数字实验系统将抽象的化学原理知识直观展示。加深了学生对弱电解质概念中“部分电离”的理解,为学生后续学习电离平衡奠定基础,并将所学知识进行迁移应用分析。
3.通过问题的科学设置,提升学生的思维能力
课堂的提问行为在启发学生思考的过程中起着不可替代的作用,如能根据学生的认知特点和学习情况,通过发问、追问、反问、质疑、设问等手段,则能诱发学生反思自己的认知缺陷,拓展自己的思维角度、激发探究欲望,促进概念的理解[3]。
在“强电解质和弱电解质”的教学过程中,设计了贯穿性的系列问题:
1.结合具体的生活场景,提出“什么样的物质是电解质,什么样的物质属于非电解质?”回顾旧知。
2.仍然结合生活实例,提出问题:“电解质溶液为什么能够导电?它们的导电能力是否相同?和什么因素有关?如何通过实验来比较论证?”从而引导学生从实验的角度,来进一步体会电解质溶液导电能力的不同。
3.通过第一组实验使学生认识到,不同的电解质在水中电离程度的差异后,提出问题:如何进一步论证在弱电解质溶液中存在未电离的弱电解质分子?”
4.在学生提炼出“强、弱电解质”的概念后,又设计了问题组:
(1)在我们所认识的物质中,除了氢氧化钠和氯化氢,还有哪些物质属于强电解质;除了醋酸和氨水是弱电解质,还有哪些属于弱电解质?
(2)难溶物一定是弱电解质吗?
(3)强电解质溶液的导电能力是否一定强?
(4)强电解质溶液的导电能力是否一定强于弱电解质溶液?
从而,拓展了概念的外延,揭示了电解质、强弱电解质、难溶物、电解质溶液导电能力之间的关系。
4.通过历史的视角,让学生体会化学概念的研究过程
著名化学家徐光宪曾经说过:“化学的教学要把21世纪化学的生动活泼,立体多维的形象向学生展示出来。不要只讲静态的当代化学,要回顾历史、展望未来。”[4]因此,本节课的教学,最终并没有只停留在化学概念的探索和理解上,而是呈现了这个概念产生的历史过程。
教学片段(三)
[师]通过这节课的学习,我们对于电解质的理解又加深了一步。但回顾化学科学的发展过程,对于电解质的认识却经历过激烈的争论。
[投影]化学史话:我们的身边的酸碱盐都是电解质,化学科学史告诉我们,科学家对电解质在水溶液能导电的根本原因至少争论了80年。
1.法拉第等人认为:“溶液中不存在离子,通电后才产生离子。”
2.法国化学家希托夫等人认为:“电解质的分子与形成它们的原子之间存在着动态平衡,电解质分子与邻近分子之间不断地交换原子,原子
1008-0546(2015)10-0024-03
G633.8
B
10.3969/j.issn.1008-0546.2015.10.010

