溶藻弧菌肽聚糖对凡纳滨对虾白斑综合征病毒的抑制作用
朱卫卫,邱德全, 甘 桢, 鲁义善,简纪常
(广东海洋大学 水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室 // 广东省教育厅水产经济动物病害控制重点实验室,广东 湛江 524025 )
溶藻弧菌肽聚糖对凡纳滨对虾白斑综合征病毒的抑制作用
朱卫卫,邱德全, 甘桢, 鲁义善,简纪常
(广东海洋大学 水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室 // 广东省教育厅水产经济动物病害控制重点实验室,广东湛江524025 )
从患病凡纳滨对虾(Litopenaeus vannamei)体内提取白斑综合征病毒(WSSV),PCR证实WSSV毒性,将病毒粗提液稀释10-2、10-3、10-4和10-5倍,攻毒实验表明,最佳攻毒剂量为10-4倍稀释液。对凡纳滨对虾(Litopenaeus vannamei)分别注射0.05、0.10、0.15 mg/mL的溶藻弧菌(Vibrio alginolyticus)肽聚糖,免疫24 h后感染WSSV,测定其免疫保护率和肝胰腺的免疫学指标,探讨溶藻弧菌肽聚糖对凡纳滨对虾抗WSSV的影响。结果表明:对虾的保护率随着肽聚糖的浓度增大而增大,与对照组相比,0.05、0.10、0.15 mg/mL组的保护率分别为36.67%、46.67%、56.67%;实验组凡纳滨对虾肝胰腺中的酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和一氧化氮合成酶(NOS)活力与对照组相比的差异有统计学意义(P < 0.01)。溶藻弧菌肽聚糖可有效增强凡纳滨对虾自身的非特殊性免疫能力,提高抗WSSV的能力。
肽聚糖;抑制作用;凡纳滨对虾;白斑综合症病毒;免疫指标
1993年,对虾养殖暴发了白斑综合征(WSS),对产业造成严重的损失[1-2]。随着对白斑综合征病毒(White Spot Syndrome Virus,WSSV)研究的深入以及相应措施的实施,WSSV发病率从90%降至5%,但至今仍无控制WSSV的有效手段。研究表明,中草药及其制剂[3-6]、葡聚糖[7]、黄芪多糖[8]和肽聚糖[9]可提高虾类机体自身免疫能力,有抗菌或抗病毒作用。肽聚糖作为一种免疫多糖,普遍存在于革兰阳性和阴性菌,可被肽聚糖识别蛋白等模式识别蛋白识别,激起机体的酚氧化酶原(proPO)等非特异性免疫系统,发生黑化作用和凝结作用[10]。郭玉娟等研究表明,注射A3α肽聚糖后可增强(Carassius auratus)免疫应答[11]和灭活嗜水气单胞菌(Aeromonas hydrophila)疫苗免疫效果[12],提高凡纳滨对虾(Litopenaeus vannamei)的成活率及产量[13]。陈国福等[9]指出,A3α肽聚糖可一定程度上提高凡纳滨对虾磷酸酶及酚氧化酶的活性。本研究从溶藻弧菌(Vibrio alginolyticus,革兰阴性菌)细胞壁中提取肽聚糖,并以3个质量浓度梯度(0.05、0.10、0.15 mg/mL)分别免疫凡纳滨对虾,研究肽聚糖对凡纳滨对虾抗WSSV及机体内免疫指标的影响,为肽聚糖提高机体免疫能力和抗病毒能力研究提供理论依据。
1 材料与方法
1.1材料
1.1.1肽聚糖提取参照刘春晓[14]方法,从溶藻弧菌中提取并纯化肽聚糖。称取所提取肽聚糖(纯度98.5%)0.05、0.10和0.15 g,溶入10 mL 平衡盐溶液(BSS缓冲液,组分:NaCl 18.0 g/L,KCl 0.7 g/L,NaHCO30.5 g/L,KH2PO40.54 g/L,调整pH至7.2),用超声波溶解,配成0.05、0.10和0.15 mg/mL的肽聚糖溶液。
1.1.2引物设计登陆NBCI搜索得到WSSV的vp28基因(GenBank:DQ681069)的全mRNA序列,用Premier 5软件设计上游引物为:5′ -GCGTCATGG ATCTTTCTTTCAC-3′ ,下游引物为:5′ -CACGAT TTATTTACTCGGTCTC-3′ ,引物由上海生工生物工程公司合成。
1.1.3实验用虾凡纳滨对虾(Litoprnaeus vannamei),体长(9.5±0.3)cm,体质量(11.0 ±0.6)g,取自湛江市东海岛东南庵里湛江腾飞实业有限公司对虾养殖场,经PCR检测,确认未携带白斑综合症病毒(WSSV),在1.0 m × 1.0 m × 0.8 m的水槽中暂养7 d,盐度为24,水温为28~32 ℃,每日投喂配合饲料3次,投喂量为对虾体质量的10%,连续充气,日换水量约为1/3。
1.1.4WSSV病毒粗提液原液由广东省水产经济动物病原生物学及流行病学重点实验室- 80 ℃超低温保存。
1.2方法
1.2.1WSSV提取取保存的WSSV原液,融化后由凡纳滨对虾第2、3腹节之间往心脏方向注射到体内。取症状明显的对虾,去除甲壳取鳃组织,放入Ependoff管中,按 1∶1(m∶V)加入高盐磷酸缓冲液PBS(230 mg/mL NaCl),置冰上匀浆。对匀浆液以4℃、7 000 r/min的条件离心15 min。吸取上清液,加入蔗糖至终质量分数为30%,以4 ℃、16 000 r/min的条件超速离心50 min。弃上层清液,沉淀用BSS缓冲液重悬,重悬液过孔径0.45 μm的滤膜,于- 80 ℃冰箱储存,备用。
取1 μL病毒粗提液作为PCR模板,反应体系(25 μL):10 × Ex Taq Buffer 2.5 μL,2.5 mmol/L dNTPs 各0.5 μL,10 μmol/L上、下游引物各1.0 μL,病毒粗提液1.0 μL,5 U/μL Ex Taq 0.2 μL,ddH2O 17.3 μL。反应条件:95 ℃ 5 min;94 ℃ 30 s,54 ℃45 s, 72 ℃ 1 min,30循环;72 ℃ 10 min。取10 µL PCR产物用10 mg/mL琼脂糖凝胶电泳检测病毒DNA片段大小。
1.2.2WSSV毒性检测实验设对照组(XS0)、实验组(XS1),每组设3个平行组,每个平行组放养凡纳滨对虾30尾。对照组每尾对虾肌肉注射100 μL的BSS缓冲液,实验组每尾肌肉注射同量1.2.1提取的WSSV粗提液。连续观察7 d,记录每天凡纳滨对虾死亡数量。取死亡凡纳滨对虾鳃,用PCR检测WSSV。
1.2.3WSSV最佳攻毒浓度的确定将1.2.1提取得到WSSV粗提液,用BSS缓冲液以10倍梯度稀释,配成10-2、10-3、10-4和10-5倍的WSSV粗提液。设XS2、XS3、XS4、XS5等4组,每组3个平行组,每平行组放养凡纳滨对虾30尾。采用肌肉注射法,每尾注射100 μL。XS2 - XS5组分别注射10-2- 10-5倍的WSSV粗提液。每日投喂配合饲料3次,连续充气,日换水量约为1/3,定时吸出排泄物,及时取出死亡对虾。连续观察7 d,记录每天凡纳滨对虾死亡尾数。
1.2.4不同浓度肽聚糖对凡纳滨对虾抗WSSV感染效果实验设5个组,分别记为PSA、PSB、PSC、PS、D组,每组设3个平行组,每个平行组放养凡纳滨对虾30尾。PSA、PSB、PSC组分别在凡纳滨对虾第3腹节注射质量浓度为0.05、0.10、0.15 mg/mL的肽聚糖,每尾注射0.1 mL;PS组为阴性对照组,每尾注射0.1 mL的BBS缓冲液。D为不做任何处理的空白对照组。于注射后0、6、12 h,1、2、3、4、5 d采集PSA、PSB、PSC、PS和D组的肝胰腺,每次取虾5尾,检测免疫指标。
于免疫后24 h,分别对PSA、PSB、PSC、PS、D组在同一地方注射10-4倍的WSSV粗提液0.1 mL。连续观察7 d,记录凡纳滨对虾死亡的情况,计算其免疫保护率。
1.2.5免疫指标测定肝胰腺粗酶液的提取与浓度测定:取肝胰腺称重,加入体积为肝胰脏质量5倍的0.05 mol/mL Tris-HCl缓冲液(pH 7. 4),超声波冰浴匀浆(工作时间5 s,间隔时间7 s,5次),匀浆液置于4 ℃冰箱中16 h,于0 ℃以下以12 000 r/min 离心15 min 取上清液,于-20 ℃保存,备用。使用南京建成的Bradford法蛋白检测试剂盒试剂盒参照说明书测定粗酶液浓度。
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活力测定参照南京建成的ACP和AKP活力测定试剂盒的说明书进行。超氧化物歧化酶(SOD)和一氧化氮合成酶(NOS)活力测定参照南京建成的测总SOD和测总NOS活力试剂盒的说明书进行。
ACP、AKP活力定义:每克组织蛋白在37 ℃下与基质作用15 min产生1 mg酚为1个金氏单位。
SOD活力定义:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
NOS活力定义:每毫克组织蛋白每分钟生成 1 nmol NO 定义为一个 NOS 活力单位。
1.2.6数据处理所得数据采用SPSS20.0进行单因素方差分析和Duncan多重分析比较,用Excel作图。
2 结 果
2.1WSSV提取、毒性检测及最佳攻毒浓度确定
攻毒试验后,经PCR电泳检测,死亡对虾的病毒粗提液扩增得大小为650 bp的片段,与WSSV原液扩增结果一致(图1),表明从死亡对虾提取的病毒粗提液为WSSV粗提液。

图1 白斑综合征病毒PCR鉴定结果Fig. 1 PCR identification of WSSV
毒性检测及最佳攻毒浓度实验结果如表1所示。

表1 WSSV粗提液稀释度对凡纳滨对虾死亡率的影响Table 1 Effects of concentration of WSSV crude extracts on mortality of Litopenaeus vannamei
表1可见,与对照组XS0相比,XS1组的凡纳滨对虾在注射100 μL病毒原液的24 h后,对虾出现大量死亡,2 d后全部死亡,说明重新提取的病毒粗提液对对虾致死率极高。
XS2和XS3组对虾1 d后开始出现死亡,2 d时死亡数最多,5 d内全死亡。7 d内,XS4组死亡率达90%,XS5组仅46.67%。一般情况下,取7 d内死亡率为90%左右的病毒浓度为实验攻毒浓度,因此,取稀释度10-4为最佳攻毒浓度,后继攻毒实验的病毒为稀释度为10-4的WSSV病毒粗提液。
2.2溶藻弧菌肽聚糖对凡纳滨对虾感染WSSV后存活率的影响
用稀释度10-4的病毒粗提液注射经不同质量浓度肽聚糖免疫的凡纳滨对虾,各组对虾存活率见表2。表2可见,PS组和D组对虾死亡率接近100%,PSA组的保护率为36.67%,PSB组为46.67%,PSC组为56.67%。表明肽聚糖对对虾的保护率随肽聚糖质量浓度的增加而增加。

表2 溶藻弧菌肽聚糖对凡纳滨对虾存活率的影响Table 2 Effects of VibrIo alginolyticus peptidoglycan on Litopenaeus vannamei survival
2.3溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺ACP和AKP活力的影响
用不同质量浓度肽聚糖免疫凡纳滨对虾,对虾肝胰腺ACP活力随实验时间的变化情况如图2所示。图2可见,PSA组肝胰腺ACP酶活力在48 h时达到最大值,与D、PS、PSB组差异有统计学意义(P < 0.05);PSB组肝胰腺ACP酶活力在24 h时达到最大值,与PSA、PSC组差异有统计学意义(P < 0.05),之后降至对照组水平,但在120 h时又有一个峰值;在12 h时,PSC组与D、PS、PSB、PSC组差异有统计学意义(P < 0.05),肝胰腺中ACP酶活力达到最大值,之后降低,120 h时升高,并接近最大值。
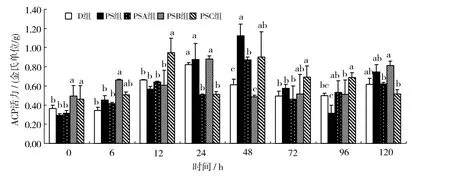
图2 溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺中ACP活力的影响Fig. 2 Effects of VibrIo alginolyticus peptidoglycan on the activity of ACP in the hepatopancreas of Litopenaeus vannamei
用不同质量浓度的肽聚糖免疫凡纳滨对虾,对虾肝胰腺AKP活力随实验时间的变化情况见图3。图3可见,在12 h时,PSB和PSC组的肝胰腺中AKP酶活力均达最大值,与D、PS组差异有统计学意义(P < 0.05),之后逐渐降至与对照组相近水平。PSA组的肝胰腺中AKP酶活力在24 h时达到最大值,与D、PS、PSB、PSC组差异有统计学意义(P < 0.05),在72 h时有另一峰值,与D、PS、 PSB组差异有统计学意义(P < 0.05),之后逐渐降低。
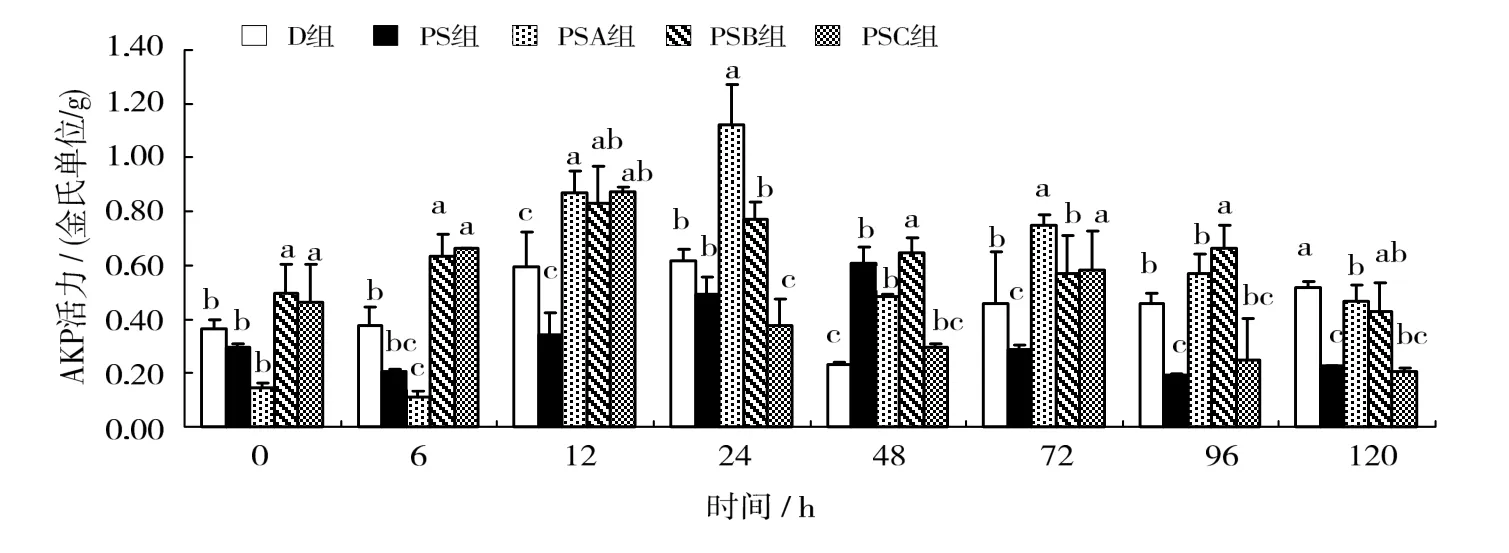
图3 溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺中AKP活力的影响Fig. 3 Effects of Vibrio alginolyticus peptidoglycan on the activity of AKP in the hepatopancreas of Litopenaeus vannamei
2.4 溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺SOD活力的影响
用不同质量浓度肽聚糖免疫凡纳滨对虾体,对虾肝胰腺SOD活力随实验时间的变化情况如图4所示。图4可见,PSA组在注射肽聚糖后,肝胰腺SOD活力逐步上升,在48 h时达最大值,并与D、PS、PSB组差异有统计学意义(P < 0.05),之后降低,但在120 h时又有一峰值,与D、PS、PSC组差异有统计学意义(P < 0.05)。PSB组的肝胰腺SOD活力分别在12 h时和72 h时达到一峰值,与D、PS、PSA组差异有统计学意义(P < 0.05),在此时间段内维持较高的SOD酶活力;PSC组的肝胰腺SOD活力在12 ~ 72 h时保持较高水平,之后逐渐降低。
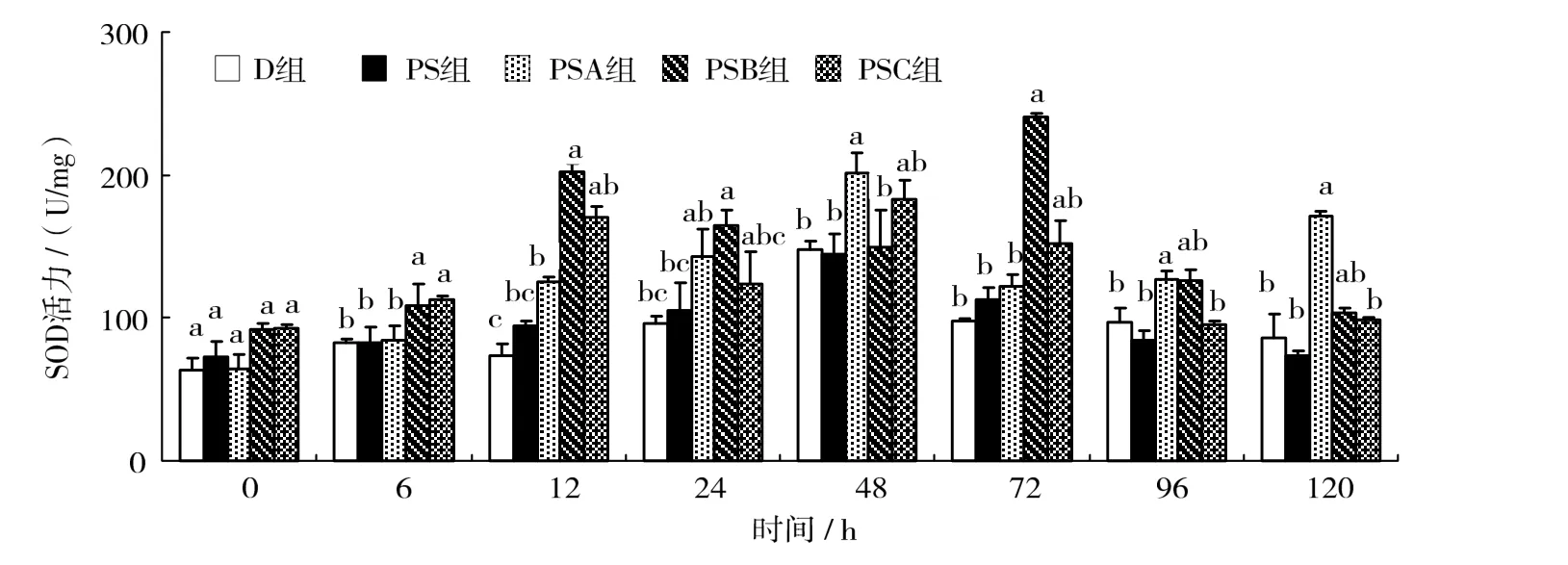
图4 溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺中SOD活力的影响Fig.4 Effects of Vibrio alginolyticus peptidoglycan on the activity of SOD in the hepatopancreas of Litopenaeus vannamei
2.5 溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺中NOS活力的影响
用不同质量浓度的肽聚糖免疫凡纳滨对虾,对虾肝胰腺中的NOS活力随实验时间的变化情况如图5所示。图5可见,PSA组在注射肽聚糖后,SOD活力逐步上升,在24 h时达最大值,并与D、PSB、PSC组差异有统计学意义(P < 0.05),之后降低,在72 h时有另一峰值,与PSB、PSC组差异有统计学意义(P < 0.05)。PSB组在12 h时达到最大值,与D、PS、PSA组差异有统计学意义(P < 0.05),之后逐渐降低,但在96 h时又有一峰值。PSC组在6 h时即达最大值,与D、PS、PSA、PSB组差异有统计学意义(P < 0.05),在12 ~ 48 h时降低,72 h时升高,之后降低,在120 h时又升高。
3 讨论与分析
3.1 溶藻弧菌肽聚糖对凡纳滨对虾抗WSSV的影响
实验开始前需验证-80 ℃保存WSSV病毒粗提液原液对对虾是否有致死效果。PCR检测结果显示阳性,证明死亡对虾是由于感染WSSV而死亡,同时确定后续实验的攻毒浓度为10-4倍稀释的WSSV粗提液。
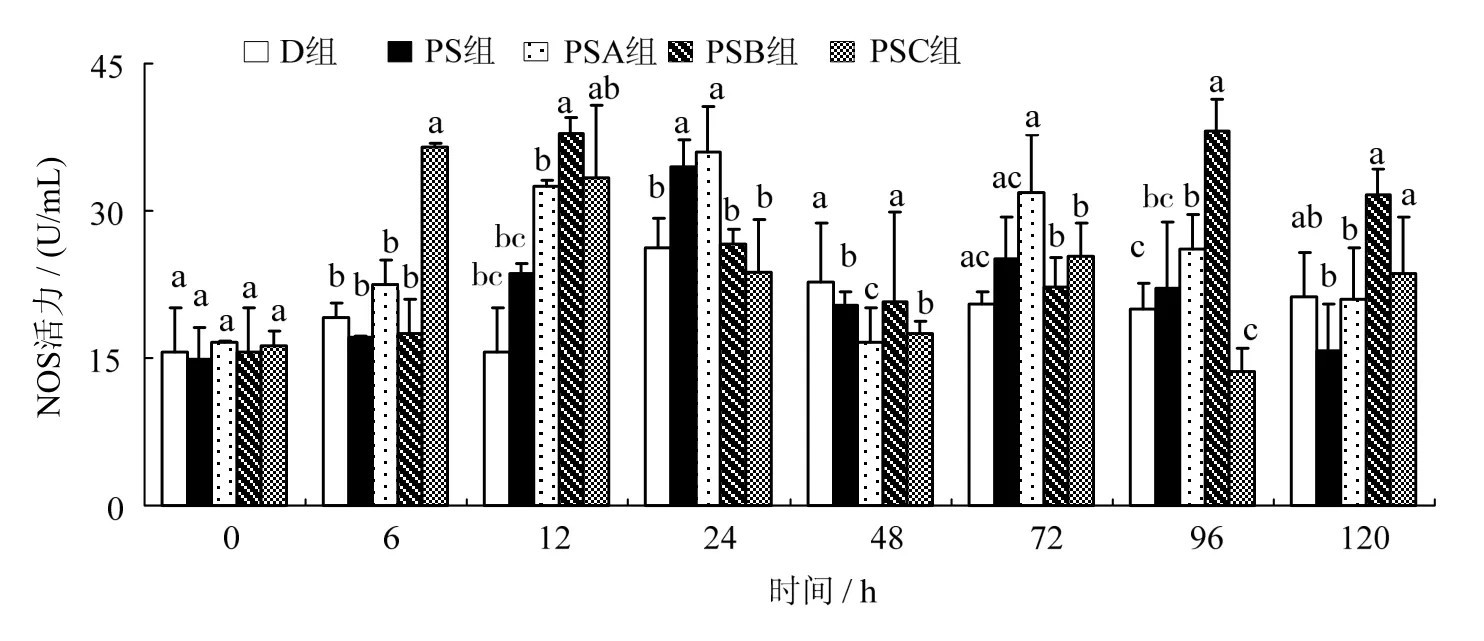
图5 溶藻弧菌肽聚糖对凡纳滨对虾肝胰腺中NOS活力的影响Fig. 5 Effects of Vibrio alginolyticus peptidoglycan on the activity of NOS in the hepatopancreas of Litopenaeus vannamei
有研究[15]提出,口服肽聚糖可增强凡纳滨对幼体抗WSSV感染能力。谢警鸿等[16]研究显示,注射一定浓度的溶藻弧菌肽聚糖,凡纳滨对虾可抵抗溶藻弧菌感染,并认为机体免疫力高低与肽聚糖添加量在一定范围内呈正比关系。本研究亦有类似结果,PSA组保护率为36.67%,PSB实验组为46.67%,PSC实验组为56.67%,说明凡纳滨对虾经过肽聚糖免疫后,随着肽聚糖质量浓度的增加,对虾因感染WSSV的死亡率逐渐降低,肽聚糖质量浓度在0.05 ~ 0.15 mg/mL时与保护率呈正比关系,进一步证实肽聚糖可增强对虾机体抗WSSV感染能力。
3.2肽聚糖对凡纳滨对虾肝胰腺中免疫指标的影响
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)是机体内溶酶体酶的主要组成成分,在机体内起直接杀菌作用,并调节细胞吞噬,催化含磷底物水解,参与含磷基团的代谢与转移,是机体重要的解毒体系。已有研究证明,ACP和AKP酶活性在不同组织中差异显著,尤其是肝脏中活性最高[17-18]。用多糖作为免疫增强剂,采用不同的刺激方式,凡纳滨对虾幼虾经A3α-肽聚糖免疫后,血清中ACP和AKP活力明显提高[19];从酵母细胞壁中提取免疫多糖,凡纳滨对虾注射用生理盐水配制的20 mg/mL的免疫多糖后,肝胰腺中的ACP和AKP活力明显提高[18]。本研究显示,凡纳滨对虾受肽聚糖免疫刺激后,肝胰腺的ACP和AKP活力显著提高,同时最大值出现时间随着注射肽聚糖浓度的增加而提前。这些研究均说明肽聚糖可增强对虾机体内免疫功能,进而增强抵抗外源病害的能力。
超氧化物歧化酶(SOD)可去除体内活性氧自由基,消减呼吸爆发中产生的高活性氧物质对细胞的毒性,防御机体的衰老以及生物分子的损伤。一氧化氮合成酶(NOS)作为生物效应信使分子,可抑制和杀灭细菌、病毒、寄生虫等。对虾体内NOS能催化L-精氨酸产生NO,抵御病原微生物侵入和调控免疫[20]。因此,把SOD和NOS酶活力作为体现对虾免疫状况的重要指标。研究指出,对虾在注射脂多糖(LPS)或肽聚糖(PG)后,血清中SOD或NOS酶活力显著提高[16,18],表明免疫增强剂LPS或PG可增强对虾机体免疫功能。本研究中,在不同质量浓度肽聚糖注射免疫刺激后,凡纳滨对虾肝胰腺SOD酶和NOS酶活力提高显著。PSB和PSC组的SOD酶活力均在12 h时达到最大值,说明肽聚糖注射浓度达一定值后对对虾的免疫效果几近相同;而NOS酶活力出现最大值时间大小依次是PSC、PSB、PSA,说明对虾受肽聚糖免疫后,NOS酶活力随肽聚糖注射浓度的增加,出现最大值时间提前。这为研究对虾肝胰腺中SOD和NOS酶活力有借鉴作用。
本研究显示,对虾在攻毒后 48 h出现大量死亡,死亡率 D 组为 60%,PS 组为 46.7%,而 PSA组为 30%,PSB 组为 26.7%,PSC组为23.3%;此时对虾肝胰腺中ACP、AKP、SOD、NOS的酶活力均高于对照组。之后的5 d内,对虾每天死亡数逐渐降低,这与对虾肝胰腺中NOS和SOD在12和72 h之间维持较高水平有关,即溶藻弧菌肽聚糖提高了机体免疫水平,增强了NOS、SOD活力,对病毒WSSV进入机体数量得到一定控制,说明当机体内的非特异性免疫因子活力明显提高时,可明显增强对虾抗病力。添加肽聚糖的饵料投喂日本对虾(Penaeus japonicus)后,对虾的成活率在 85%~100 %之间,均显著高于对照组的15%~30%[21],凡纳滨对虾经肽聚糖免疫后发病率为 0~40%,低于对照池(发病率80%~100%)[22],这些均证实了肽聚糖对对虾的免疫保护作用。本研究中,凡纳滨对虾受肽聚糖免疫刺激后,7 d内累积死亡率在43.3%~63%,与文献[21-22]基本吻合。肽聚糖不仅对对虾有免疫效果,对大黄鱼(Larimichthys crocea)[23]、刺参(Apostichopus japonicus)[24]、和花鲈(Lateolabrax japonicus)[25]亦有免疫保护作用,说明肽聚糖是一种有效的免疫增强剂,在水产养殖有广阔应用前景。
[1]ZHAN W B, WANG Y H,YU K K, et al. White spot syndrome virus infection of cultured shrimp in China[J]. J Aquat Anim Health, 1998, 10(4): 405-410.
[2]MOMOYANA K, NAKANO H, KOUBE H. Mass mortalities of cultured Kuruma shrimp, Penaeus japonicus, in Japan in 1993: epizootiological survey and infection trials[J]. Fish Pathology, 1994, 29(2): 135-139.
[3]国子娟. 基于细胞培养筛选抗对虾白斑综合征病毒(WSSV)中草药及其实验效果评价[D]. 上海: 上海海洋大学,2014.
[4]郭志勋,李卓佳,管淑玉. 抗对虾白斑综合症病毒(WSSV)中草药的筛选及番石榴叶水提取物对WSSV致病性的影响[J]. 广东农业科学,2011,38(21):129-131.
[5]郝忱,万金娟,沈美芳,等. 中草药添加剂对克氏原螯虾生长及免疫力的影响[J]. 江苏农业学报,2014, 30(2):363-369.
[6]杨明. 中草药制剂在凡纳滨对虾抗病性能中的应用研究[D]. 福建: 集美大学,2012.
[7]王新霞. 对虾免疫增强剂的研究与应用[D]. 山东:中国海洋大学,2004.
[8]洪徐鹏,陆宏达,张庆华,等. 黄芪多糖对克氏原螯虾抗白斑综合征病毒(WSSV)感染的效果研究[J]. 上海海洋大学学报,2014,23(3):423-428.
[9]陈国福,宋晓玲,黄倢,等. A3α-肽聚糖对凡纳滨对虾磷酸酶及细胞内酚氧化酶活性的影响[J]. 海洋水产研究,2007,28(1):59-64.
[10]梁虹,王安利,王维娜,等. 无脊椎动物模式识别蛋白研究进展[J]. 生理科学进展,2006,37(2):156-159
[11]郭玉娟,陈学年. A_(3α)肽聚糖对受免彭泽鲫免疫应答影响的研究[J]. 中国预防兽医学报,2006,28(5):562-565.
[12]郭玉娟,陈学年. A_(3α)肽聚糖增强灭活嗜水气单胞菌疫苗免疫效果的研究[J]. 淡水渔业,2005,35(6):3-6.
[13]郭玉娟,陈学年,杨先乐. A_(3α)肽聚糖投喂南美白对虾试验[J]. 淡水渔业,2003,33(4):35-37.
[14]刘春晓. 溶藻弧菌肽聚糖对凡纳滨对虾常用免疫指标、脂肪酸含量及基因表达差异的影响[D]. 广东:广东海洋大学,2014
[15]陈国福,宋晓玲,黄倢,等. A3α肽聚糖对凡纳滨对虾幼体生长及抗病毒感染力的影响[J]. 中国水产科学,2004,11(5):448-455.
[16]谢警鸿,邱德全,刘春晓,等. 溶藻弧菌肽聚糖对凡纳滨对虾虾青素、免疫指标及保护率的影响[J]. 广东海洋大学学报,2013,33(1):50-55.
[17]牟海津,江晓路,刘树青,等. 免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J]. 青岛海洋大学学报,1999,29(3):463-468.
[18]陈昌福,姚娟,陈萱,等. 免疫多糖对南美白对虾免疫相关酶的激活作用[J]. 华中农业大学学报,2004,23(5):551-554.
[19]陈国福,张春云,光玉,等. A3α肽聚糖对凡纳滨对虾幼体酸性磷酸酶和碱性磷酸酶活力的影响[J]. 水产科学,2008,27(11):584-587.
[20]朱宏友,余德光,王广军,等. 副溶血弧菌和脂多糖对凡纳滨对虾一氧化氮和一氧化氮合酶的影响[J]. 热带海洋学报,2006,25(1):27-32.
[21]ITAMI T, ASANO M, TOKUSHIGE K, et al. Enhancement of disease resistance of kuruma shrimp,Penaeus japonicus after oral administration of peptidoglican derived from Bifidobacterium thermophilum [J]. Aquaculture,1998,164(1/2/3/4):277-288.
[22]王秀华,黄倢,宋晓玲. 免疫增强剂—肽聚糖在对虾养殖中的应用[J]. 海洋水产究,2003,24(1):69-74.
[23]张春晓,麦康森,艾庆辉,等. 饲料中添加肽聚糖对大黄鱼生长和非特异性免疫力的影响[J]. 水产学报,2008,32(3):411-416.
[24]赵彦翠. 刺参多糖类免疫增强剂及微生态制剂的研究与应用[D]. 山东:中国海洋大学,2011.
[25]吴桂玲. 几种免疫增强剂对花鲈非特异性免疫力的影响及免疫疲劳初探[D]. 山东:中国海洋大学,2007.
(责任编辑:刘庆颖)
Antivirus Effects of Vibrio alginolyticus Peptidoglycan on Litopenaeus vannamei against White Spot Syndrome Virus
ZHU Wei-wei, QIU De-quan, GAN Zhen, LU Yi-shan, JIAN Ji-chang
(College of Fishery, Guangdong Ocean University // Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals // Key Laboratory of Control for Disease of Aquatic Animals of Guangdong Higher Education Institutes, Zhanjiang 524025, China)
White Spot Syndrome Virus (WSSV) was extracted from Litopenaeus vannamei suffering from White Spot Syndrom, and WSSV toxicity was confirmed by PCR. The virus crude extract was diluted 10-2, 10-3, 10-4and 10-5times, respectively, and the best attack dose of 10-4fold dilution was ascertained after challenge with WSSV. Peptidoglycan at the concentration of 0.05, 0.10 and 0.15 mg/mL was injected into L. vannamei, respectively. 24 hours later, WSSV were injected into shrimps, and the immune protection rate and the immunological indexes in hepatopancreas were measured to investigate the influence of Vibrio alginolyticus peptidoglycan in shrimps against WSSV. The results showed that the immune protection rate increased with the increase of peptidoglycan concentration, and they reached 36.67%, 46.67% and 56.67%, respectively, compared with the control group. The activities of acid phosphatase (ACP), alkaline phosphatase (AKP), superoxide dismutase (SOD) and nitrogen monoxide synthetic enzyme (NOS) in hepatopancreas had statistical differences from the control (P < 0.05). The V. alginolyticus peptidoglycan could effectively enhance the L. vannamei non-specific immunity and promise approaches to protect the shrimp from WSSV infection.
peptidoglycan; Litopenaeus vannamei; white spots syndrome virus; immune index
S941.41
A
1673-9159(2015)06-0040-07
10.3969/j.issn.1673-9159.2015.06.008
2015-06-29
广东省海洋渔业科技推广专项项目(A201100D03),广东省海洋经济创新发展区域示范专项项目(GD2012-A03-012),湛江市科技计划项目(2013A03021)
朱卫卫(1986-),男,硕士研究生,研究方向为水产经济动物免疫与病害控制。E-mail:zhuweiwei320@163.com
邱德全,男,教授,研究方向为水产经济动物免疫与病害控制。E-mail:qmsld@163.com

