附着生物对流沙湾喜盐草光合强度的影响
李英子,黄翔鹄,朱雪冰,汪锦涛,董帅领
(广东海洋大学水产学院,广东 湛江 524088)
附着生物对流沙湾喜盐草光合强度的影响
李英子,黄翔鹄,朱雪冰,汪锦涛,董帅领
(广东海洋大学水产学院,广东 湛江 524088)
从2014年10月至2015年7月,对广东流沙湾海草床3个海岸带(远岸带A、中海岸带B及近岸带C)中的喜盐草(Halophila valios)进行了季节性调查,研究喜盐草上附着生物的现存量、叶绿素a含量的季节变化及其对喜盐草的光合速率的影响。结果发现,附着生物的现存量及叶绿素a含量存在明显的季节性,其变化依次为春季﹥冬季﹥夏季﹥秋季,春季达到最高峰,两者含量分别为0.605 mg/g和0.118 mg/g,且在近岸带附着生物的含量要略高于中海岸带和远岸带。附着生物对喜盐草的光合速率存在着明显的抑制效应,并随含量的增加,其抑制作用增强。在春季,最大光合抑制率可达50.72%,冬、夏季次之,分别为47.13%和37.15%,在附着生物含量最低的秋季,抑制率也可达30.61%。由此表明,水体中营养盐浓度的增加会促使喜盐草上附着生物不断生长和累积,进而导致喜盐草的衰亡加速。
海草床;附着生物;喜盐草;光合速率
海草床是继红树林和珊瑚礁以外的又一个重要的海洋生态系统,它是许多大型海洋生物甚至哺乳动物赖以生存的栖息地,在生态学上具有重要的意义。尽管海草床占据海洋总面积的比例不是很大,但具有较高的生物量和极高的初级生产力[1-2]。世界上已发现的海草共有7科13属,约70余种[3-4],其中水鳖科(Hydroeharitaceae)下的喜盐草属(Halophila)的物种数是最多的,高达17种之多[5]。
近年来,随着全球环境的变化以及人类开发活动的过度和无序,海洋水体富营养化程度不断加剧,海草床已经出现了世界范围内大面积的衰退,甚至是消失[6-8]。虽然世界各国相继开展了一系列关于海草床修复技术的探究并取得了一定的成果,但其恢复与重建的效果仍不理想,海草床衰退机理也不是很明确。国内外许多学者从水体富营养化导致其浊度、透光度、营养盐浓度以及附着生物密度等几个方面的改变来探讨沉水植物衰退的机制,但是关于附着生物对沉水植物影响的研究报道仍然很少[9-12]。近年来,越来越多国外学者将研究重点放在关于附着生物对沉水植物影响的研究上[13]。有研究表明,附着藻类的附着会导致海草可利用光能明显下降,进而影响海草的生长[14-15]。Borum[16]的研究发现,覆盖在海草叶片表面上的附着藻类不仅会与海草在营养物质的利用上形成竞争关系,还会抑制海草对碳的摄取,并且降低水体溶解氧含量,导致氧气供给受到限制,不利于海草的生长。但是,迄今为止国内外关于附着生物对海草生长影响的研究报道极少。
本研究对象喜盐草(Halophila ovalis)隶属沼生目(Helpobiae)水鳖科(Hydroeharitaeeae)喜盐草属(Halophila),为多年生亚热带海草物种,在我国主要分布于广东、广西、海南和香港等省区海域[17-18]。其中,广东湛江流沙湾沿海的喜盐草海草床是我国第一大海草床,面积约为900 ha[3]。有调查研究表明,从20世纪90年代开始流沙湾当地人们开始大范围地开挖虾池,直接毁坏海草床,且由于其养虾业以及其他养殖业的不断发展,海域水体富营养化程度愈来愈严重,喜盐草海草床内出现了严重的衰退现象,有部分区域几乎全部消失[19]。因此本文以选取流沙湾海草床优势种—喜盐草作为实验研究对象,主要研究不同季节喜盐草附着生物现存量、叶绿素a含量的变化及其对喜盐草光合速率的抑制效应,以期为海草床的修复与重建提供一些科学依据与指导。
1 材料与方法
1.1实验海水、仪器与药品
海水取自流沙湾海域的原位海水,经What man GF/C(0.45μm)微孔滤膜过滤后充分曝气,备用。仪器有GPS eTrex301定位仪,抽滤器,玻璃采水器,恒温干燥箱,MA型电子分析天平,比色管,UV-2450紫外-可见光光度计,碱式滴定管等。药品主要有氯化锰,碘化钾,硫代硫酸钠,可溶性淀粉,浓硫酸,80%丙酮,氢氧化钠,碳酸钠,冰醋酸。
图1 流沙湾海草床采样点的地理位置Fig.1 Sampling site in Liusha Bay
1.2样点布设
根据《海草床生态监测技术规程》(HY/T083-2005)调查方法,(如图1),在流沙湾海草床(20°26.1′N,109°57.1′E,)分布区选出最具代表性地段,沿与海岸线垂直方向设置3个断面,每个断面分为近岸带(C)、中海岸带(B)、远岸带(A)3个海岸带,相邻海岸带间距约为200 m,每个海岸带选取有代表性的3个点,共9个,分别编号为近岸带(C1、C2、C3),中海岸带(B1、B2、B3)和远岸带(A1、A2、A3),各站点采用GARMIN公司生产的GPS eTrex301进行定位。
1.3样品的采集与处理
分别于2014年10月,2015年1、4、7月,在9个站点采集喜盐草和水样。将样品装入塑料瓶中带回处理,并采集原位海水各1 L,作为初级生产力以及光合速率测定中的试验用水。采集的喜盐草其中一部分用作附着藻类的分离,另一部分用作光合速率的测定。用软毛刷子轻轻地刷洗叶片表面来分离附着生物,然后将刷洗液以及冲洗刷子的液体一同搜集并定容,备用。
1.4附着生物现存量的测定[20]
附着生物生物量的大小用附着在植物表面的有机物的量来表示。取250 mL的刷洗液(不含浮泥),通过What man GF/C(0.45μm)微孔滤膜过滤,将带有残留物的滤膜在105 ℃下烘干至恒重后,在550 ℃灼烧6 h后称重并记录,3次重复。
1.5附着生物叶绿素a含量测定[21]
所有藻类都含有叶绿素a,故可通过测定附着生物中叶绿素a的含量来表征附着藻类生物量的大小[21]。取适量备用液,用What man GF/C(0.45μ m)微孔滤膜过滤,将带有附着生物的滤膜置于冰箱中冷冻48 h后,取出放入研钵中,加入6~8 mL 80%的丙酮溶液,研磨成糊状后转移至10 mL离心管中,于7 000 r/min 4℃低温离心20 min,取上清液,定容10 mL,用UV-2450紫外-可见光光度计测定。
1.6喜盐草的光合速率的测定[22]
通过测定光合作用过程中产生的氧的含量作为衡量光合速率的指标。选取有活力、生长基本一致的新鲜海草枝端,一部分直接放入250 mL黑、白培养瓶中;另一部分样品经刷洗去除表面附着生物后再分别放入250 mL黑、白培养瓶中。于光照培养箱中培养6 h,培养温度与原位点一致。用碘量法[23]测定培养前后的溶解氧含量。
1.7数据处理与分析
采用Excel 2007和SPSS 17.0分析软件进行试验数据的处理和统计学分析。用单因素方差(one way ANOVA)来检验差异的显著性水平,检验处理组的差异显著性水平设为P < 0.05,并利用LSD方法比较各个处理组间的差异。使用Origin 8.0软件进行试验结果图形的绘制。相关计算公式为
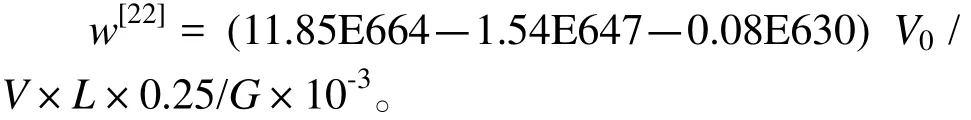
式中,w:叶绿素a含量(mg/g);V0:样品提取液体积(mL);V:海水样品实际用量(mL);L:比色皿光程(cm);G:叶片鲜样质量(g)。
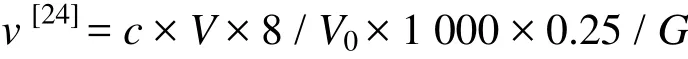
式中,v:光合速率(mg/g);c:硫代硫酸钠溶液浓度(mol/L);V:滴定用硫代硫酸钠体积(mL);V0:实际水样体积(mL);G:叶片鲜样质量(g)。
光合抑制率=(无附着组光合速率-有附着组光合速率)/无附着组光合速率×100%。
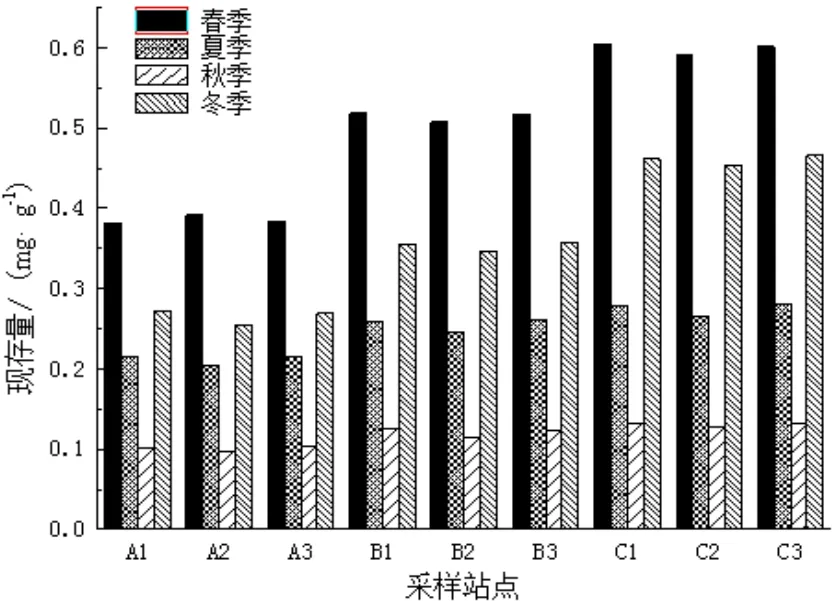
图2 附着生物现存量季节性变化Fig.2 The seasonal variation of epiphyte biomass
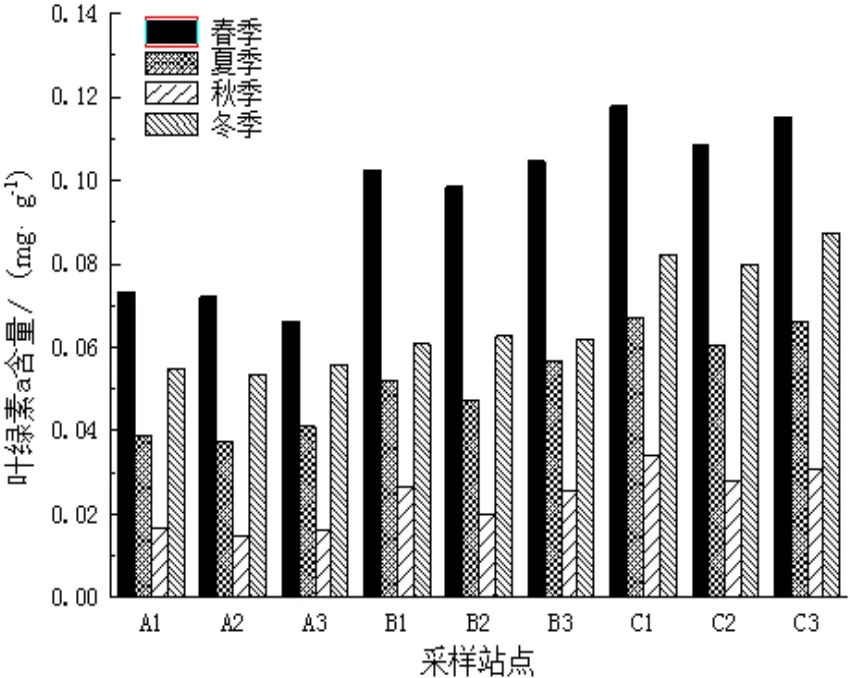
图3 叶绿素a含量的季节性变化Fig.3 The seasonal variation of chlorophyll a content
2 结 果
2.1附着生物现存量及叶绿素a含量的季节性变化
流沙湾海域各个站点喜盐草叶片上附着生物现存量以及叶绿素a含量指标如图2和3所示。由图中可见,现存量及叶绿素a含量均存在明显的季节性变化,秋季含量达最小值,此时两者含量分别为0.098 mg/g和0.015 mg/g,冬季和夏季次之,春季含量到最高峰,分别为0.605 mg/g和0.118 mg/g,此时叶绿素a含量约为秋季的6倍之多。在各个不同的海岸带之间,现存量和叶绿素a含量也存在着一定的差异,含量变化从大到小依次是近岸带﹥中海岸带﹥远岸带。
2.2附着生物对喜盐草的光合速率的影响
附着生物对喜盐草的光合速率影响的实验结果如图4~8所示。由图中可知,有附着组与无附着组喜盐草的光合速率差异显著(P < 0.05),即附着生物对喜盐草的光合速率存在明显的抑制作用,且其抑制效应随着采样站点不同以及季节的变化呈现出一定的差异。
由图4可见,在冬季,有附着组的光合速率变化范围为0.214~0.333 mg/(g•h),均值为0.270 mg/(g•h);无附着组的光合速率在0.401~0.502 mg/(g•h)之间变化,均值达0.450 mg/(g•h)。无附着组的光合速率比有附着组增大了0.6倍。
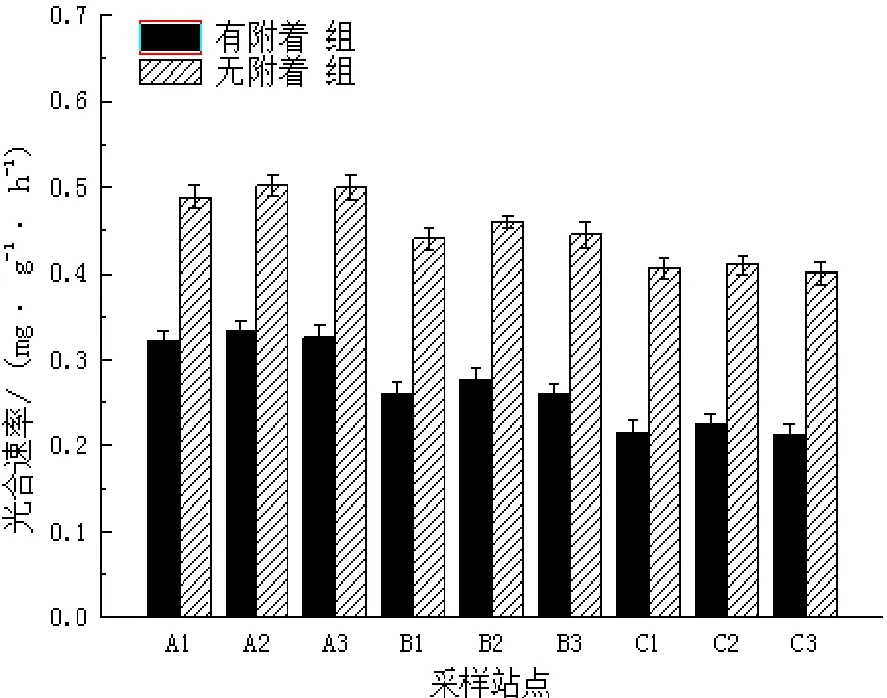
图4 冬季不同站点喜盐草的光合速率Fig.4 The photosynthesis rate of Halophila ovalis in winter at different sites
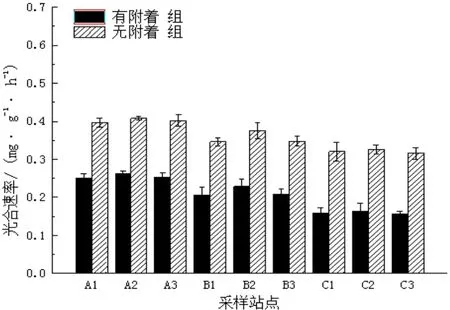
图5 春季不同站点喜盐草的光合速率Fig.5 The photosynthesis rate of Halophila ovalis in spring at different sites
由图5可见,在春季,有附着组的光合速率变化范围为0.157~0.262 mg/(g•h),均值为0.210 mg/(g•h);无附着组的光合作用速在0.316~0.397 mg/(g•h)的范围内变化,均值为0.360 mg/(g•h)。无附着组比有附着组的光合速率增大了0.7倍。但是与冬季相比,两者的光合速率都有所下降。
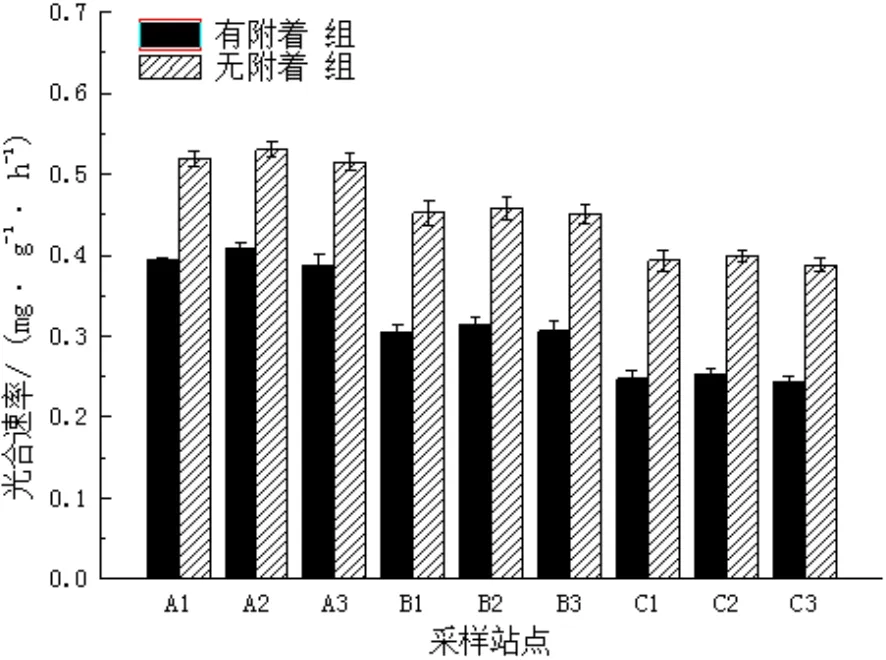
图6 夏季不同站点喜盐草的光合速率Fig.6 The photosynthesis rate of Halophila ovalis in summer at different sites
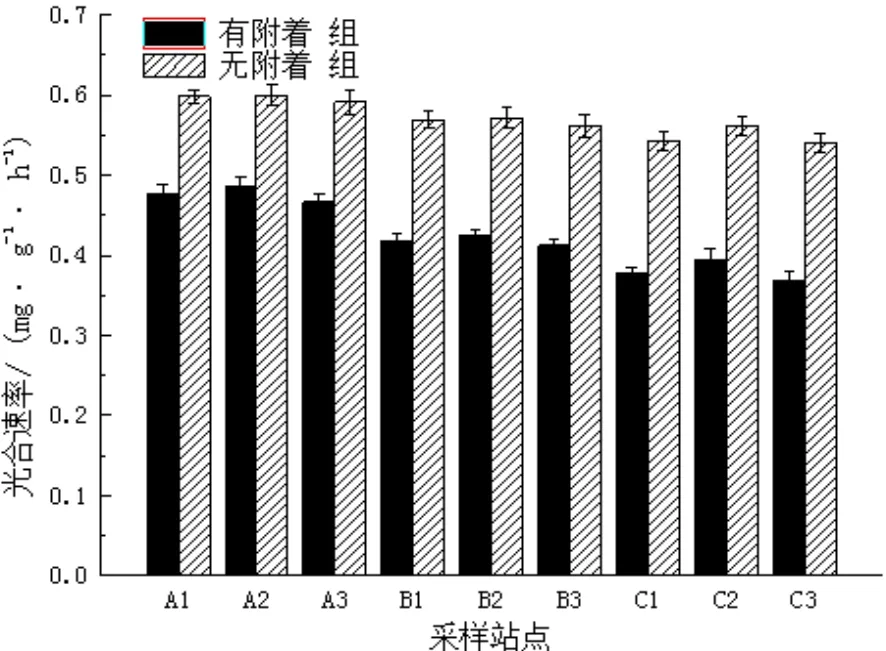
图7 秋季不同站点喜盐草的光合速率Fig.7 The photosynthesis rate of Halophila ovalis in autumn at different sites
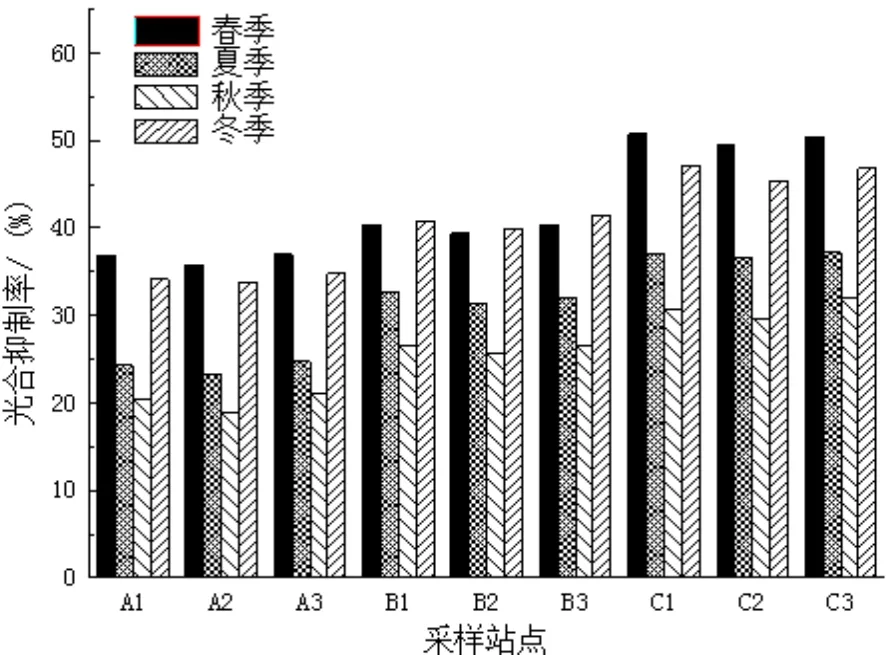
图8 附着生物对喜盐草的光合抑制率(秋季)Fig.8 The inhibition rate of epiphyte on the photosynthesis rate of H. ovalis (winter)
从图6可见,在夏季,有附着组的光合速率范围为0.244~0.407 mg/(g•h),均值达0.317 mg/(g•h);无附着组的变化范围为0.388~0.530 mg/(g•h),均值为0.456 mg/(g•h)。无附着组比有附着组的光合速率增大了0.4倍,两个处理组的整体的光合速率相比冬季和春季都明显增大了。
从图7可见,在秋季,有附着组的光合速率范围为0.368 ~ 0.486 mg/(g•h),均值为0.425 mg/(g•h);无附着组为0.540 ~ 0.599 mg/(g•h),均值为0.570 mg/(g•h)。无附着组比有附着组的光合速率增大了0.3倍。两个处理组的光合速率在4个季节中均达到最大值,且明显高于冬季和春季。
2.3光合抑制率的季节性变化情况
由图8所示,附着生物对喜盐草的光合速率的抑制效应在各个不同季节呈现出一定的变化,春季附着生物对喜盐草的光合抑制率达到最大值,为50.72%。冬季和夏季次之,其光合抑制率分别为47.13%和37.15%,秋季附着生物对喜盐草的光合抑制率最低,此时为30.61%。在4个不同季节中,3个不同海岸带附着生物对喜盐草的光合抑制率的变化趋势一致,均表现为近岸带最高,中海岸带次之,远岸带达最低值。
2.4附着生物现存量及叶绿素a含量与光合抑制率的相关性分析
图9和图10 所示为附着生物现存量与附着生物叶绿素a含量及其对喜盐草的光合速率抑制率的相关性分析。由图中可见,附着生物现存量以及叶绿素a含量与光合速率抑制率均呈显著正相关。
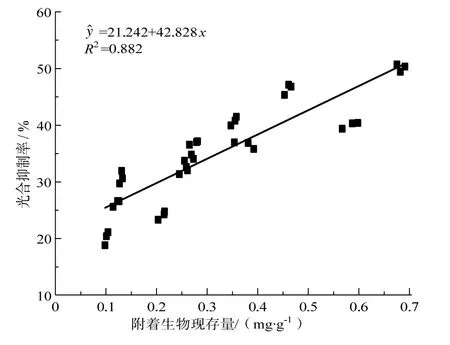
图9 附着生物现存量与光合抑制率的相关性Fig.9 The correlation coefficient between the epiphyte biomass and inhibition rate of photosynthesis
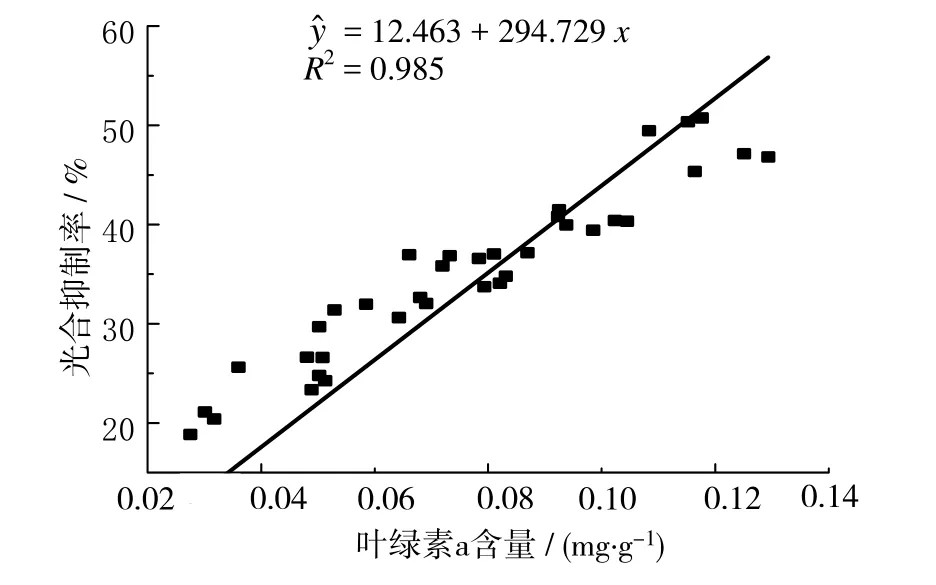
图10 叶绿素a含量与光合抑制率的相关性Fig.10 The correlation coefficient between chlorophyll a content and inhibition rate of photosynthesis
3 讨 论
3.1附着生物现存量及叶绿素a含量变化
在水域生态系统中,沉水植物以及其他浸没在水中的介质上常常会有以藻类为主的有机体覆盖在表面,我们将其统称为附着生物,许多文章中也称其为着生生物、周从生物或者附生生物等。附着生物(epiphytes)主要由附着植物和附着动物组成,而大部分情况下,附着植物一般是指附着在其他生物体表面的附着藻类(perphytic algae),它们在水生附生群落中扮演着重要的角色[24-25]。通常把以水生沉水植物作为附着基质的附生生物统称为附着生物或植物体附着生物,而这种情况在大中型浅水湖泊中的大型沉水植物叶片表面是十分常见的,除此之外,此类叶附生现象在滨海生态系统的海草床中也是普遍存在的[26]。
附着生物生物量的多少受很多因素的影响,包括生物因素和非生物因素。其中生物因素主要包括附着介质植物体本身结构、叶片更新速率以及形态等的差异,以及周围食草动物的摄食作用等;非生物因素有水体温度、盐度、水体流速以及营养盐浓度等[27]。有研究发现,大叶藻(Zostera marina)和泰来藻(Thalassia hemperichii)叶片末端的附着藻类生物量要比新生部位的高出很多[28-29]。另外,从植株叶片两面的受光情况分析,波喜荡草的向光面的附着生物含量要明显高于背光面[30]。而廖祖荷[31]调查结果表明,影响植物体表面附着生物的生物量的重要因素之一是水体的营养盐水平,即在营养盐浓度较高的区域,附着生物的生物量要比营养盐浓度较低的区域高。
研究结果发现,喜盐草附着藻类主要以硅藻为主,其优势种在不同的季节有所不同,夏季和秋季主要是盾卵形藻,冬季为楔形藻,春季为海洋斑条藻。从附着生物含量变化来看,附着生物的现存量及叶绿素a含量存在明显的季节性变化,春季含量达到峰值,冬、夏季次之,秋季含量最低;在不同海岸带间,附着生物的现存量以及叶绿素a含量也存在明显差异,近岸带相比中海岸带和远岸带来说要高。曾圆圆[32]对流沙湾海草床水体中氮磷营养盐含量进行的周年调查发现,水体营养盐含量的变化趋势与本研究中附着生物的季节性变化相一致。因此,笔者认为水体营养盐含量的高低会直接影响附着生物的生物量,营养盐含量越高,附着生物含量越高,反之则越低。
3.2附着生物对喜盐草光合作用的影响
海草表面所覆盖的附着生物不仅仅会减弱植物体所能获得的有效光辐射,从而抑制植物的光合速率[33],而且还会增大营养物质在水体与植物体之间传递的阻力,并且与植物形成营养方面的竞争,从而影响植物体的生长[34]。除此之外,附着生物中的附着藻类可以通过营养物质的转化、代谢产物的释放等来改变水环境,有些附着藻类甚至会释放藻毒素,使得水生生物的生存受到威胁[35]。Comelisen等[36]通过同位素标记实验发现,附着生物的附着会导致龟裂泰来藻(Thalassia testudinum)对含氮营养盐的摄取效率。Cebrián 等[37]发现,茎生波喜荡草(Posidonia oceanica)上附着生物的生物量为2.6 mg/cm2时,植物叶片表面能够获得的有效光能下降了约30%之多,光合速率明显受到抑制。
本研究结果表明,附着生物对喜盐草的光合速率存在明显的抑制效应,喜盐草刷洗前后的光合速率存在显著差异(P <0.05),刷洗前的光合速率明显低于刷洗后的光合速率。并且附着生物现存量及叶绿素a含量的季节性变化趋势与光合速率的抑制率完全一致,且从相关性分析的结果来看,现存量及叶绿素a含量与光合抑制率之间均呈显著正相关,说明附着生物对喜盐草的光合抑制效应会随附着生物生物量的增加而显著增强。这与宋玉芝等[23]对沉水植物伊乐藻的研究结果相一致。
综上所述,水体富营养化引起附着生物大量繁殖所造成的喜盐草的光合速率受到抑制是导致喜盐草海草床衰退发生的主要原因之一。
[1]李文涛,张秀梅. 海草场的生态学功能[J]. 中国海洋大学学报(自然科学版),2009,39(5):933-939.
[2]DUARTE C M, CHISCANO C L. Seagrass biomass and production: a reassessment [J]. Aquatic Bot,1999, 65 (1/2/3/4): 159-174.
[3]DEN HARTOG C, KUO J. Taxonomy and Biogeography of Seagrasses // Taxonomy and biogeography of seagrasses [M]. Western Australia: Springer Netherlands, 2006: 1-23.
[4]SHORT F, CARRUTHERS T, DENNISON W, et al. Global seagrass distribution and diversity: a bioregional model [J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1): 3-20.
[5]SHORT F T, POLIDORO B, LIVINGSTONE S R, et al. Extinction risk assessment of the world’s seagrass species [J]. Biological Conservation, 2011, 144(7): 1961-1971.
[6]PARK J I, LEE K S. Site-specific success of three transplanting methods and the effect [J]. Aquatic Bot,2007,15(24): 1-11.
[7]MARTIN I, NOTO J M, FONTES M G, et al. Seasonal variation in short-term survival of Zostera noltii transplants in a declining meadow in Portugal [J]. Aquatic Bot, 2005,82: 132-142.
[8]NICHOLLS R J, SMALL C. Improved estimates of coastal population and exposure to hazards released [J]. Earth Observation System,2002,83(28): 301-302.
[9]王华,逢勇,刘申宝,等. 沉水植物生长影响因子研究进展[J]. 生态学报,2008,28(8):3958-3968.
[10]FELDMANN T, NOGES P. Factors controlling macrophyte distribution in large shallow Lake Vrtsjarv [J]. Aquatic Botany,2007,87(1):15-21.
[11]KUN S L, SANG R P, YOUNG K K. Effects of irradiance, temperature, and nutrients on growth dynamics of seagrasses: a review[J]. Journal of Experimental Marine Biology and Ecology,2007,350:144-175.
[12]LIBORIUSSEN L. Production, regulation and ecophysiology of periphyton in shallow freshwater lakes [D]. Roskilde, Denmark: National environmental research institute,2003.
[13]LAUGASTE R, LESSOK K. Planktonic algae and epiphyton of the littoral in lake Peipsi, Estoniaf [J]. Limnologica ecology and management of inland waters,2004,34(l/2):90-97.
[14]SILBERSTEIN K, CHIFfiNGS A W, MCCOMBN A J. Western australia III. The effect of epiphytes on productivity of posidonia australis hook [J]. Aquatic Bot,1986,24: 355-371.
[15]SAND-JENSEN K. Effects of epiphytes on eelgrass photosynthesis[J]. Aquatic Bot, 1977,3 : 55-63.
[16]BORUM J. Dynamics of epiphyton on eelgrass (Zostera marina L) leaves: relative roles of algal growth, herbivory and substratum turnover [J]. Limnol Oceanogr,1987,32 : 986-992.
[17]黄小平,江志坚,张景平,等. 广东沿海新发现的海草床[J]. 热带海洋学报,2010, 29(1):132-135.
[18]SHI Y H Q, FAN X J, CUI L H, et al. Overview on seagrass and related research in China [J]. ChineseJournal of Oceanology and Limnology, 2010, 28 (2): 329-339.
[19]HUANG X P, HUANG L M. Seagrass beds investigations in South China Sea, China[M]. Guangzhou: Guangdong Economy Press,2007: 27-29.
[20]秦伯强,宋玉之,高光. 附着生物在浅水富营养化湖泊藻-草型生态系统转化过程中的作用[J]. 中国科学C辑:生命科学,2006,36(3):283-288.
[21]赵文. 水生生物学[M]. 北京:中国农业出版社,2008:507-509.
[22]宋玉之,秦伯强,高光. 附着生物对沉水植物伊乐藻生长的影响研究[J]. 生态环境,2007,16(6):1643-1647.
[23中国国家标准化管理委员会. 海水化学要素调:第4部分非数资料:GB17378.4–2007[S]. 北京:中国标准出版社,2007:13-14.
[24]ALLANSON B R. The fine structure of the periphyton of Chara sp and Potamogeton natans from wytham pond, oxford, and its significance to the macrophyteperiphyton metabolic model of R G Wetzel and H L Allen [J]. Freshwater biology,1973,3(6):535-542.
[25]BRONMARK C. Interactions between epiphytes, macrophytes and freshwater snails: a review [J]. Journal of Molluscan Studies,1989,55(2):299-311.
[26]张景平,黄小平. 海草与其附着藻类之间的相互作用[J]. 生态学杂志,2008,27(10):1785-1790.
[27]张景平,黄小平. 海草附生藻类生物量的主要影响因子[J]. 生态学报,2009,29(10):5611-5617.
[28]HEIJS F M L. The seasonal distribution and community structure of the epiphytic algae on Thalassia hemperichii (Ehrenb) [J]. Aquatic botany,1985,21:295-324.
[29]DRAKE L A, DOBBS F S, ZIMMERMAN R C. Effects of epiphyte load on optical properties and photosynthetic potential of seagrass Thalassia hemperichii and Zostera marina L[J]. American society of limnology and oceanography,2003,48(2):456-463.
[30]TRAUMAN D A,BOROWITZKA M A. The distribution of the epiphytic organisms on Posidonia australis and P. sinuosa,two seagrasses with differing leaf morphology [J]. Marine ecology progress series,1999,179:215-229.
[31]廖祖荷, 顾泳洁. 苏河州水质与着生生物群落的生态学变化关系的研究[J]. 贵州大学学报(自然科学版), 2003, 20(2):196-199.
[32]曾圆圆. 流沙湾喜盐草的生长和生理生化特征的研究[D]. 湛江:广东海洋大学,2015.
[33]MOHAMED Z A, SHEHRI A M A. Microcystin production in epiphytic cyanobacteria on submerged macrophytes [J]. Toxicon,2010,55(7):1346-1352.
[34]IRLAND E A, ORLANDO B A, BIBER PD. Driftalgae-epiphyte-seagrass interactions in a subtropical Thalassia testudinum meadow[J]. Marine ecology progress series,2004,279:81-91.
[35]MACLEOD N A, BARTON D R. Effects of light intensity, water velocity and species composition on carbon and nitrogen stable isotope ratios in periphyton [J]. Canadian journal of fisheries and aquatic science,1998,55(8):1919-1925.
[36]COMELISEN C D, THOMAS F M. Ammonium and nitrate uptake by leaves of the seagrass thalassia testudinum: impact of hydrodynamic regime and epiphyte cover on uptake rates [J]. Journal of marine systems,2004,49:177-194.
[37]CEBRIÁN J, ENRÍQUE Z,FORTES M, et al. Epiphyte accrual on Posidonia oceanic (L) delile leaves implications for light absorption [J]. Botanica marina,1999,42:123-128.
(责任编辑:任万森)
Effects of Epiphyte on Photosynthesis Metabolism Intensity of Halophila ovalis in Liusha Bay
LI Ying-zi, HUANG Xiang-hu, ZHU Xue-bing, WANG Jin-tao, DONG Shuai-ling
(Fisheries College of Guangdong Ocean University,Zhanjiang 524088,China)
In order to study the inhibition effects of epiphyte on photosynthesis rate of the plant and the seasonal variation in epiphyte biomass and content of Chlorophyll-a, samples from three different coastal zones (far-shore zone, in term of A and middle-shore zone, in term of B and near-shore zone, in term of C) in Liusha Bay in Guangdong from October 2014 to July 2015 are collected. The results showed that there was a prominent seasonal variability of the epiphyte biomass and Chlorophyll-a. The amount of epiphyte biomass and Chlorophyll-a descended seasonally in the following sequence: Spring winter, summer and autumn, with the maxim amount of epiphyte biomass, 0.605 mg/g, and Chlorophyll-a, 0.118 mg/g, in spring, and the minimal amount of epiphyte biomass and Chlorophyll-a in autumn. In addition, the amount of epiphyte biomass at C was slightly higher than that at B and A. And the photosynthesis efficiency of Halophila ovalis was significantly inhibited by the epiphyte, and the maximum inhibition rate was up to 50.34% in spring, followed by winter and summer with inhibition rates of 47.13% and 37.15% respectively. However, with a low epiphyte biomass in autumn, the photosynthesis rate of Halophila ovalis was 30.61%. Researches show that the epiphyte biomass can grow and accumulate continuously with the increase of nutrient concentration in water, and in turn accelerate the death of Halophila ovalis.
seagrass bed; epiphyte; Halophila ovalis; photosynthesis rate
Q143+.1
A
1673-9159(2015)06-0070-07
10.3969/j.issn.1673-9159.2015.06.013
2015-09-18
广东省科技计划项目(2013B051000081)
李英子(1990-),女,硕士研究生,主要从事海洋生物学专业。
黄翔鹄, 男, 教授,从事水域生态研究。E-mail:hxh166@126.com

