补肾疏肝方对肺腺癌A549细胞的凋亡作用及其机制研究
苗学红,王淑玲
补肾疏肝方对肺腺癌A549细胞的凋亡作用及其机制研究
苗学红,王淑玲
目的探讨补肾疏肝方对肺腺癌A549细胞的凋亡作用,对肿瘤坏死因子(TNF)-α分泌、Survivin及半胱氨酸天冬氨酸蛋白酶(Caspase)-3 mRNA表达的影响。方法将补肾疏肝方制成低剂量(1.25 g/ml)、中剂量(2.50 g/m l)和高剂量(3.75 g/ml)药液。以随机数字表法将大鼠分为对照组、低剂量组、中剂量组、高剂量组、顺铂(DDP)组、联合组(中剂量药液联合DDP),每组10只。对照组于第1~5天给予0.9%氯化钠溶液4 ml/d灌胃;低剂量组、中剂量组、高剂量组于第1~5天给予相应剂量药液4ml/d灌胃;DDP组分别于第1、3、5天腹腔注射2 m l DDP(20%);联合组于第1~5天给予中剂量灌胃药液灌胃4 ml/d及第1、3、5天腹腔注射2 ml DDP(20%)。末次给药2 h后采血,分离血清。A549细胞分别加入各组血清,培养72 h,倒置荧光显微镜下观察细胞凋亡情况。A549细胞分别加入各组血清,培养24、48、72 h后,采用酶联免疫吸附法(ELISA)检测TNF-α水平。A549细胞与各组血清共培养72 h后,采用荧光定量PCR检测Survivin mRNA、Caspase-3 mRNA的相对表达量。结果各组血清作用于A549细胞72 h后,凋亡细胞核固缩,且随药液浓度增加凋亡细胞增多。各组血清作用于A549细胞24、48、72 h后TNF-α分泌水平比较,差异均有统计学意义(P<0.05)。其中,低剂量组、中剂量组、高剂量组、DDP组和联合组作用于A549细胞24、48、72 h后TNF-α分泌水平高于对照组,差异均有统计学意义(P<0.05)。各组血清作用于A549细胞72 h后Survivin mRNA相对表达量比较,差异有统计学意义(F=13.238,P<0.05)。其中,高剂量组、DDP组和联合组血清作用于A549细胞72 h后Survivin mRNA相对表达量低于对照组,差异有统计学意义(P<0.05)。各组血清作用于A549细胞72 h后Caspase-3 mRNA相对表达量比较,差异有统计学意义(F=10.814,P<0.05)。其中,中剂量组、高剂量组、DDP组和联合组血清作用于A549细胞72 h后Caspase-3 mRNA相对表达量高于对照组,差异有统计学意义(P<0.05)。结论补肾疏肝方可促进肺腺癌A549细胞凋亡,其机制可能与抑制Survivin基因表达、促进TNF-α分泌和Caspase-3基因表达有关。
腺癌,细支气管肺泡;补肾疏肝方;A549细胞;细胞凋亡;Survivin;肿瘤坏死因子α;半胱氨酸天冬氨酸蛋白酶3
苗学红,王淑玲.补肾疏肝方对肺腺癌A549细胞的凋亡作用及其机制研究[J].中国全科医学,2015,18 (32):3964-3968.[www.chinagp.net]
Miao XH,Wang SL.Effects of bushenshugan formula on the apoptosis of human lung adenocarcinoma A549 cells and its mechanism[J].Chinese General Practice,2015,18(32):3964-3968.
近年来,肺癌发病率和病死率逐年上升,已成为危害人类健康最常见的恶性肿瘤之一[1]。非小细胞肺癌约占肺癌的80%,肺腺癌是非小细胞肺癌的主要病理类型。早期肺癌可采用手术治疗,但多数患者确诊时已到中晚期,失去了手术时机,其5年生存率低于15%[2]。同时,虽然放化疗已成为中晚期肺癌的主要治疗手段,但其毒副作用较多,常导致治疗中断。目前,中医药抗肿瘤已成为研究热点[3]。补肾疏肝方由北五味子、柴胡、当归、枸杞子、菟丝子、女贞子、车前子、瓜蒌等十八味中药组成,其通过行气化瘀,疏肝解郁,养血活血,化痰软坚散结,补肝肾之功效,提高患者机体免疫力,提高生活质量[4]。体外实验证实补肾疏肝方具有抑制肺腺癌A549细胞增殖的作用[5],本研究进一步探讨补肾疏肝方对肺腺癌A549细胞的作用机制。
1 材料与方法
1.1动物雄性SD大鼠60只,SPF级,体质量280~320 g,由郑州大学动物实验中心提供,合格证号:SCXK(豫)2010-0002。
1.2药品、试剂与仪器补肾疏肝方由北五味子、柴胡、当归、枸杞子、菟丝子、女贞子、车前子、瓜蒌等十八味中药组成,单方共计210 g,分别制成低剂量(1.25 g/ml)、中剂量(2.50 g/ml)和高剂量(3.75 g/ml)药液,4℃保存备用。冻干型粉剂注射用顺铂(DDP,肺腺癌的常规化疗药物),购于山东齐鲁制药有限公司,批号:国药准字号H37021357,临时配置成20%溶液。胎牛血清购自浙江天杭生物科技有限公司,RPMI 1640培养液、胰酶-EDTA和Hoechst33258染色液购自北京索莱宝科技有限公司,酶联免疫吸附法(ELISA)检测试剂盒购自深圳赛尔生物技术有限公司,4%多聚甲醛、Trigol、三氯甲烷、异丙醇、乙醇、DEPC、引物均购自北京鼎国生物技术有限责任公司,反转录试剂盒购自康为试剂有限公司。超净工作台购自苏州净化设备有限公司,细胞培养箱购自德国HERAEUS公司,酶标仪购自美国Bio-RAD公司,倒置荧光显微镜购自日本Nikon公司。
1.3细胞培养人肺腺癌A549细胞由郑州大学肿瘤实验中心提供。培养于含10%胎牛血清、100 U/ml青霉素和100μg/ L链霉素的RPMI 1640培养液中,37℃、5%CO2培养箱内培养,细胞呈长梭形贴壁生长,隔天换液,当细胞铺满瓶壁80%时,用胰酶消化传代,取对数生长期细胞用于实验。
1.4含药血清的制备以随机数字表法将大鼠分为对照组、低剂量组、中剂量组、高剂量组、联合组(中剂量药液联合DDP)、DDP组,每组10只。对照组于第1~5天给予0.9%氯化钠溶液4 ml/d灌胃;低剂量组、中剂量组、高剂量组于第1~5天给予相应剂量药液4 ml/d灌胃;DDP组分别于第1、3、5天腹腔注射2 ml DDP;联合组于第1~5天给予中剂量药液灌胃4 ml/d及第1、3、5天腹腔注射2 ml DDP。末次给药2 h后采用10%水合氯醛溶液腹腔注射麻醉,无菌条件下腹主动脉采血,静置2 h,3 000 r/min离心20min,分离血清,56℃灭活30 min,经0.22μm过滤除菌,将各组含药血清与含10%胎牛血清的RPMI 1640培养液以1∶9比例配制,于-20℃保存备用。
1.5Hoechst33258荧光染色取对数生长期A549细胞,加入培养液调整细胞浓度为1×105/ml,每孔2 m l接种于6孔板,放入培养箱中过夜,使细胞铺满底部的50%~80%,弃去旧培养液,分别加入各组血清,培养72 h,用PBS冲洗2~3次,加入4%多聚甲醛固定液1 ml,室温固定15 min。吸去固定液,PBS冲洗2~3次,加入0.5ml的Hoechst33258染色液,放入摇床上摇动10 min,去掉染色液,PBS冲洗2次,放入倒置荧光显微镜下观察。凋亡细胞由于染色质固缩,细胞核呈致密浓染或呈碎块状致密浓染,荧光倒置显微镜下呈蓝色。
1.6ELISA检测肿瘤坏死因子(TNF)-α取对数生长期A549细胞,调整细胞浓度为1×105/ml,以每孔1 ml接种到24孔板中,细胞培养24 h之后,加入各组血清,分别培养24、48、72 h后,3 000 r/min离心10 min,取上清液。从室温
平衡20 min后的铝箔袋中取出所需板条,设置标准品孔、样品孔和空白孔,在标准品孔中加入50μl标准品,在样品孔中加入各组上清液10μl,再加稀释液40μl,随后标准品孔和样品孔中加入辣根过氧化物酶(HRP)标记的检测抗体50μl,封板膜封住反应孔,放入37℃水浴锅内60 min,弃去液体,用洗涤液洗板5次。各孔加入底物A、B各50μl,37℃避光15 min,加入终止液50μl,15 min内于450 nm波长处测定各孔吸光度值。描绘标准曲线,计算各组TNF-α水平。实验独立重复3次。
1.7荧光定量PCR检测Survivin及半胱氨酸天冬氨酸蛋白酶(Caspase)-3 mRNA的相对表达量取上述培养72 h后细胞,胰酶进行消化,3 000 r/min离心10min,弃上清液。根据RNA提取试剂盒,提取细胞总RNA,提取的RNA根据cDNA第一链合成试剂盒合成cDNA。Survivin引物序列:上游:5'-ACCTCTTTGGGCTGGTATTG-3',下游:5'-AACGGACAGCTTTGGATTTC-3';Caspase-3引物序列:上游:5'-GCAGAACTTACATCACCTCA-3',下游:5'-GCATTGCTGCCTCTAGTTAT-3';β-actin内参基因引物序列:上游:5'-ATTACGCACCATGAAGATCA-3',下游:5'-TCGTCATACTCCTGCTTGCT-3'。取PCR反应液43μl、Taq酶2μl,加入无菌离心管中混匀,使用微量加样器于反应管中加入45μl反应液,加入RT反应产物5μl。PCR条件:预变性95℃5 min,变性95℃30 s,退火62℃20 s,延伸72℃20 s,共35次循环,终延伸72℃10 min。荧光定量检测仪检测Survivin mRNA、Caspase-3 mRNA相对表达量。
1.8统计学方法采用SPSS 17.0统计软件进行统计分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Hoechst33258荧光染色各组血清作用于A549细胞72 h后,经Hoechst 33258荧光染色,凋亡细胞核固缩,染色质边集,呈现蓝色荧光,且随药液浓度增加,凋亡细胞增多,以联合组出现致密浓染的细胞核最多(见图1)。
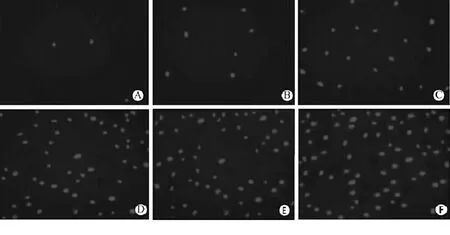
图1 各组血清作用于A549细胞72 h后荧光染色(Hoechst33258染色)Figure 1 Fluorescent staining of each group after 72 hours'influence of serum on A549 cells
2.2各组血清作用于A549细胞不同时间后TNF-α分泌水平比较各组血清作用于A549细胞24、48、72 h后TNF-α分泌水平比较,差异均有统计学意义(P<0.05)。其中,低剂量组、中剂量组、高剂量组、DDP组和联合组作用于A549细胞24、48、72 h后TNF-α分泌水平高于对照组,差异均有统计学意义(P<0.05,见表1)。
表1 各组血清作用于A549细胞不同时间后TNF-α分泌水平的比较(n=3,±s,μmol/L)Table 1 Comparison of TNF-αlevel among the 6 groups at different timepoints of serum's influence on A549 cells
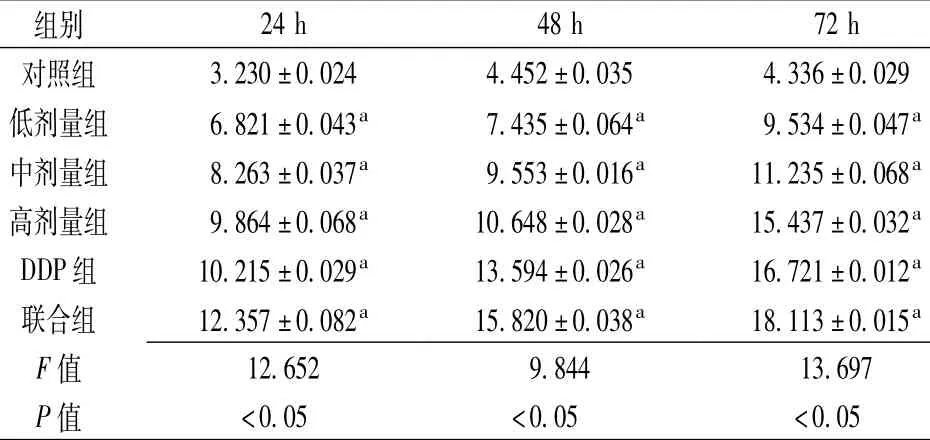
表1 各组血清作用于A549细胞不同时间后TNF-α分泌水平的比较(n=3,±s,μmol/L)Table 1 Comparison of TNF-αlevel among the 6 groups at different timepoints of serum's influence on A549 cells
注:DDP=顺铂;与对照组比较,aP<0.05
组别24 h 48 h 72 h对照组3.230±0.024 4.452±0.035 4.336±0.029低剂量组6.821±0.043a7.435±0.064a9.534±0.047a中剂量组8.263±0.037a9.553±0.016a11.235±0.068a高剂量组9.864±0.068a10.648±0.028a15.437±0.032aDDP组10.215±0.029a13.594±0.026a16.721±0.012a联合组12.357±0.082a15.820±0.038a18.113±0.015aF值12.652 9.844 13.697 P值<0.05<0.05<0.05
2.3各组血清作用于A549细胞72 h后Survivin mRNA及Caspase-3 mRNA相对表达量各组血清作用于A549细胞72 h后Survivin mRNA相对表达量比较,差异有统计学意义(F =13.238,P<0.05)。其中,高剂量组、DDP组和联合组血清作用于A549细胞72 h后Survivin mRNA相对表达量低于对照组,差异有统计学意义(P<0.05,见图2)。各组血清作用于A549细胞72 h后Caspase-3 mRNA相对表达量比较,差异有统计学意义(F=10.814,P<0.05)。其中,中剂量组、高剂量组、DDP组和联合组血清作用于A549细胞72 h后Caspase-3 mRNA相对表达量高于对照组,差异有统计学意义(P<0.05,见图3)。
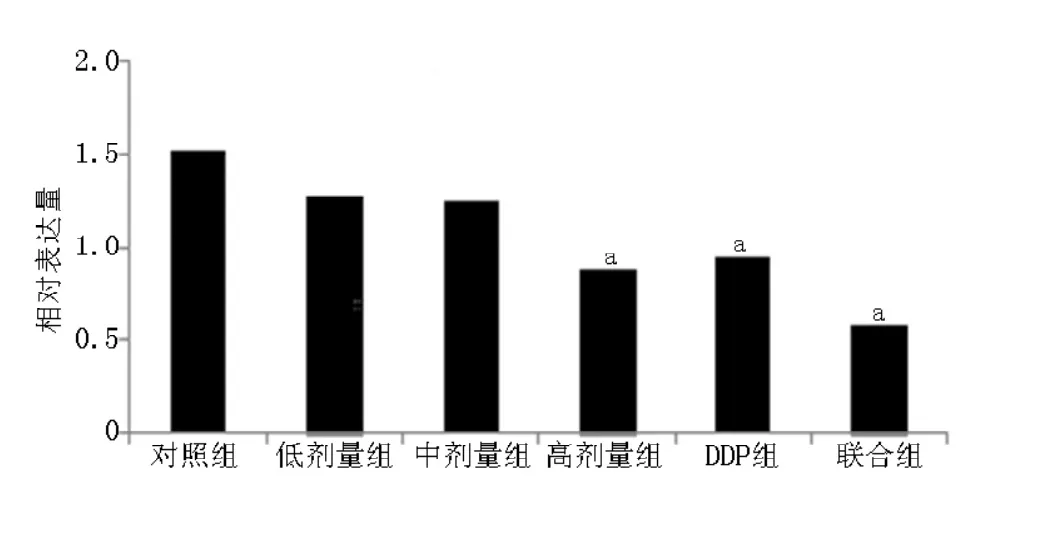
图2 各组血清作用于A549细胞72 h后Survivin mRNA相对表达量Figure 2 Relative expression of Survivin mRNA of each group after 72 hours'influence of serum on A549 cells

图3 各组血清作用于A549细胞72 h后Caspase-3 mRNA相对表达量Figure 3 Relative expression of Caspase-3 mRNA of each group after 72 hours'influence of serum on A549 cells
3 讨论
肿瘤细胞的首要特征为细胞增殖与凋亡失衡,因此抗增殖、促凋亡是治疗肿瘤的有效方法。中医药抗肿瘤已经由单纯临床报道进入较为系统的临床与实验相结合的前瞻性研究。
TNF主要由活化的巨噬细胞、NK细胞及T淋巴细胞产生,是首个用于肿瘤生物疗法的细胞因子,TNF抗肿瘤的机制有[6]:(1)体内、体外均可杀死某些肿瘤细胞,或抑制其增殖作用;(2)提高中性粒细胞的吞噬功能;(3)引起发热,诱导肝细胞急性期蛋白的合成;(4)促进白血病细胞向巨噬细胞的分化。夏晖等[7]研究表明,TNF-α可能通过与肿瘤细胞表面特异性受体结合,影响P53蛋白的表达,从而影响肿瘤细胞的增殖和凋亡过程,发挥抗肿瘤作用。夏启松等[8]研究表明,TNF-α在大黄素抑制肺腺癌A549细胞增殖和促进A549细胞凋亡过程中发挥重要作用。本研究结果显示,补肾疏肝方可促进TNF-α的分泌,表明其对抑制肺腺癌A549细胞的增殖和促进凋亡具有一定作用。
Survivin具有肿瘤特异性,只表达于肿瘤和胚胎组织,与肿瘤细胞的分化增殖和浸润转移有关,为凋亡抑制蛋白家族的一员,是迄今为止发现的最强的凋亡抑制因子[9]。研究显示,Survivin参与乳腺癌细胞凋亡的调控,促进细胞增殖及淋巴结转移[10]。也有研究认为,Survivin在甲状腺癌组织中表达上调[11]。Singhal等[12]研究发现,Survivin在肺癌组织中高表达,是非小细胞肺癌最显著的预后因子之一,其高表达抑制Caspase、Bax活性及抗肿瘤药物效果。本研究结果显示,补肾疏肝方作用肺腺癌A549细胞72 h后,高剂量组Survivin mRNA相对表达量下降,提示补肾疏肝方促进A549细胞的凋亡可能与下调Survivin基因的表达有关。
Caspase是执行细胞凋亡的蛋白酶家族,Caspase-3酶原能够被Caspase-8、Caspase-9、Caspase-10以及颗粒酶B激活,是细胞凋亡的主要执行者。Caspase-3在多个信号传导途径中发挥重要作用[13]。夏晖等[7]研究表明,TNF-α可通过促进人肺癌A549细胞Caspase-3的蛋白表达以增强γ射线导致的细胞凋亡,从而提高放疗敏感性,可见Caspase-3在TNF-α杀伤肿瘤细胞中发挥促进作用。本研究结果显示,补肾疏肝方作用于肺腺癌A549细胞72 h后,中剂量组、高剂量组Caspase-3 mRNA相对表达量升高,提示补肾疏肝方促进A549细胞的凋亡可能与上调Caspase-3基因的表达有关。
综上所述,补肾疏肝方可促进肺腺癌A549细胞凋亡,其机制可能与抑制Survivin基因表达、促进TNF-α分泌和Caspase-3基因表达有关。本研究经体外实验证实补肾疏肝方对肺腺癌A549细胞的抑制作用,为其在临床推广提供依据。
[1]赵建平,王媛媛.人参多糖体外诱导人非小细胞肺癌A549细胞凋亡的实验研究[J].中国中西医结合杂志,2006,26(6): 95-97.
[2]Hu JC,Li QQ.Effect of Tetramethypyrazine on the proliferation and apoptosis of lung cancer cell line of A549 and its mechanism[J].Medical Journal ofWuhan University,2010,31(1):19-22.(in Chinese)胡家才,李清泉.川芎嗪对肺癌A549细胞增殖与凋亡的影响及其机制[J].武汉大学学报,2010,31(1):19-22.
[3]Guan XL,Luo G,Zhu L,et al.Inhibition of nobiletin on human non-small cell lung cancer cell line A549[J].Journal of China Pharmaceutical University,2006,37(5):443-446.(in Chinese)管晓琳,罗刚,朱玲,等.川陈皮素诱导非小细胞肺癌A549细胞凋亡的研究[J].中国药科大学学报,2006,37(5):443-446.
[4]刘源,王淑玲.补肾散结方联合GP方案治疗晚期非小细胞肺癌临床疗效观察[J].中华中医药杂志,2011,26(4):864-867.
[5]苗学红,王淑玲,古兆森,等.补肾疏肝方对肺腺癌A549细胞的抑制及凋亡相关因子研究[J].中华中医药杂志,2014,29 (8):2661-2664.
[6]Gu CP,Zhang YP.Progress on anti-tumor mechanism of tumour necrosis factor-alpha[J].China Cancer,2007,16(2):102-105.(in Chinese)古翠萍,张沂平.TNF-α抗肿瘤作用机制新进展[J].中国肿瘤,2007,16(2):102-105.
[7]Xia H,Li J,Yu CH,et al.Effect of TNF-αon the apoptosis human of A549 cells[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2005,10(12):1381-1383.(in Chinese)夏晖,李捷,于长海,等.TNF-α对人肺癌A549细胞凋亡的影响[J].中国临床药理学与治疗学,2005,10(12):1381-1383.
[8]Xia QS,Liu JW,Sun RY,et al.Effects of emodin on cell proliferation,apoptosis and VEGF/TNF-αsecretion of human lung adenocarcinoma A549 cells[J].Cancer Research on Prevention and Treatment,2010,37(4):387-391.(in Chinese)夏启松,刘静维,孙仁宇,等.大黄素对人肺腺癌A549细胞体外增殖凋亡及VEGF和TNF-α分泌的影响[J].肿瘤防治研究,2010,37(4):387-391.
[9]Chen J,Qiu R,Bi YL,etal.Mechanism of apoptosis in A549 cells induced by CoCl2[J].Journal of Medical Reaserch,2012,41 (3):58-61.(in Chinese)陈健,仇容,毕艳丽,等.二氯化钴诱导A549细胞凋亡及机制的研究[J].医学研究杂志,2012,41(3):58-61.
[10]Sang ZF,Wang X,Qi YX,et al.Survivin expression and its correlation with cell prolifeation in breast cancer[J].Journal of Modern Oncology,2009,17(8):1478.(in Chinese)桑占发,王兴,齐玉新,等.乳腺癌组织Survivin表达与细胞增殖的关系[J].现代肿瘤医学,2009,17(8):1478.
[11]Ma J,Li XJ,Sui J,et al.Correlations between expression of survivin and microvessd demity in thyroid carcinoma[J].Cancer Prevention Research,2010,37(10):1149.(in Chinese)马静,李晓江,隋军,等.Survivin在甲状腺癌中的表达及与微血管生成的关系[J].肿瘤防治研究,2010,37(10) :1149.
[12]Singhal S,Vachani A,Antin-Ozerkis D,et al.Prognostic implications of cellcycle,apoptosis,and angiogenesis biomarkers in non-small cell lung cancer:a review[J].Clin Cancer Res,2005,11(11):3974-3986.
[13]Sanli T,Liu C,Rashid A,et al.Lovastatin sensitizes lung cancer cells to ionizing radiation:modulation of molecular pathways of radioresistance and tumor suppression[J].J Thorac Oncol,2011,6(3):439-450.
(本文编辑:吴立波)
Effects of Bushenshugan Formula on the Apoptosis of Hum an Lung Adenocarcinom a A549 Cells and Its M echanism
MIAO Xue-hong,WANG Shu-ling.Department of Integrative Chinese and Western Medicine,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Objective To explore the effects of Bushenshugan Formula(BSSGF)on the apoptosis of human lung adenocarcinoma A549 cells,the level of TNF-αand themRNA expression of Survivin and Caspase-3.M ethods BSSGFwas used tomake low-dose(1.25 g/ml),medium-dose(2.50 g/ml)and high-dose(3.75 g/ml)liquid.Using random number tablemethod,we divided the rats into control group,low-dose group,medium-dose group,high-dose group,DDP group and combined group(medium-dose liquid combined with DDP)with 10 rats in each group.Control group was given 0.9%sodium chloride solution from day 1 to day 5;low-dose,medium-dose and high-dose groupswere given corresponding dose of liquid by 4 ml/d;DDP group was given 2 ml DDP(20%)on day 1,day 3 and day 5 by intraperitoneal infection; combined group was givenmedium-dose liquid by 4 ml/d from day 1 to day 5 and was also given 2ml DDP(20%)on day 1,day 3 and day 5 by intraperitoneal infection.Two hours after the last administration,blood samples were taken and serum was separated.A549 cells were added into the serum of each group and were cultured for 72 hours,then observed cell apoptosis by inverted fluorescencemicroscope.ELISA method was used to determine TNF-αlevel at24 h,48 h and 72 h after cultivatation.After 72 hours,fluorogenic quantitative PCR was employed to determine the relative expression of SurvivinmRNA and Caspase-3 mRNA.Results After 72 hours'influence of serum on A549 cells,cell apoptosis and karyopyknosis occurred,and the apoptotic cells increased with liquid concentration increasing.At24 h,48 h and 72 h,the 6 groupswere significantly different in the expression of TNF-α(P<0.05).At 24 h,48 h and 72 h,low-dose group,medium-dose group,high-dose group,DDP group and combined group were higher than control group in the expression of TNF-α(P<0.05).The 6 groups were significantly different in the relative expression of Survivin mRNA at 72 h(F=13.238,P<0.05).High-dose group,DDP group and combined group were lower(P<0.05)than control group in the relative expression of Survivin mRNA at 72 h.The 6 groups were significantly different in the relative expression of Caspase-3 mRNA at 72 h(F=10.814,P<0.05).Medium-dose group,high-dose group,DDP group and combined group were higher than control group in the relative expression of Caspase-3 mRNA at72 h(P<0.05).Conclusion BSSGF could accelerate the apoptosis of A549 cells,and it may induce apoptosis of A549 cells by inhibiting the gene expression of Survivin,promoting the secretion of TNF-αand increasing the expression of Caspase-3.
Adenocarcinoma,bronchiolo-alveolar;Bushenshugan formula;A549 cells;Apoptosis;Survivin; Tumor necrosis factor-alpha;Caspase 3
R 730.261
A
10.3969/j.issn.1007-9572.2015.32.016
国家自然科学基金资助项目(81473497);河南省科技厅科技攻关项目(112300410049)
450052河南省郑州市,郑州大学第一附属医院中西医结合科(苗学红);郑州大学基础医学院(王淑玲)
王淑玲,450001河南省郑州市,郑州大学基础医学院;E-mail:wsl5869@163.com
2015-01-18;
2015-08-18)

