两种生物活性植骨材料对小鼠骨髓干细胞增殖和分化的影响
李德利 李箐 王 彤 毋育伟卢松鹤 胡洪成 唐志辉
1(北京大学口腔医学院口腔医院第二门诊部,北京 100012)2(北京大学口腔医学院口腔医院口腔医学数字化研究中心,北京 100081)3(口腔数字化医疗技术和材料国家工程实验室,北京 100081)
两种生物活性植骨材料对小鼠骨髓干细胞增殖和分化的影响
李德利1†李箐2,3†王 彤1毋育伟1卢松鹤1胡洪成1唐志辉3*
1(北京大学口腔医学院口腔医院第二门诊部,北京 100012)2(北京大学口腔医学院口腔医院口腔医学数字化研究中心,北京 100081)3(口腔数字化医疗技术和材料国家工程实验室,北京 100081)
生长因子作用于拔牙后的牙槽窝,有可能阻止或减少牙槽骨的破坏吸收,从而维持牙槽骨原有的结构。为了奠定临床拔牙后、牙槽嵴位点保留的实验基础,本研究首先通过乳液交联法合成壳聚糖微球,负载生长因子BMP-2及脂联素(APN),再将其复合于小牛松质骨支架形成生物活性植骨材料。将两种生物活性材料与小鼠前成骨细胞(MC3T3-E1)共培养,比较材料对细胞增殖和分化的影响。结果表明,负载BMP-2的缓释微球表面更为光滑,微球平均直径为9.634 μm。cck-8结果表明,随着BMP-2浓度的增加,细胞增殖速度较脂联素组增加更快。实时定量PCR结果表明,ALP、BMP-2、OCN和Adipor2基因在APN处理组增加倍数高于BMP-2组。Western-Blot结果表明,APN植骨材料更有利于小鼠前成骨细胞MC3T3-E1的增殖和分化。
骨形态发生蛋白-2(BMP-2);脂联素(APN);成骨细胞(MC3T3-E1);药物缓释体系
引言
牙齿拔除后,拔牙窝周围牙槽骨会发生持续性骨吸收,Araújo等的研究表明,拔牙后12个月内牙槽嵴水平向骨吸收可高达5~7 mm,相当于拔牙前牙槽骨宽度的一半[1]。其中大部分骨吸收发生在拔牙后3个月内。有研究将骨替代材料或支架放入拔牙窝内,为牙槽骨重建保留空间[2-5],或在拔牙窝中应用具有诱导成骨能力的生物活性因子骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2),虽然对促进拔牙创的愈合并提高新骨形成的速度有一定的作用,但仍然无法阻止破骨细胞对牙槽骨壁的早期吸收破坏过程,仅能重建部分牙槽骨[6-8]。
骨重建是由破骨细胞和成骨细胞共同介导的一种有序、平衡的骨吸收和骨形成过程[9-10]。因此,在骨破坏与骨生成的动态平衡中,如果选择既具有抑制破骨细胞活性,又能促进成骨的生物因子作用于拔牙后的牙槽窝,将有可能能够阻止或减少牙槽骨颊舌侧骨板的破坏吸收,从而尽量维持牙槽嵴原有的框架结构,减少因为牙槽骨重建所需的治疗时间、成本和手术难度。
脂联素(adiponectin,APN)在骨代谢中具有调控作用。成骨细胞与破骨细胞均表达脂联素受体[11-12],是脂联素的靶器官。体外实验证明,脂联素通过抑制TLR4介导的NF-kappa B激活,进而抑制小鼠单核细胞向破骨细胞分化成熟[13]。另一方面,脂联素通过激活AdipoRl/JNK、AdipoRl/p38信号转导途径诱导人成骨细胞的增殖及分化,促进其成骨功能[14]。体内研究亦证实,含脂联素的腺病毒转染C57BL/6J小鼠后,破骨细胞功能被抑制,成骨细胞作用被激活,表现为净骨量增加[15]。以上研究表明,脂联素既能抑制破骨细胞的骨吸收活性,同时又能增加成骨细胞的活性和骨基质的矿化。
本研究以高分子壳聚糖(chitosan, CS)作为缓释载体,将生物活性因子脂联素(adiponectin,APN)复合高温煅烧的小牛松质骨材料(ceramic bovine bone,CBB),与 BMP-2复合CBB材料对照,探讨两种生物活性材料对小鼠前成骨细胞MC3T3-E1的增殖和分化的影响,旨在构建骨组织工程适宜的支架材料,为临床拔牙后牙槽嵴位点保留奠定实验基础。
1 材料和方法
1.1CBB制备
选用新鲜牛肱骨骨垢端松质骨,截取3 mm×3 mm×15 mm形状规则的长方形骨条,氢氧化钠、双氧水溶液浸泡后,高压蒸煮2 h,去除部分蛋白及胶原,去离子水洗净,烘干。将干燥的骨条放入马弗炉中煅烧,缓慢升至700℃,氧气氛围2 h煅烧,形成保留自然骨架结构的磷灰石骨架,将煅烧后的骨条浸入0.09 mol/L 焦磷酸钠溶液中, 70℃水浴浸泡72 h,干燥后再将骨条再放入马弗炉中煅烧, 缓慢升温至1 200℃, 维持 1 h,制备成经两次煅烧的牛松质骨块。将煅烧骨块研磨成颗粒,通过标准筛的标准网孔过滤,得到(0.25~1 mm)尺寸的煅烧骨颗粒。
1.2CS缓释体系制备
采用乳化交联法制备缓释体系。称取1.5 g壳聚糖溶于2.4 vol%的稀醋酸溶液60 mL中,待其完全溶解后,加入一定量的BMP-2/APN,机械搅拌使二者混合均匀。将混合后的溶液缓慢加入380 mL含2.7 wt%、2 wt%乳化剂Tween80、Span80的液体石蜡溶液中,室温下机械搅拌3 h。然后向其中缓慢滴加的vanillin乙醇溶液,使壳聚糖发生交联。滴加完毕,继续搅拌6 h,静置,取出沉淀物,用石油醚、异丙醇反复漂洗,最后将沉淀物冷冻干燥至恒重,分别制备出载BMP-2和APN的壳聚糖微球。
1.3CS/CBB支架材料的制备
室温下将BMP-2/APN壳聚糖微球,配制1%或2%的壳聚糖溶液,充分搅拌使其混合均匀,取上述溶液到入支架材料,然后用二次蒸馏水浸泡洗涤15 min (3次),冷冻干燥24 h,得到负载两种生长因子的CS/CBB支架材料。
1.4材料的表征
采用场发射扫描电子显微镜(Hitachi S-4500)对材料进行显微结构的观察。
1.5体外细胞培养
无机化学是一门以实验为入手和学习的一门课程,在理论课后要用实验去巩固所学习的知识,在做实验的过程中,需要向学生灌输认真细致的实验态度,追求实事求是的结果。实验可以检验课本所教授的知识,同时可以强化理论的学习,巩固理论知识。
1.5.1细胞增殖
取P3代MC3T3-E1细胞,以密度为1×106个/mL接种在T25培养瓶中,用a-MEM培养。细胞共分为CON组(不含生长因子)、BMP-2组(1 μg/mL, 1.25 μg/mL)、APN组(100 μg/mL, 200 μg/mL)。将上述各组细胞接种细胞悬液于96孔板中(1×103个/孔)。隔天换培养基。分别于第1、3、5、7、14 d每孔加入10 μL CCK-8溶液,孵育2 h,酶标仪(Bro-rad 680)测定450 nm吸光度值。
1.5.2实时定量PCR 测定
取P3代MC3T3-E1细胞,以密度为1×106个/mL接种在T25培养瓶中,用a-MEM培养。接种第2 d换成诱导培养基(在上述a-MEM基础上加入10E-8M DEX、50 μg/mL VC, 10 mM β-磷酸甘油)。
细胞共分为3组,CON组(不含生长因子)、BMP-2组(1.25 μg/mL)、APN组(100 μg/mL)。分别在第3和第7 d收集细胞。再通过实时定量PCR的方法检测ALP、BMP-2、OCN、OPN、AdipoR1 和AdipoR2基因在BMP-2和APN2处理后的mRNA水平表达的变化。
将MC3T3-E1细胞于体外使用成骨诱导基培养,第3和第7 d时,收集细胞,提取总RNA(#55-11120,SinoGene Scientific)。分光光度计测定浓度(Biophotometer,Eppendorf), 取1 μg总RNA进行DNaseI处理(EN0521, Fermentas),然后反转录(Thermo First cDNA Synthesis Kit,#33-20102,SinoGene Scientific)。ALP、BMP-2、OCN、OPN、AdipoR1、AdipoR2及ACTB序列参照GeneBank(引物序列如表1)。qPCR反应体系按照10 μL 2×SG PCR MasterMix(#33-10201,SinoGene Scientific), 0.4 μLForward/Reverse primer(5 μM),1 μLcDNA和8.2 μL ddH2O进行配置,在定量PCR仪上进行反应(Applied Biosystems ABI StepOnePLUS)。反应程序为预变性:95℃、10 min;40个循环的95℃、30 s,61℃、31 s;最后按照仪器默认添加熔解程序:95℃、15 s,60℃、30 s,和95℃、15 s,以验证反应的特异性。内参基因同时检测,用2-△△Ct方法进行数据分析。

表1 引物信息Tab.1 The chain of primers
1.5.3Westen-Blot测定
首先90V电泳30 min,后120 V电泳2 h,然后300 mM,2 h转到PVDF膜上。无蛋白快速封闭液(#66-11402,SinoGene)封闭(3~5)min,进行室温下一抗孵育2 h,抗体Anti-ALP(sc-79839),Anti-BMP-2(sc-6267)、Anti-OCN(sc-30045),Anti-OPN(sc-21742)、anti-AdipoR1(sc-46748),Anti-AdipoR2(sc-46756),稀释倍数均为1∶1 000。TBST漂洗3次后,加二抗(1∶2 000)孵育1 h后,ECL发光(29050,Engreen),暗室曝光检测。Stripping Buffer(#66-11501,SinoGene Scientific)洗脱后,重新标记内参Actin(一抗,M20009,Ab-mart)。
1.6统计分析
采用Graph Pad Prism 4统计分析软件进行统计分析。所有实验均进行3 次独立操作。采用ANOVA 检验对数据进行统计分析,两两比较采用双尾t检验,3组或3组以上比较采用Turkey-Kramer 检验。P<0.05 表明差异具有统计学意义。
2 结果
2.1材料形貌观察
负载不同生长因子的微球形状及表面形态如图1 所示。图1中(a)和(b)分别表示CS微球负载脂联素和BMP-2后的微观形态图。微球均呈现出很好的球形,这是由于乳化离子交联法有利于CS和Vanillin之间发生了很好地交联作用。相对于负载脂联素的壳聚糖微球,负载BMP-2的缓释微球表面更为光滑。所制备的壳聚糖微球的球形良好,整个球体表面光滑无皱。应用扫描电镜测量所制备微球的直径,所制备的微球平均直径为9.634 μm。在CS/BMP-2微球的制备过程中,BMP-2离子浓度影响了与CS之间的交联作用。

图1 负载不同生长因子微球的SEM图片。(a)脂联素;(b)BMP-2Fig.1 SEM of different CMs. (a) APN; (b) BMP-2
2.2细胞增殖检测结果
为了评价该缓释系统的生物活性,实验采用CCK-8法测量不同组成骨细胞的增殖活性(见图2)。总体来说,随着共培养的时间由1 d增加到14 d,两种生长因子实验组和对照组中的成骨细胞总量都有不同程度的增加,可见各组成骨细胞均处于增殖状态。而且,随着BMP-2浓度的增加,细胞增殖速度比脂联素组显著性加快。这说明负载BMP-2生长因子的缓释体系更有利于小鼠前成骨细胞MC3T3-E1的增殖。
2.3实时定量PCR结果
从表1中qPCR结果统计分析可以看出,ALP、BMP-2、OCN、OPN、AdipoR2基因在第3和第7 d,在BMP-2和APN处理时,RNA样品提取及浓度均出现上调趋势。AdipoR1基因没有表现出这个趋势。
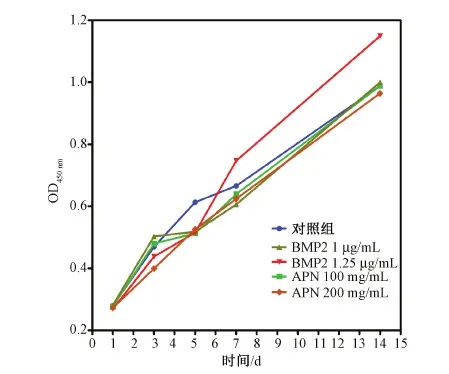
图2 不同的缓释体系对MC3T3细胞增殖影响Fig.2 The proliferation of MC3T3- co-cultured with materials
再从图3中可以发现ALP、BMP-2、OCN和 AdipoR2基因在APN处理组增加倍数高于BMP-2处理组。与对照组相比,ALP基因在第3和第7 d时,BMP-2组分别增加了1.2和1.8倍,APN组分别增加了5.7和22.5倍。 BMP-2基因在第3和第7 d时,BMP-2组分别增加了3.2和11.8倍,APN组分别增加了10.1和77.6倍。OCN基因在第3和第7 d时,BMP-2组分别增加了1.8和8.4倍,APN组分别增加了11.3和76.1倍。AdipoR2基因在第3和第7 d时,BMP-2组分别增加了1.2和1.8倍,APN组分别增加了4.0和9.3倍。
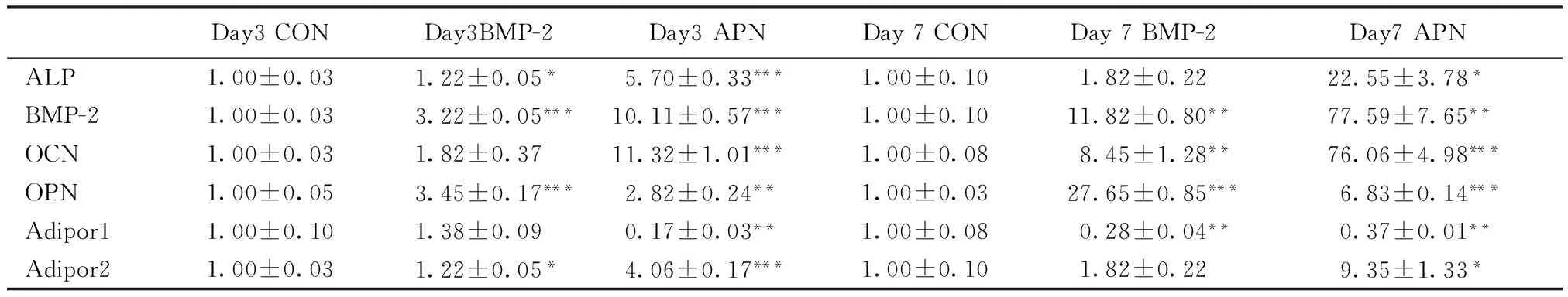
表1 细胞中BMP-2和APN基因表达的不同变化Tab.1 Fold-change of different gene expression in BMP-2 and APN Treatments
注:*:P<0.05;**:P<0.01;***:P<0.001
Note:*:P<0.05;**:P<0.01;***:P<0.001
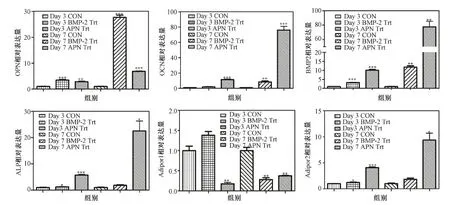
图3 实时定量PCR 检测不同缓释体系对MC3T3细胞多个基因的表达(*P<0.05;**P<0.01;***P<0.001)。(a) OPN; (b) OCN; (c) BMP2; (d) ALP;(e) Adipor1;(f) Adipor2Fig.3 Real-Time PCR on MC3T3 cells(*P<0.05;**P<0.01;***P<0.001). (a) OPN; (b) OCN; (c) BMP2; (d) ALP; (e) Adipor1; (f) Adipor2
2.4Western-Blot结果
如图4(a)所示,在BMP-2处理后第3 d,OCN、OPN、BMP2、ALP、AdipoR2的蛋白表达量都明显出上调趋势。如图4(b)所示,APN处理后第3和第7 d,OCN、OPN、BMP2、ALP、AdipoR1和AdipoR2的蛋白表达量出现明显上调趋势。相对于BMP-2处理仅在第3 d表现出的趋势,APN处理在第3和第7 d都能促进蛋白的表达。这说明负载APN的缓释体系更有利于小鼠前成骨细胞MC3T3-E1的增殖分化。
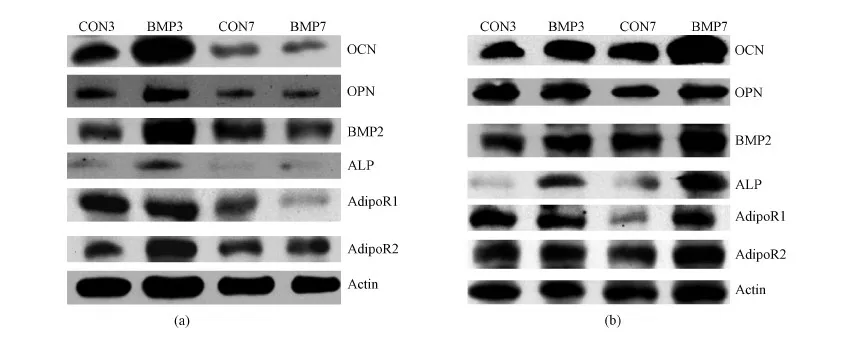
图4 Westen-Blot检测不同缓释体系对MC3T3细胞多个基因的表达。(a)BMP-2;(b)APNFig.4 Westen-Blot of MC3T3 cells(a)BMP-2;(b)APN
3 讨论
牙槽嵴位点保留(ridge preservation)是在拔牙的当时对牙槽骨吸收过程进行干预,将骨替代材料(graft material)或支架(scaffold)放入拔牙窝,维持拔除牙齿遗留的空隙,达到牙槽嵴保留目的[16]。牙槽嵴位点保留的治疗理念,为保存牙槽骨提供了一种简单有效的方法,避免了复杂的植骨手术,减少了病人的痛苦和费用。最近有研究表明,新鲜的拔牙窝放入Bio-Gide胶原膜之后,仅起到支架的作用,不能促进新骨形成[17,18];将骨替代品植入拔牙窝,却不易被新生骨组织替代,不利于后续的种植治疗[19-20]。为解决这些问题,研究者们开始关注生物活性因子(bioactive molecules)在拔牙窝骨壁保留中的重要作用,目前国内外学者主要集中于促进成骨作用的生物活性因子的研究,例如重组骨形态发生蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2)[13]、辛伐他汀(simvastatin),碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)[21]、血小板源生长因子(platelet-derived growth factor,PDGF)[22]、细胞结合肽-15(cell-binding peptide-15)[23]等。经大量文献检索后,尚未发现有既能促进成骨,又能抑制破骨细胞作用的生物活性因子用于牙槽嵴骨壁保留的文献报道。
BMP-2是一种可溶的、低分子跨膜糖蛋白,研究表明BMP-2可以诱导骨髓干细胞分化为成骨细胞,上调碱性磷酸酶活性,上调骨钙素和I型胶原的表达,增加矿化基质,在局部其对膜内成骨和软骨内成骨均有诱导作用。然而,骨组织改建包括两个方面:成骨细胞(osteoblasts)参与的骨形成过程和破骨细胞(osteoclasts)介导的骨吸收过程,二者共同构成了一个精细的动态平衡的过程[24-25]。骨形成与骨吸收的平衡,受机体局部和全身因素的影响,通过改变成骨细胞以及破骨细胞的细胞分化和细胞活性得以实现[29]。因此,可以在拔牙窝局部使用生物活性因子,促进局部成骨细胞的成骨能力或抑制破骨细胞的骨吸收活性,达到牙槽嵴骨壁保留的目的。
脂联素是20世纪90年代中期由美国、日本4个独立的实验小组从不同角度相继在动物及人类脂肪细胞中发现,由247 个氨基酸组成,存在2种受体,AdipoR1和AdipoR2。体外实验证明,脂联素通过抑制TLR4介导的NF-kappa B激活,进而抑制小鼠单核细胞向破骨细胞分化成熟;另一方面,脂联素通过激活AdipoRl/JNK、AdipoRl/P38信号转导途径诱导人成骨细胞的增殖及分化,促进成骨[14-15]。因此APN既能抑制破骨细胞的骨吸收活性,同时又能增加成骨细胞的活性和骨基质的矿化。
煅烧骨作为支架材料在成骨过程中主要起骨引导作用,既形成一个物理支架吸附种子细胞顺此支架爬行、增殖并形成新骨。而骨生长因子在骨修复过程中能诱导间充质细胞分化为成骨细胞,刺激成骨细胞加速增殖。由于骨改建包括成骨细胞参与的骨形成过程和破骨细胞介导的骨吸收过程,二者共同构成了一个精细的动态平衡的过程。研究采用促进成骨作用的BMP-2与既能抑制破骨、又能促进成骨的APN作为骨替代材料缓释的生物因子,发现在蛋白表达水平,BMP-2处理后第3d表现明显出现上调趋势。APN处理后第3和第7d也出现明显上调趋势。此外,ALP、BMP-2、OCN、OPN、Adipor1和Adipor2基因表达水平,BMP-2和APN组均出现明显的上调趋势。但负载生长因子APN组较BMP-2组上调趋势更加明显。
4 结论
本研究表明,外源性的BMP-2和APN作为骨替代材料缓释的生物因子,在干细胞向成骨分化过程中起促进作用。APN一定浓度下,既能抑制破骨、又能促进成骨向分化。所以载APN植骨材料较BMP-2植骨材料更加促进成骨相关蛋白和基因的表达。
[1] Araujo MG, Lindhe J. Dimensional ridge alterations following tooth extraction. an experimental study in the dog [J]. J Clin Periodontol, 2005,32(2):212-218.
[2] Araujo M. The influence of bio-oss collagen on healing of an extraction socket: an experimental study in the dog [J]. Int J Periodontics Restorative Dent, 2008,28(2): 123-135.
[3] Carmagnola D. Healing of human extraction sockets filled with Bio-Oss [J]. Clin Oral Implants Res, 2003,14(2):137-143.
[4] Bashara H. The effect of permanent grafting materials on the preservation of the buccal bone plate after tooth extraction: an experimental study in the dog [J]. Clin Oral Implants Res, 2012,23(8): 911-917.
[5] Shi B. Alveolar ridge preservation prior to implant placement with surgical-grade calcium sulfate and platelet-rich plasma: a pilot study in a canine model [J]. Int J Oral Maxillofac Implants, 2007,22(4): 656-665.
[6] Lissenberg-Thunnissen SN, Gorter DJ, Sier CF,etal. Use and efficacy of bone morphogenetic proteins in fracture healing [J]. Int Orthop, 2011,35(9): 1271-1280.
[7] Matin K. Impact of recombinant human bone morphogenetic protein-2 on residual ridge resorption after tooth extraction: an experimental study in the rat [J]. Int J Oral Maxillofac Implants, 2001,16(3): 400-411.
[8] Spagnoli DB, Marx RE. Dental implants and the use of rhBMP-2 [J]. Oral Maxillofac Surg Clin North Am, 2001,23(2):347-361.
[9] Katagiri T, Takahashi N. Regulatory mechanisms of osteoblast and osteoclast differentiation [J]. Oral Dis, 2002,8(3): 147-159.
[10] Martin TJ, Sims NA. Osteoclast-derived activity in the coupling of bone formation to resorption [J]. Trends Mol Med, 2005,11(2): 76-81.
[11] Yamauchi T. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects [J]. Nature, 2003,423(6941): 762-769.
[12] Diez JJ, Iglesias P. The role of the novel adipocyte-derived hormone adiponectin in human disease [J]. Eur J Endocrinol, 2003,148(3): 293-300.
[13] Deepa SS, Dong LQ. APPL1: role in adiponectin signaling and beyond [J].Am J Physiol Endocrinol Metab, 2009,296(1): 22-36.
[14] Huang CY. Adiponectin increases BMP-2 expression in osteoblasts via AdipoR receptor signaling pathway [J]. J Cell Physiol, 2010,224(2): 475-483.
[15] Tu Q. Adiponectin inhibits osteoclastogenesis and bone resorption via APPL1-mediated suppression of AKT1 [J]. J Biol Chem, 2011,286(14):12542-12553.
[16] Spagnoli DB, Marx RE. Dental implants and the use of rhBMP-2 [J]. Oral Maxillofac Surg Clin North Am, 2011,23(2):347-361.
[17] Katagiri, T, Takahashi N. Regulatory mechanisms of osteoblast and osteoclast differentiation [J].Oral Dis,2002,8(3): 147-159.
[18] Martin TJ, Sims NA. Osteoclast-derived activity in the coupling of bone formation to resorption [J]. Trends Mol Med, 2005,11(2): 76-81.
[19] Raisz, LG. Physiology and pathophysiology of bone remodeling [J]. Clin Chem, 1999,45(8 Pt 2): 1353-1358.
[20] Yamauchi T. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects [J]. Nature,2003,423(6941): 762-769.
[21] Makoto K, Hiroko K, Kenichirou K,etal. Promotion of tracheal cartilage growth by intra-tracheal injection of basic fibroblast growth factor (b-FGF) [J]. J Pediatr Surg,2014,49(2):296-300.
[22] Aleksandar K, Ulrike H, Patricia M,etal. LIM-homeobox gene 2 promotes tumor growth and metastasis by inducing autocrine and paracrine PDGF-B signaling [J]. Mol Oncol,2014,8(2):401-416.
[23] Tracey H, Brent LA. Comparison of cell viability on anorganic bone matrix with or without P-15 cell binding peptide [J]. Biomaterials, 2004,25(19): 4831-4836.
[24] Shin K, Takashi S, Yoshio K,etal. Automatic construction of an anatomical coordinate system for three-dimensional bone models of the lower extremities-Pelvis, femur, and tibia [J]. J Biomech, 2014,47(5): 1229-1233.
[25] Liao W, Yang S, Song C,etal. Construction of ureteral grafts by seeding bone marrow mesenchymal stem cells and smooth muscle cells into bladder a cellular matrix [J]. Transplantation Proc, 2013,45(2): 730-734.
Effect of Proliferation and Differentiation MC3T3-E1 by Two Different Growth Factors in the Bone Substitution
Li Deli1†Li Qing2,3†Wang Tong1Wu Yuwei1Lu Songhe1Hu Hongcheng1Tang Zhihui3*
1(The 2nd Dental Center, Peking University School and Hospital of Stomatology, Beijing 100012, China)2(Center of Digital Dentistry, Peking University School and Hospital of Stomatology, Beijing 100081, China)3(National Engineering Laboratory for Digital and Material Technology of Stomatology, Beijing 100081, China)
More and more scientists focus on the growth factors that can improve the bone regeneration. The aim of the study was to prepare a bone scaffolds, and to investigate underlying molecular mechanisms in promoting osteogenesis on the socket of tooth extraction. Chitosan microspheres carrying two osteogenic factors, BMP-2 or APN, were prepared by emulsion crosslinking, and then were mixed with ceramic bovine bone to form a novel drug delivery system. To compare the biological activity of the grafts, MC3T3-E1 cells were seeded in the scaffold. The influence of the scaffold on cells proliferation and differentiation were investigated. Results show that the average diameter of the chitosan microspheres is 9.634 μm. The scaffolds loading BMP-2 or APN both contributed to the proliferation of osteoblasts MC3T3-E1. Cells seeded in the scaffold loading BMP-2 showed higher proliferation. However, cells seeded in the adiponectin-loading scaffold showed a higher level in the expression of osteogenesis-related proteins and genes compared with those in the BMP-2 loading scaffold.
bone morphogenetic protein-2(BMP-2); adiponectin (APN); MC3T3-E1; drug delivery
10.3969/j.issn.0258-8021. 2015. 03.009
2014-10-10, 录用日期:2015-04-10
首都市民健康项目培育项目(z2110005312001)
R318
A
0258-8021(2015) 03-0323-07
†共同第一作者
*通信作者(Corresponding author), E-mail: tang_zhihui@live.cn

