高纯度人尿促卵泡素与基因重组促卵泡素对超促排卵周期影响比较的Meta分析
张梦苑,卫茂玲,耿丽红,吕兴钰,李霞,田海清,腊晓琳
高纯度人尿促卵泡素与基因重组促卵泡素对超促排卵周期影响比较的Meta分析
张梦苑,卫茂玲,耿丽红,吕兴钰,李霞,田海清,腊晓琳
目的系统评价高纯度人尿促卵泡素应用于超促排卵周期的临床疗效。方法计算机检索PubMed、The Cochrane Library(2014年第7期)、Web of Science、EMBase、中国生物医学文献数据库、中国知网、维普和万方数据库,检索时限为从建库至2014年7月。收集试验组采用高纯度人尿促卵泡素进行超促排卵治疗,对照组采用基因重组促卵泡素进行超促排卵治疗的随机对照试验(RCT)或临床对照试验(CCT)。对纳入文献进行质量评价和数据提取,采用RevMan 5.2软件对两组临床妊娠率、活产率、成熟卵数、获卵数、超促排卵刺激天数进行分析。结果共纳入10篇RCT,4 784例患者。两组临床妊娠率、活产率、成熟卵数、获卵数、超促排卵刺激天数比较,差异均无统计学意义〔OR=1.01,95%CI(0.90,1.14),P=0.83;OR=1.04,95%CI(0.91,1.19),P=0.56;MD=-0.21,95%CI(-0.80,0.38),P=0.49;MD=-0.12,95%CI(-0.82,0.58),P=0.73;MD=-0.40,95%CI (-0.91,0.11),P=0.12〕。敏感性分析结果显示,两组获卵数和超促排卵刺激天数与原结果基本一致,具有较好的稳定性。漏斗图左右呈大致对称,存在发表偏倚的可能性较小。结论高纯度人尿促卵泡素在超促排卵周期中的临床疗效与基因重组促卵泡素相当。但由于受纳入文献数量和质量的限制,有待开展更多高质量、多中心研究加以验证。
促卵泡素,人尿;体外受精;胚胎移植;超排卵;Meta分析;随机对照试验
张梦苑,卫茂玲,耿丽红,等.高纯度人尿促卵泡素与基因重组促卵泡素对超促排卵周期影响比较的Meta分析[J].中国全科医学,2015,18(29):3613-3618.[www.chinagp.net]
Zhang MY,WeiML,Geng LH,et al.Clinical efficacy comparison of high-purity human follicle-stimulating hormone and genetically recombined follicle-stimulating hormone in the cycle of controlled ovarian hyperstimulation:a meta-analysis[J].Chinese General Practice,2015,18(29):3613-3618.
体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)又称试管婴儿技术,包括卵巢刺激、取卵、卵母细胞和精子的培养、胚胎移植、黄体支持。在IVFET周期中,卵巢刺激阶段起着重要作用,是在可控制的范围内给予药物治疗,诱发多个卵泡同时生长发育,以获得更多卵子,提高妊娠率,此阶段又称超促排卵,是治疗女性不孕症极其重要的手段[1]。1980年,澳大利亚Monash大学人类生殖学家首先提出应用药物刺激卵巢超促排卵,以获得较多的卵子,从而提高IVF-ET成功率,至此以后很快获得全球生殖辅助技术领域的共识和推广,使超促排卵成为IVF-ET的重要前提[2]。目前,超促排卵的促卵泡素药物主要有高纯度人尿促卵泡素和基因重组促卵泡素,但临床上关于两种药物的选择仍存在争议。Out等[3]认为,基因重组促卵泡素可获得更多优质胚胎数,但罗艳等[4]认为,高纯度人尿促卵泡素使冷冻胚胎率及胚胎利用率更高。因此临床上有关两种药物在超促排卵中的疗效存在较大争议,且目前国内外关于两种药物在超促排卵治疗中的疗效研究多为回顾性分析,由于研究受到临床病例数量及研究质量的限制,仍缺乏更高等级的证据支撑。因此,本研究采用系统评价的方法,对国内外有关高纯度人尿促卵泡素和基因重组促卵泡素应用于超促排卵周期疗效的对比研究进行综合分析,为临床上提高IVF-ET成功率提供更可靠的循证医学证据。
1 资料与方法
1.1 文献纳入标准采用PICOS原则设计。研究对象(P): (1)年龄≥18岁;(2)卵巢功能正常,基础状态下血清促卵泡生成素(FSH)<10 U/L;(3)月经规律,周期为21~35 d;(4)超促排卵方案为促性腺激素释放激素激动剂方案; (5)民族、国籍不限。干预措施(I):采用高纯度人尿促卵泡素进行超促排卵治疗。对照措施(C):采用基因重组促卵泡素进行超促排卵治疗。结局指标(O):(1)临床妊娠率; (2)活产率;(3)成熟卵数;(4)获卵数;(5)超促排卵刺激天数。研究类型(S):比较超促排卵周期患者使用高纯度人尿促卵泡素和基因重组促卵泡素的随机对照试验(RCT)或临床对照试验(CCT)。限中、英文。
1.2 文献排除标准(1)资料不完整;(2)重复报告、报告信息少等无法利用;(3)研究对象为卵巢囊肿及相关疾病者;(4)高纯度人尿促卵泡素及基因重组促卵泡素联合治疗; (5)文献类型为综述、病例报告。
1.3 文献检索计算机检索PubMed、The Cochrane Library (2014年第7期)、Web of Science、EMBase、中国生物医学文献数据库、中国知网、维普和万方数据库,检索时限为从建库至2014年7月。中文检索词为“高纯度人尿促卵泡素”“体外受精-胚胎移植”“超促排卵”等。英文检索词为“Highpurity follicle-stimulating hormone”“In vitro fertilizationembryo transfer”“Controlled ovarian hyperstimulation”。以PubMed为例,具体检索策略见表1。

表1 PubMed检索策略Table 1 Search strategy in PubMed
1.4 文献筛选与资料提取由2位研究者根据纳入与排除标准独立筛选文献,对结果进行交叉核对,如遇有分歧则通过讨论解决或由第三位研究者裁定。之后使用事先设计的资料提取表提取资料。提取内容包括:(1)一般资料:文题、第一作者姓名、发表时间、文献类型;(2)研究基本特征:患者基本信息、研究干预措施、研究类型等;(3)结局指标,包括临床妊娠率、活产率、成熟卵数、获卵数、超促排卵刺激天数;(4)方法学:随机方法、分配隐藏、盲法等。如果相关文献资料不全,通过邮箱联系作者以补充研究中未描述的相关信息。
1.5 纳入文献的质量评价2名评价员采用Cochrane手册5.1.0针对RCT的偏倚风险评估工具[5]对纳入文献的方法学质量进行评价。包括:(1)是否采用随机方法分组;(2)是否运用分配隐藏;(3)是否采用盲法(研究者、受试者、结局测量者之间);(4)结局数据是否具有完整性;(5)是否无选择性报告结果;(6)是否无其他来源的偏倚。“是”表示偏倚风险较低,“否”表示偏倚风险较高,“不清楚”表示文献未提及或偏倚风险不确定。
1.6 统计学方法采用Cochrane协作网提供的RevMan 5.2软件进行Meta分析,计量资料计算加权均数差(MD),计数资料计算优势比(OR),且各效应量均给出95%CI。采用χ2检验对纳入研究的结果进行异质性检验,若P>0.10,I2<50%时,表示各研究结果间无统计学异质性,采用固定效应模型进行分析;反之,采用随机效应模型进行分析。当存在异质性时,分析其异质性来源,对可能导致异质性的因素进行亚组分析。若异质性源于低质量研究,进一步行敏感性分析比较排除某一项研究后的合并效应量。若异质性过大,则仅采用描述性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果初检出相关文献327篇,经2位研究人员逐层筛选后,最终纳入10篇[6-15]文献,均为RCT,包括4 784例患者,其中试验组2 747例,对照组2 037例。文献筛选流程见图1。纳入文献的基本特征见表2。
2.2 质量评价纳入的文献中有8篇[7-13,15]文献提及并描述了随机方法;2篇文献[8-9]采用分配隐藏;2篇文献[9,11]采用盲法(见表3)。
2.3 Meta分析结果
2.3.1 临床妊娠率共9篇文献[6-10,12-15]报道了临床妊娠率。共纳入4 714例患者,其中试验组2 712例,对照组2 002例。各文献间无统计学异质性(I2=0,P=0.99),采用固定效应模型进行分析。Meta分析结果显示,两组临床妊娠率比较,差异无统计学意义〔OR=1.01,95%CI(0.90,1.14),P= 0.83,见图2〕。
2.3.2 活产率共7篇文献[6,8-12,15]报道了活产率。共纳入4 117例患者,其中试验组2 398例,对照组1 719例。各文献间无统计学异质性(I2=0,P=0.87),采用固定效应模型进行分析。Meta分析结果显示,两组活产率比较,差异无统计学意义〔OR=1.04,95%CI(0.91,1.19),P=0.56,见图3〕。

图1 文献筛选流程图Figure 1 Flow chart of literature screening
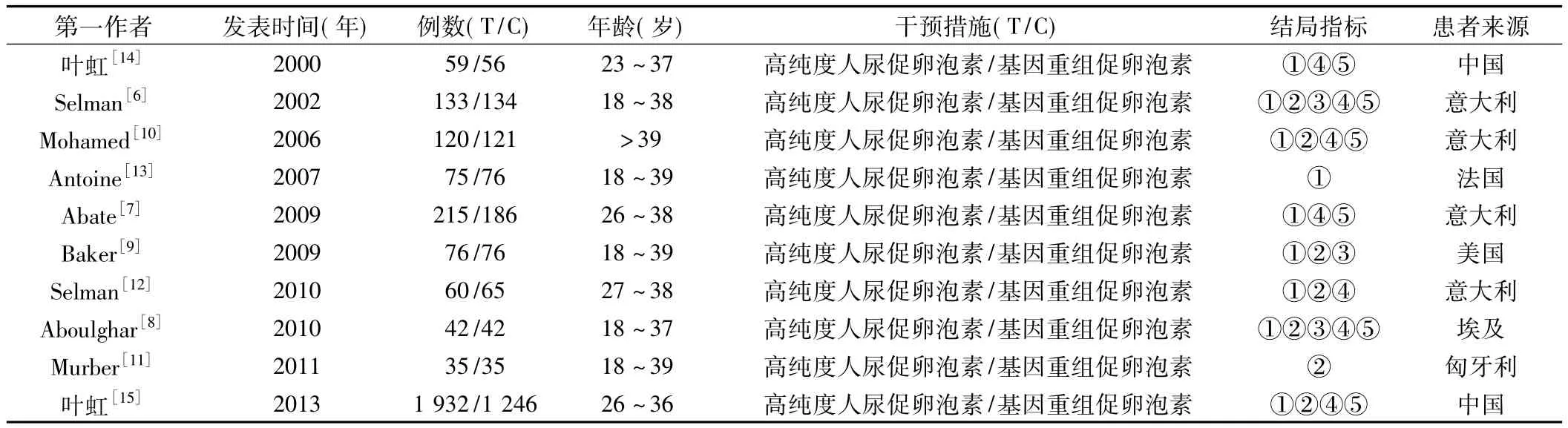
表2 纳入文献的基本特征Table 2 Basic characteristics of included literatures

表3 纳入文献质量评价Table 3 Quality assessment for eligible studies
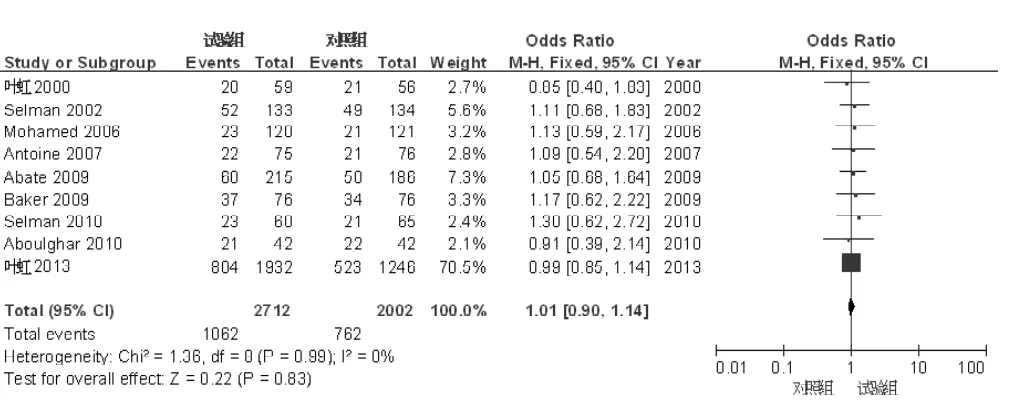
图2 试验组和对照组临床妊娠率比较的森林图Figure 2 Forest plot of the comparison of clinical pregnancy rate between trial group and control group
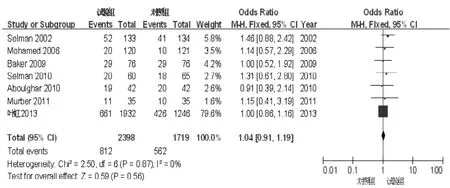
图3 试验组和对照组活产率比较的森林图Figure 3 Forest plotof the comparison of live birth rate between trial group and control group
2.3.3 成熟卵数共3篇文献[6,8-9]报道了成熟卵数。共纳入503例患者,其中试验组251例,对照组252例。各文献间无统计学异质性(I2=33%,P=0.23),采用固定效应模型进行分析。Meta分析结果显示,两组成熟卵数比较,差异无统计学有意义〔MD=-0.21,95%CI(-0.80,0.38),P= 0.49,见图4〕。

图4 试验组和对照组成熟卵数比较的森林图Figure 4 Forest plot of the comparison of the number of mature ovums between trial group and control group
2.3.4 获卵数共7篇文献[6-8,10,12,14-15]报道了获卵数。共纳入4 411例患者,其中试验组2 561例,对照组1 850例。各文献间存在统计学异质性(I2=85%,P<0.01),采用随机效应模型进行分析。Meta分析结果显示,两组获卵数比较,差异无统计学意义〔MD=-0.12,95%CI(-0.82,0.58),P =0.73,见图5〕。
2.3.5 超促排卵刺激天数共6篇文献[6-8,10,14-15]报道了超促排卵刺激天数。共纳入4 286例患者,其中试验组2 501例,对照组1 785例。各文献间存在统计学异质性(I2=93%,P<0.01),采用随机效应模型进行分析。Meta分析结果显示,两组超促排卵刺激天数比较,差异无统计学意义〔MD=-0.40,95%CI(-0.91,0.11),P=0.12,见图6〕。
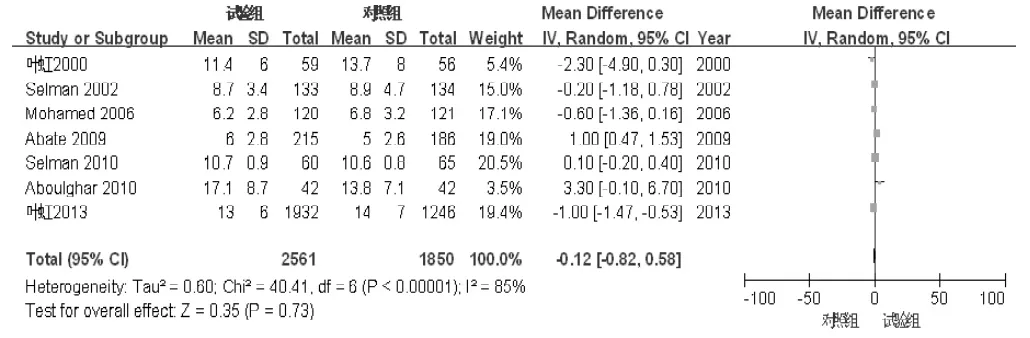
图5 试验组和对照组获卵数比较的森林图Figure 5 Forest plot of the comparison of the number of retrieved oocytes between trial group and control group
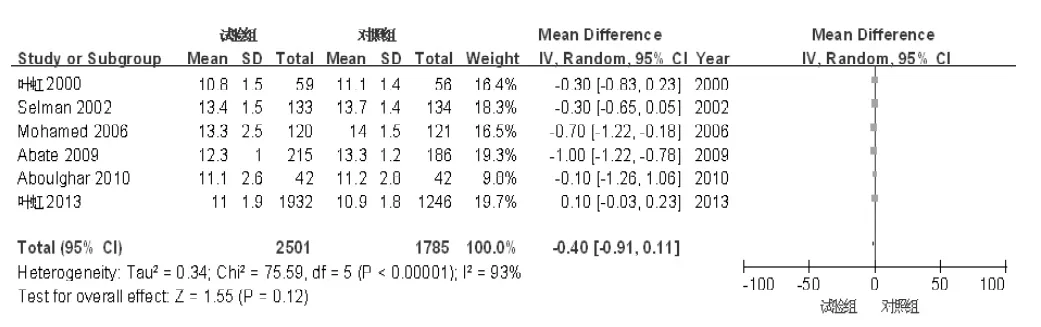
图6 试验组和对照组超促排卵刺激天数比较的森林图Figure 6 Forest plot of the comparison of Gn stimulation days between trial group and control group
2.4 敏感性分析两种药物的获卵数和超促排卵刺激天数存在明显异质性,故在此项Meta分析中,剔除其中权重最大的文献,并且在RevMan 5.2软件中选择不同的统计模型,结果显示,两组获卵数〔MD=-0.17,95%CI(-1.17,0.84),P=0.75〕和超促排卵刺激天数〔MD=-0.23,95%CI (-0.57,0.10),P=0.17〕与原结果基本一致,具有较好的稳定性。
2.5 发表偏倚对有关活产率的文献绘制漏斗图,结果显示,散点主要分布在无效线的两侧,左右呈大致对称,表明存在发表偏倚的可能性较小(见图7)。
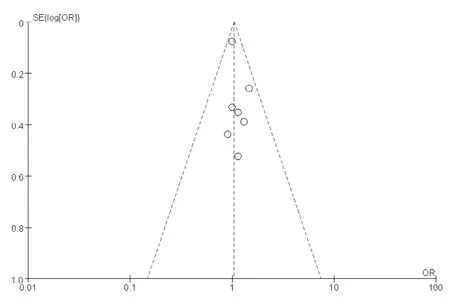
图7 活产率发表偏倚的漏斗图Figure 7 Funnel plot of the publication bias of live birth rate
3 讨论
超促排卵周期中,促卵泡素是主要的垂体促性腺激素,因此促卵泡素发挥着极其重要的作用。在超促排卵阶段,使用促性腺激素在卵泡的募集阶段提高外周血中促性腺激素的水平,使之超过募集前阶段的卵泡进入募集所需的阈值,从而达到多个卵泡同步发育的目的,促使更多的卵泡能够克服卵泡的选择机制而继续发育成为成熟卵泡,从而达到超促排卵的目的,以利于回收更多的卵子,提高辅助生殖技术的成功率[16]。目前,促卵泡素主要分为高纯度人尿促卵泡素及基因重组促卵泡素两大类。但在临床上,关于两种药物在超促排卵中的临床疗效,一直具有争议。Mohamed等[10]对121例用重组促卵泡激素治疗的患者和120例用高纯度人源促卵泡激素治疗的患者,进行疗效研究,高纯度人源促卵泡激素与基因重组促卵泡素相比,更利于卵泡的生长及募集。而Frydman等[17]认为,基因重组促卵泡素在超促排卵中能获得更多的卵子和更多可移植胚胎。
基因重组促卵泡素是从中国仓鼠卵巢细胞(CHO)中培养出来,将一种抗体特异性结合促卵泡素的免疫层析纯化,获得恒定的促卵泡素同工型构成以及高特异性活性高纯度制剂,但不含黄体生成素(LH)的活性。基因重组促卵泡素可促进次级窦前卵泡发育、颗粒细胞分裂,诱导产生芳香化酶及排卵前的颗粒细胞内的LH受体,并且使卵泡细胞膜分化,优化卵泡的募集和筛选,但导致卵巢过度刺激综合征(OHSS)的风险较高[18]。高纯度人尿促卵泡素是提取于绝经妇女的尿液,经过复杂的生产以及加工以去除无关蛋白,具有FSH及LH的活性。高纯度人尿促卵泡素在卵泡刺激过程中可加快进入窦状卵泡期生长速度,降低成熟卵泡的损失和HCG日小卵泡的数目以降低OHSS的发生,使植入率更高,及冷冻胚胎的效果更好,但在卵泡早期生长速率较慢,卵泡的募集数量较少[18]。
本研究结果显示,高纯度人尿促卵泡素与基因重组促卵泡素在临床妊娠率、活产率、成熟卵数、获卵数以及超促排卵刺激天数间均无差异。其中对获卵数和超促排卵刺激天数进行了敏感性分析,结果显示与原结果基本一致,表明高纯度人尿促卵泡素具有基因重组促卵泡素的同等疗效。分析原因可能为: (1)Marrs等[19]研究表明,针对高龄(>35岁)患者,予以少量的LH可利于促排卵泡。高纯度人尿促卵泡素则具有少量的LH活性(每75单位FSH含有<1单位LH)。(2)FSH具有不同的亚型分类,高纯度人尿促卵泡素具有酸性亚型,基因重组促卵泡素为低酸性亚型。酸性亚型FSH可更好地促使卵泡成熟,以及雌二醇的分泌,从而提高卵母细胞的受精率及可移植胚胎率[20]。(3)高纯度人尿促卵泡素较基因重组促卵泡素具有更高的糖基化程度,使其具有更高的FSH阈值、更长的半衰期及较低的生物活性。这些特性可促进优势卵泡的募集[15]。
本研究也存在一定的局限性,包括:(1)纳入的多数文献未具体提及盲法的使用,其中一部分未描述分配隐藏的方法,因此有存在实施及测量偏倚、选择性偏倚的可能;(2)纳入文献中采用药物的剂量和用药时间等并不全相同,存在临床异质性;(3)评价指标不足;(4)由于原始文献中经济学指标数据缺乏,本研究未能进行系统评价。
综上所述,高纯度人尿促卵泡素与基因重组促卵泡素在临床上有同等的疗效,且价格较基因重组促卵泡素低。尽管目前有文献[20]也系统评价高纯度人尿促卵泡素的疗效,但是纳入人群主要为欧洲及美洲,未对亚洲乃至我国人群进行纳入比较。本研究纳入了我国研究人群,具有较好的外推性,故为我国医师指导临床提供了可供选择的决策。
[1]杨增武.计划生育实用技术[M].北京:科学出版社,2009:143.
[2]陈子江.人类生殖与辅助生殖[M].北京:科学出版社,2005:410.
[3]Out HJ,Mannaerts BM,Driessen SG,et al.A prospective,randomized,assessor-blind,multicentre study comparing recombinant and urinary follicle stimulating hormone(Puregon versus Metrodin)in in-vitro fertilization[J].Hum Reprod,1995,10 (10):2534-2540.
[4]Luo Y,Hu R,Wang FM,et al.Analysis on the effect of highly purified urinary FSH recombinant FSH,and urinary FSH in IVFICSI/ET undergoing the controlled ovarian hyperstimulation[J].Ningxia Medical Journal,2011,33(9):822-825.(in Chinese)
罗艳,胡蓉,王飞苗,等.福特蒙、果纳芬和丽申宝在体外受精-胚胎移植中超促排卵效果分析[J].宁夏医学杂志,2011,33 (9):822-825.
[5]Higgins JPT,Green S.The Cochrane Collaboration's tool for assessing risk of bias.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0:Section 8[EB/OL].The Cochrane Collaboration,2013.Available at:www.cochranehandbook.org.
[6]Selman HA,De Santo M,Sterzik K,et al.Effect of highly purified urinary follicle-stimulating hormone on oocyte and embryo quality[J].Fertil Steril,2002,78(5):1061-1067.
[7]Abate A,Nazzaro A,Salerno A,et al.Efficacy of recombinant versus human derived follicle stimulating hormone on the oocyte and embryo quality in IVF-ICSI cycles:randomized,controlled,multi-centre trial[J].Gynecol Endocrinol,2009,25(8):479-484.
[8]Aboulghar M,Saber W,Amin Y,et al.Prospective,randomized study comparing highly purified urinary follicle-stimulating hormone (FSH)and recombinant FSH for in vitro fertilization/intracytoplasmic sperm injection in patientswith polycystic ovary syndrome[J].Fertil Steril,2010,94(6):2332-2334.
[9]Baker VL,Fujimoto VY,Kettel LM,et al.Clinical efficacy of highly purified urinary FSH versus recombinant FSH in volunteers undergoing controlled ovarian stimulation for in vitro fertilization:a randomized,multicenter,investigator-blind trial[J].FertilSteril,2009,91(4):1005-1011.
[10]Mohamed MA,Sbracia M,Pacchiarotti A,et al.Urinary folliclestimulating hormone(FSH)ismore effective than recombinant FSH in olderwomen in a controlled randomized study[J].Fertil Steril,2006,85(5):1398-1403.
[11]Murber A,Fancsovits P,LedóN,et al.Impact of highly purified versus recombinant follicle stimulating hormone on oocyte quality and embryo development in intracytoplasmic sperm injection cycles[J].Acta Biol Hung,2011,62(3):255-264.
[12]Selman H,Pacchiarotti A,El-Danasouri I.Ovarian stimulation protocolsbased on follicle-stimulating hormone glycosylation pattern: impact on oocyte quality and clinical outcome[J].Fertil teril,2010,94(5):1782-1786.
[13]Antoine JM,Mouzon J,Nicollet B,et al.Effectiveness and tolerability of hFSH compared to rFSH in ICSI:the European study[EB/OL].http://www.ibsa.ch/it/eshre_2007_lyon_ abstracts-3.pdf.
[14]叶虹,黄国宁.人基因重组促卵泡生长激素与高纯度人尿促卵泡生长激素在控制性排卵中的疗效比较[J].中华妇产科杂志,2000,35(9):562-563.
[15]Ye H,Huang GN,Cao YX,et al.Effect of domestic highly purified urinary follicle stimulating hormone on outcomes of in vitro fertilization-embryo transfer in controlled ovarian stimulation[J].Chinese Journal of Obstetrics and Gynecology,2013,48(11): 838-842.(in Chinese)
叶虹,黄国宁,曹云霞,等.尿源性高纯度FSH在控制性促排卵中对IVF-ET结局的影响[J].中华妇产科杂志,2013,48 (11):838-842.
[16]庄广伦.现代辅助生殖技术[M].北京:人民卫生出版社,2005:109-110.
[17]Frydman R,Howles CM,Truong F.A double-blind,randomized study to compare recombinant human follicle stimulating hormone (FSH;Gonal-F)with highly purified urinary FSH(Metrodin HP) in women undergoing assisted reproductive techniques including intracytoplasmic sperm injection.The French Multicentre Trialists[J].Hum Reprod,2000,15(3):520-525.
[18]罗世芳.排卵障碍性不孕症诊断与治疗[M].北京:中国医药科技出版社,2012:39-40.
[19]Marrs R,Meldrum D,Muasher S,et al.Randomized trial to compare the effectof recombinant human FSH(follitropin alfa)with or without recombinant human LH in women undergoing assisted reproduction treatment[J].Reprod Biomed Online,2004,8 (2):175-182.
[20]Gerli S,Bini V,Favilli A,et al.Clinical efficacy and costeffectiveness of HP-human FSH(Fostimon®)versus rFSH (Gonal-F®)in IVF-ICSI cycles:a meta-analysis[J].Gynecol Endocrinol,2013,29(6):520-529.
Clinical Efficacy Com parison of H igh-purity Human Follicle-stimulating Hormone and Genetically Recombined Follicle-stimulating Hormone in the Cycle of Controlled Ovarian Hyperstimulation:A Meta-analysis
ZHANGMeng-yuan,WEIMao-ling,GENG Li-hong,et al.Maternal and Child Care Service Centreof Jinjiang District,Chengdu 610000,China
Objective To systematically review the clinical efficacy of high-purity follicle-stimulating hormone in the cycle of controlled ovarian hyperstimulation(COH).M ethods Wemade computer retrieval from PubMed,The Cochrane Library(Issue 7,2014),Web of Science,EMBase,CBM,CNKI,VIP and Wanfang Data.The searching time range was set from database establishment to July 2014.Through the retrieval,we collected literatures about randomized controlled studies (RCT)or clinical controlled trical(CCT)which the trial group was administrated with COH by using high-purity folliclestimulating hormone and the control group was administrated with COH by using genetically recombined follicle-stimulating hormone.Qualify evaluation and data extraction were conducted on the included literatures.RevMan 5.2 software was used to analyze clinical pregnancy rate,live birth rate,the number ofmature ovums,the number of retrieved oocytes and the number of COH days.Results We included 10 pieces of RCT literatures,concerning with 4 784 patients.The two groups were not significantly different in clinical pregnancy rate,live birth rate,the number ofmature ovums,the number of retrieved oocytes and the number of COH days〔OR=1.01,95%CI(0.90,1.14),P=0.83;OR=1.04,95%CI(0.91,1.19),P= 0.56;MD=-0.21,95%CI(-0.80,0.38),P=0.49;MD=-0.12,95%CI(-0.82,0.58),P=0.73;MD=-0.40,95%CI(-0.91,0.11),P=0.12〕.The sensitivity analysis showed that the number of retrieved oocytes and thenumber of COH days of the two groups were basically the same with original results,which indicated good stability.The funnel plotwas generally symmetrical on two sides,indicating small possibility in publication bias.Conclusion Compared with genetically recombined follicle-stimulating hormone,high-purity follicle-stimulating hormone has same efficacy in the cycle of COH.However,due to the limited number and quality of included literatures,more high-quality and multi-center researches need to be carried out to verify the results of the study.
Follicle-stimulating hormone,human urine;In vitro fertilization;Embryo transfer;Superovulation; Meta-analysis;Randomized controlled trial
R 321.1 R 347.913
A
10.3969/j.issn.1007-9572.2015.29.025
2014-12-17;
2015-08-04)
(本文编辑:贾萌萌)
新疆维吾尔自治区自然科学基金资助项目(2013211A087)
610000四川省成都市锦江区妇幼保健院(张梦苑,耿丽红,吕兴钰);四川大学循证医学中心(卫茂玲);新疆医科大学第一附属医院妇科生殖助孕中心(李霞,田海清,腊晓琳)
腊晓琳,830054新疆乌鲁木齐市,新疆医科大学第一附属医院妇科生殖助孕中心;E-mail:xiaolinla@hotmail.com

