天花粉蛋白通过下调p-ERK及Cyclin D1表达抑制PC3细胞增殖
黄益玲 胡火军 尤程程 黄迎娣 黄利鸣 (三峡大学医学院病理学系,湖北 宜昌 443002)
天花粉蛋白(TCS)是一种单链核糖体失活蛋白,从葫芦科植物栝蒌的块根中提取出来。TCS早期主要用于引发中期流产,近年研究表明,TCS有多种生物学活性,能够抑制人获得性免疫缺陷病毒复制、调节人体免疫功能、抑制肿瘤细胞生长〔1〕。关于TCS对人前列腺癌的抑制作用尚未见报道。本实验主要研究TCS在体外对前列腺癌细胞(PC3细胞)的增殖抑制作用及其可能机制。
1 材料和方法
1.1 细胞与主要试剂 RPMI1640培养基和胎牛血清(FBS)购自美国Gibco公司,噻唑蓝(MTT)购于美国Amresco公司,碘化丙啶(PI)及RNA酶(RNase A)购自Sigma公司,一抗ERK、p-ERK、Cyclin D1购自 Cell Signal公司,β-actin、二抗 HRP 标记的IgG抗体购于Santa Cruz公司,TCS购自上海金山制药厂。
1.2 细胞培养 PCa PC3细胞为本实验室传代保存,培养于含10%的RPMI1640培养基,置于37℃、5%CO2的湿化孵箱中常规培养。
1.3 MTT法测定TCS对PC3细胞的增殖抑制作用 取对数生长期的PC3细胞,以2×104个/ml的密度接种于96孔板,细胞贴壁 后 加 入 不 同 浓 度 的 TCS(0、20、40、60、80、100、120 μg/ml),每个浓度设置6个复孔,继续培养 24、48、72 h 后每孔加入5g/L的 MTT溶液 20 μl,继续培养4 h后加入200 μl DMSO溶解,测定570 nm处光吸收值,计算细胞生长抑制率。
1.4 流式细胞术检测细胞周期 离心收集经TCS处理的PC3细胞,用含0.2%FBS的PBS清洗,加75%的冰冷乙醇固定,10000 r/min条件下离心5 min,去乙醇,以PBS洗涤两次,弃上清。用0.5 ml PBS重悬细胞沉淀,加入等体积的细胞裂解缓冲液(1%NP-40,50 mmol/L Tris-HCl,40 mmol/L EDTA,pH 值7.5)室温作用5~10 min,离心后加入终浓度为30 μg/ml的RNase于37℃水浴中消化 30 min,离心,10000 r/min离心5 min,加人1 ml终浓度为50 μg/ml的 PI避光染色 30 min,上流式细胞仪检测,Multicycles软件分析结果。
1.5 Western印迹检测 离心收集经不同浓度TCS处理的PC3细胞,加入适量的细胞裂解液(注意临用前加入各种蛋白酶抑制剂)提取蛋白,BCA法测定蛋白浓度,保证样本中含有相同的蛋白含量,置95℃ ~100℃沸水中变性5 min,加入等体积2×SDS-PAGE加样缓冲液行12.5%的SDS-PAGE垂直电泳,电转至PVDF膜,加50 g/L脂奶粉于室温封闭1 h,PBST洗膜,分别加入一抗ERK、p-ERK、cyclin D1及β-actin于4℃孵育过夜,PBST洗涤3次,加入辣根过氧化物酶标记的二抗室温孵育1 h,再用TBST洗涤3次,ECL反应液A和B混合后加至膜上1 min,最后X片显影。
1.6 统计学方法 应用SPSS14.0软件行单因素方差分析。
2 结果
2.1 MTT法测定TCS对PC3细胞增殖的抑制作用 1 d TCS对PC3细胞的生长抑制作用随其浓度的增大而加强,与未加药物的对照组相比,差异有显著性(P<0.01)。见表1。
表1 不同浓度TCS作用24、48、72 h对PC3细胞增殖的抑制作用(±s,n=3)
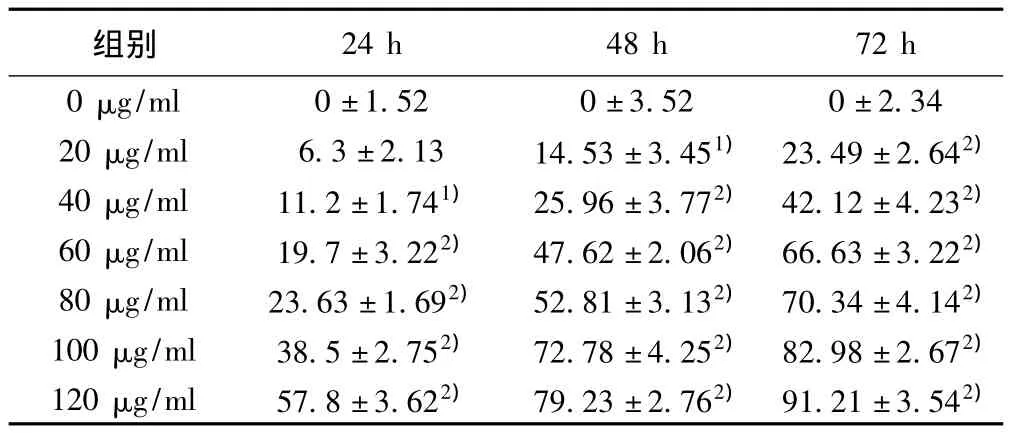
表1 不同浓度TCS作用24、48、72 h对PC3细胞增殖的抑制作用(±s,n=3)
与0 μg/ml组比较:1)P <0.05,2)P <0.01
g/ml 0±1.520±3.520±2.3420 μg/ml 6.3±2.1314.53±3.451) 23.49±2.642)40 μg/ml 11.2±1.741) 25.96±3.772) 42.12±4.232)60 μg/ml 19.7±3.222) 47.62±2.062) 66.63±3.222)80 μg/ml 23.63±1.692) 52.81±3.132) 70.34±4.142)100 μg/ml 38.5±2.752) 72.78±4.252) 82.98±2.672)120 μg/ml 57.8±3.622) 79.23±2.762) 91.21±3.542)24 h 48 h 72 h 0 μ组别
2.2 TCS对PC3细胞周期的影响 流式细胞仪检测经20、40、80 μg/ml TCS作用24 h后PC3细胞周期情况,结果显示,处于G1期的细胞比例分别为(37.4±0.45)%、(42.1±0.25)%、(59.9±0.09)%,与TCS未处理组(29.9±0.25)%相比差异显著,表明TCS能引起PC3细胞发生G1期阻滞。
2.3 Western印迹检测ERK、p-ERK、Cyclin D1表达 以β-actin为内参,经 20、40、80 μg/ml TCS 处理 PC3 细胞 24 h 后,p-ERK的表达受到抑制,且抑制作用随药物浓度的增加而加强,而Cyclin D1的表达呈明显下降趋势,见图1。
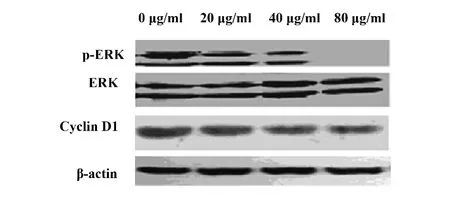
图1 TCS对P-ERK、ERK及Cyclin D1表达的影响
3 讨论
部分前列腺癌患者发现时已发生侵袭和转移〔2〕,晚期前列腺癌患者平均经过2年的内分泌治疗后会进展为激素难治性TCS(HRPC)〔3〕,化疗是激素难治性前列腺癌的主要治疗手段。
细胞过度增殖会导致疾病的发生,甚至肿瘤的形成。抑制信号转导通路中某一信号转导分子的表达从而阻断异常活化的信号转导通路是肿瘤治疗的策略之一。丝裂原活化蛋白激酶信号转导通路存在于大多数细胞中,将细胞外刺激信号转导至细胞内,引起细胞增殖、分化、凋亡等一系列重要生化反应〔4〕。ERK信号通路是 1993 年由 Her等〔5〕人发现的一条MAPK信号通路。ERK1/2亚功能区中的酪氨酸和苏氨酸残基可发生磷酸化激活,激活的ERK1/2由胞质移位至细胞核后磷酸化一系列转录因子〔6〕,调控细胞的增殖和分化过程。细胞周期是细胞生命活动中的重要过程,其关键是G1期的启动。Cyclin D1是Fu等〔7〕从甲状旁腺腺瘤中克隆、鉴定出来的一种细胞周期蛋白。研究发现,Cyclin D1是调控细胞周期G1期的关键蛋白,Cyclin D1过表达可导致G1期缩短,降低细胞对外源性有丝分裂刺激的依赖性〔8〕,使肿瘤细胞不依赖于细胞外生长信号的刺激而反复自发进行细胞周期循环。
TCS在临床上主要用于引产及宫外孕、葡萄胎、绒癌等疾病的治疗,因其具有N糖苷酶活性,使核糖体发生不可逆性失活而抑制蛋白质的合成〔9〕,体外实验发现TCS对结肠癌、肺癌、黑色素瘤等肿瘤细胞的生长具有明显的抑制作用〔1〕。本课题组前期研究发现,TCS能通过诱导凋亡抑制宫颈癌Hela细胞的生长〔10〕。本实验显示TCS能明显抑制PC3细胞生长,随着药物浓度的增加及作用时间的延长,TCS对PC3细胞的生长抑制作用逐渐增大,具有时间及剂量依赖性。TCS抑制Pca细胞增殖的可能机制为TCS能抑制ERK磷酸化从而抑制ERK-MAPK信号通路活性,TCS诱导的G1期阻滞与前列腺癌抑制细胞周期调节蛋白Cyclin D1的表达有关。对前列腺癌抗癌机制的进一步研究,有望使其应用于前列腺癌等肿瘤的临床治疗。
1 Shawp C,Lee KM,Wong KB.recent advances in trichosanthin,a ribosome-inactivating protein with multiple pharmacological properties〔J〕.Toxicon,2005;45(6):683-9.
2 杨裕华,王际莘,贺法宪.前列腺癌二级预防研究进展〔J〕.中国老年学杂志,2011;31(2):722-5.
3 Shen MM,Abate-Shen C.Molecular genetics of prostate cancer:new prospects for old challenges〔J〕.Genes Dev,2010;24(18):1967-2000.
4 Kim EK,Choi EJ.Pathological roles of MAPK signaling pathways in human diseases〔J〕.Biochim Biophys Acta,2010;1802(4):396-405.
5 Her JH,Lakhani S,Zu K,et al.Dual phosphorylation and autophosphorylation in mitogen-activated protein(MAP)kinase activation〔J〕.Biochem J,1993;296(1):25-31.
6 De Luca A,Maiello MR,DAlessio A,et al.The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways:role in cancer pathogenesis and implications for therapeutic approaches〔J〕.Expert Opin Ther Targets,2012;16(2):17-27.
7 Fu M,Wang C,Li Z,et al.Cyclin D1:normal and abnormal functions〔J〕.Endocrinology,2004;145(12):5439-47.
8 Seo JH,Jeong ES,Choi YK.Therapeutic effects of lentivirus-mediated shRNA targeting of cyclin D1 in human gastric cancer〔J〕.BMC Cancer,2014;14:175-80.
9 汪 猷,金善炜.天花粉蛋白〔M〕.第2版.北京:科学出版社,2000:158.
10 黄益玲,胡火军,黄利鸣,等.天花粉蛋白诱导人宫颈癌Hela细胞凋亡的分子机制研究〔J〕.中国药理学通报,2007;23(1):99-101.
〔2014-12-03修回〕

