cT1-2N0期乳腺癌腋窝淋巴结转移相关因素分析
崔竹山,杜 烨,朱 珠,高 品,李佳娓,范志民
(吉林大学第一医院乳腺外科,吉林 长春 130021)
cT1-2N0期乳腺癌腋窝淋巴结转移相关因素分析
崔竹山,杜烨,朱珠,高品,李佳娓,范志民
(吉林大学第一医院乳腺外科,吉林 长春 130021)
目的:探讨cT1-2N0期乳腺癌患者临床及病理因素与腋窝淋巴结转移的关系,阐明乳腺癌腋窝淋巴结转移规律,发现乳腺癌腋窝淋巴结转移的危险因素,为乳腺癌个体化治疗提供理论依据。方法:选取cT1-2N0期乳腺癌患者687例,根据腋窝淋巴结病理结果分为阴性组和阳性组,对临床及病理特征进行分层,采用χ2检验及Logistic回归分析筛选出预测乳腺癌腋窝淋巴结转移的危险因素。结果:687例cT1-2N0期乳腺癌患者中,有腋窝淋巴结转移者156例(22.7%)。单因素分析,年龄、cT分期、pT分期、病理分型、脉管浸润、神经浸润、雌激素受体(ER)、孕激素受体(PR)和分子分型等因素与腋窝淋巴结转移有关。多因素分析,年龄<35岁(r=3.440,P=0.010)、cT2(r=1.770,P=0.007)、浸润性导管癌(r=3.397,P=0.001)、脉管浸润(r=7.434,P=0.000)和Luminal型(r=2.212,P=0.015)是预测腋窝淋巴结转移的独立危险因素。 结论:cT1-2N0期乳腺癌患者中,年龄、cT分期、病理分型、脉管浸润和分子分型是腋窝淋巴结是否存在转移的危险因素,其中有无脉管浸润最为重要,术前全面分析和评估临床资料及术前获得的病理结果将有助于正确选择手术术式。
乳腺肿瘤;肿瘤分期;腋窝淋巴结转移;超声诊断;脉管浸润;Luminal型
腋窝淋巴结清扫术(axially lymph node dissection, ALND)是乳腺癌外科治疗的重要组成部分之一,其目的是为肿瘤分期、指导治疗和判断预后提供信息。随着影像学和活检技术的发展和普及,术前了解腋窝淋巴结状况已成为可能。前哨淋巴结活检 (sentinel lymph node biopsy, SLNB) 技术的应用及Z0011试验结果的问世[cT1-2N0期乳腺癌患者,接受保乳术和术后全乳放疗,有1或2枚前哨淋巴结(SLN)阳性且不行ALND也并不对其复发和长期生存产生影响],还有正在进行中的腋窝超声检查后前哨淋巴结活检对比观察(sentinel nodevsobservation after axillary ultrasound,SOUND)试验,撼动了ALND的“金标准”地位[1-2],可能对ALND能否获得区域控制和远期疗效的这一长期争议找到答案。目前国内外对cT1-2N0期乳腺癌在腋窝淋巴结超声诊断为阴性这一前提下的研究未见相关报道,本研究拟通过探讨cT1-2N0期乳腺癌患者临床及病理因素与存在腋窝淋巴结转移的关系,阐明在超声诊断为阴性前提下乳腺癌腋窝淋巴结的转移规律,发现乳腺癌腋窝淋巴结转移的危险因素,为其提供选择正确的腋窝处理方式,从而指导乳腺癌患者的个体化治疗。
1 资料与方法
1.1一般资料回顾性分析本科室于2006年1月—2013年12月收治的2 378例原发性乳腺癌患者的临床病理资料,其中符合入组标准者共687例(28.9%)。入组标准:cT1-2期、腋窝临床查体和超声检查阴性、无远处转移的原发性乳腺癌患者。所有入组患者均于术前接受腋窝超声检查,并排除腋窝检查结果为阳性、行术前腋窝淋巴结穿刺活检或接受新辅助治疗者。保乳术、乳房全切术及一期重建分别为152例、530例和5例,261例行SLNB,其中59例因SLN阳性而接受补充性腋窝淋巴结清扫术(complementary axially lymph node dissection,CALND),426例接受ALND。术后病理:531例腋窝淋巴结为阴性,5例为孤立细胞团,12例微转移,139例宏转移, 腋窝淋巴结转移率为22.7%(156/687)。临床病理特征包括年龄、病灶分布、cT分期、pT分期、病理分型、脉管浸润、神经浸润、雌激素受体(ER)、孕激素受体(PR)、HER-2、Ki-67和分子分型等。见表1。术后给予常规辅助治疗。
1.2超声仪器、检查方法和诊断标准东芝Aplio XG 790彩色超声诊断系统,线阵探头频率4~9 MHz。受检者仰卧,双上肢外展,双手置于头部,充分暴露双侧腋窝后扫查; 观察指标包括淋巴结形态、长短径、皮质形态、皮质最宽处厚度、淋巴门结构、淋巴结内部及周边血流分布。超声诊断阴性淋巴结特点:肾形,皮质呈薄而均一的低回声,淋巴结门呈内凹形的脂肪样高回声,长径长度通常是短径长度的2倍,最大径通常小于2 cm[3]。超声诊断阳性淋巴结特点:整体呈饱满圆球形的明显低回声,纵横比缩小,脂肪样淋巴结门模糊不清、消失或被取代,正常的门型血流分支受压,形成周边型或混合型血流,皮质增厚>3 mm、呈不对称性或偏心性、不规则或分页状低回声,边界不清或带有毛刺,通常增大或相互融合,周边水肿[3-6]。
1.3病理检查方法和诊断标准术前用巴德针或麦默通旋切刀穿取乳腺肿物组织进行术前病理检查,SLN结定位选用蓝染料和/或锝99硫胶体法,术中切除SLN为冰冻切片检查。ER、PR、HER-2和Ki-67的表达由免疫组织化学方法判断。本研究将ER或PR>1% 为激素受体表达阳性; Ki-67以14%为界值; 定义HER-2(-)或HER-2(+)为阴性,HER-2 (和)为阳性, 采用FISH法进行判断。HE染色法判断为阴性的淋巴结再采用免疫组织化学方法判断,>2.0 mm为宏转移,0.2~2.0 mm为微转移,<0.2 mm为孤立细胞团,本研究均定义为淋巴结阳性。
1.4统计学分析采用 SPSS 19.0 软件进行统计学分析。计数资料组间比较采用χ2检验。利用χ2检验分析影响腋窝淋巴结转移的临床病理特征。利用Logistic回归分析分析临床病理特征对腋窝淋巴结发生转移的风险。选用赋值方法:腋窝淋巴结 (阳性为1,阴性为0),年龄 ( <35 岁为 1,≥35 岁为 2),病灶分布 (乳头乳晕区为1,多中心为2,单个象限为3),cT分期( cT2为1,cT1为2),pT分期 pT(pT1c2为1,pT0-1b为2),病理分型 (浸润性导管癌为1,非浸润性导管癌为2),组织学分级 ( 2~3级为1,1级为2),核分级MBNG ( 2~3级为1,1级为2),脉管浸润(有为1,无为2),神经浸润(有为1,无为2),ER(阳性为1,阴性为2),PR( 阳性为1,阴性为2),HER-2(阴性为1,阳性为2),K-i67(≥14%为1,<14%为2),分子分型(Luminal型为1,非Luminal型为2)。以P<0.05为差异有统计学意义。
2 结 果
2.1乳腺癌临床病理特征与腋窝淋巴结转移的单因素分析①年龄与腋窝淋巴结转移的关系:本组患者中,年龄<35岁者转移率较高,组间比较差异有统计学意义(P=0.023) 。②病灶分布与腋窝淋巴结转移的关系:本组患者中,组间比较差异无统计学意义(P=0.376) 。③临床T分期及病理T分期与腋窝淋巴结转移的关系:本组患者中,cT2者转移率较高,组间比较差异有统计学意义(P=0.001) ;pT1c2者转移率较高,组间比较差异有统计学意义(P<0.001)。④病理分型与腋窝淋巴结转移的关系:本组患者中,浸润性导管癌与浸润性小叶癌转移率较高,组间比较差异有统计学意义(P<0.001) 。⑤组织分级、核分级与腋窝淋巴结转移的关系:本组患者中,组织分级组间比较差异无统计学意义(P=0.061) ;核分级组间比较差异无统计学意义(P=0.398)。⑥脉管浸润、神经浸润与腋窝淋巴结转移的关系:本组患者中,有脉管浸润者转移率较高,组间比较差异有统计学意义(P<0.001);有神经浸润者转移率较高,组间比较差异有统计学意义(P=0.018)。⑦ER、PR、Her-2、 Ki-67和分子分型与腋窝淋巴结转移的关系:本组患者中,ER阳性者转移率较高,组间比较差异有统计学意义(P<0.001);PR阳性者转移率较高,组间比较差异有统计学意义(P<0.001);HER-2组间比较差异无统计学意义(P=0.316);Ki-67组间比较差异无统计学意义(P=0.372);Luminal型者转移率较高,组间比较差异有统计学意义(P<0.001)。
2.2临床病理特征与腋窝淋巴结转移的多因素分析年龄<35岁、cT2、浸润性导管癌、存在脉管浸润和Luminal型是腋窝淋巴结转移的独立危险因素(OR值分别为:3.440、1.770、3.397、7.434和2.212,均P<0.05)。见表2。
表1cT1-2N0期乳腺癌患者腋窝淋巴结转移与临床病理特征的关系
Tab.1Relationships between axillary lymph nodes(ALN) metastasis in patients with cT1-2N0breast cancer and clinicopathological features [n(η/%)]
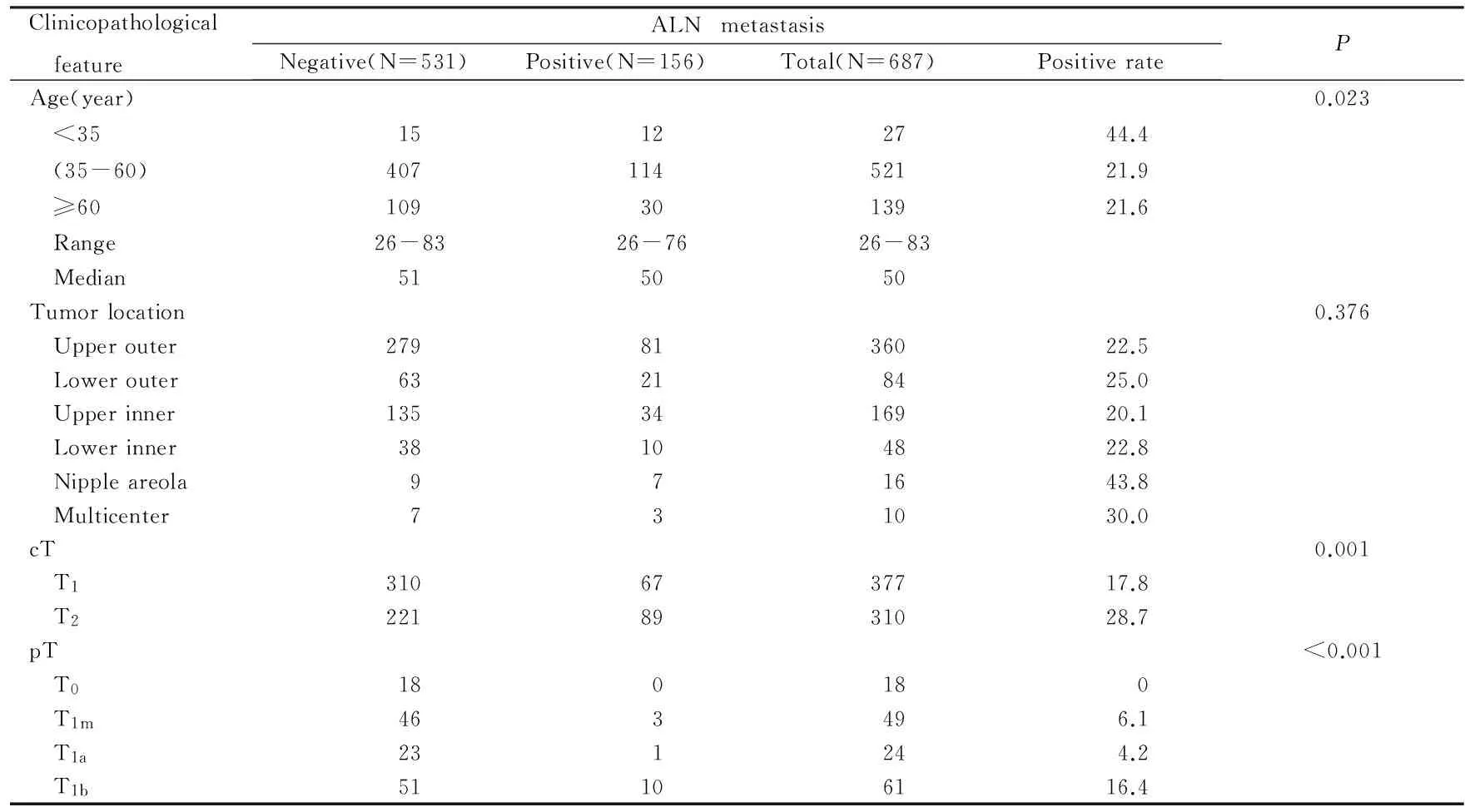
续表1
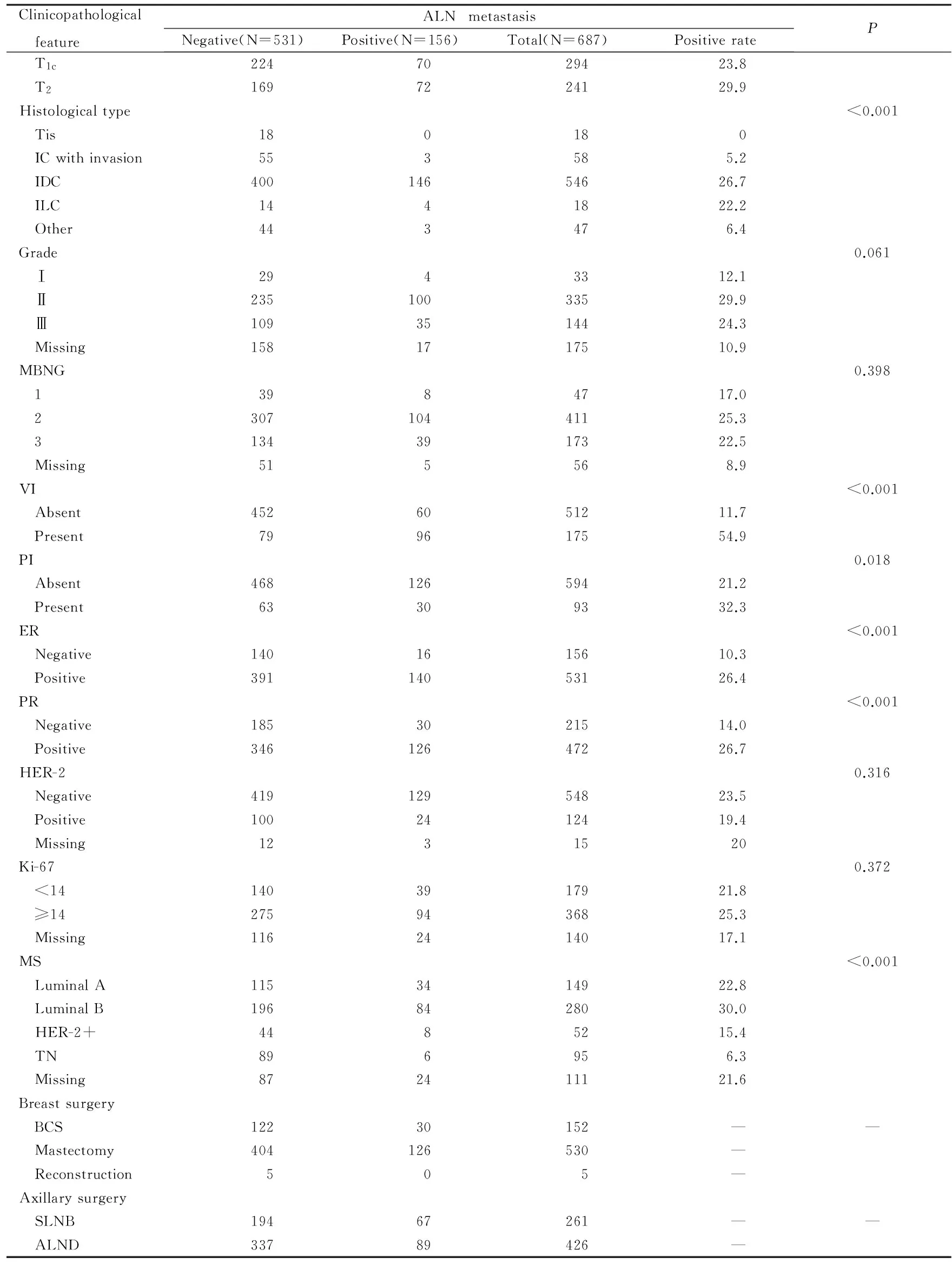
Clinicopathological featureALNmetastasisNegative(N=531)Positive(N=156)Total(N=687)PositiverateP T1c2247029423.8 T21697224129.9Histologicaltype<0.001 Tis180180 ICwithinvasion553585.2 IDC40014654626.7 ILC1441822.2 Other443476.4Grade0.061 Ⅰ2943312.1 Ⅱ23510033529.9 Ⅲ1093514424.3 Missing1581717510.9MBNG0.398 13984717.0 230710441125.3 31343917322.5 Missing515568.9VI<0.001 Absent4526051211.7 Present799617554.9PI0.018 Absent46812659421.2 Present63309332.3ER<0.001 Negative1401615610.3 Positive39114053126.4PR<0.001 Negative1853021514.0 Positive34612647226.7HER-20.316 Negative41912954823.5 Positive1002412419.4 Missing1231520Ki-670.372 <141403917921.8 ≥142759436825.3 Missing1162414017.1MS<0.001 LuminalA1153414922.8 LuminalB1968428030.0 HER-2+4485215.4 TN896956.3 Missing872411121.6Breastsurgery BCS12230152—— Mastectomy404126530— Reconstruction505—Axillarysurgery SLNB19467261—— ALND33789426—
BCS: Breast-conserving surgery; ER: Restrogen receptor; Her-2: Human epidermal growth factor receptor; IC: Intraductal carcinoma; IDC: Infiltrating ductal carcinoma; ILC: Infiltrating lobular carcinoma; MS: Molecular subtyping; PR: Progesterone receptor; PI: Perineural invasion; VI: Vascular invasion.“-”:No data.
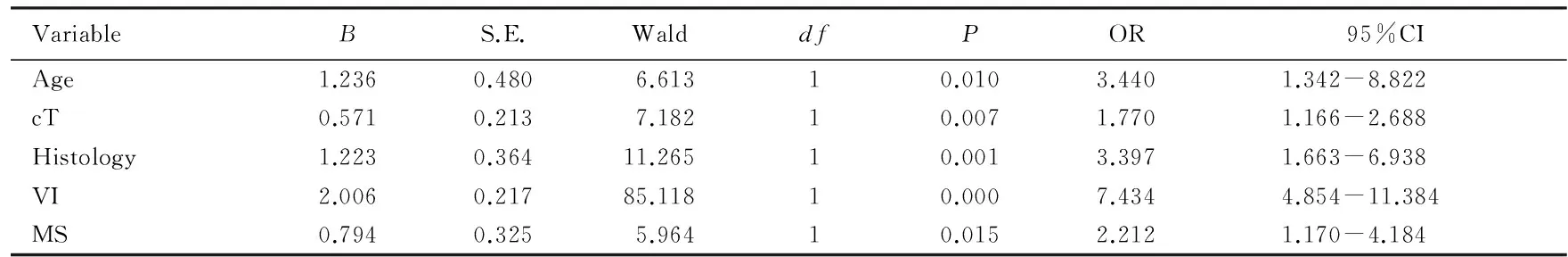
表2 多因素Logistic 回归分析
MS: Molecular subtyping; VI: Vascular invasion.
3 讨 论
文献[5]报道:腋窝淋巴结超声诊断的阴性预测值为87.4%。本研究超声诊断的阴性预测值为77.3%(531/687),若将孤立细胞团定义为阴性,则超声诊断的阴性预测值为78.0%(536/687)。目前超声诊断的阴性预测值还未达到临床需求,需进一步分析临床病理因素对腋窝淋巴结转移的影响。
Orucevicd等[7]发现:年龄<35岁者的腋窝淋巴结转移率高,为59%,即使T1期也有较高的转移率。雌激素可促使对其敏感性高的乳腺组织发生恶变,孕激素刺激乳腺细胞增殖和血管生成,导致乳腺癌细胞的生长和转移扩散,年轻患者较年老者具有激素水平高的优势,而更易出现早期的腋窝淋巴结转移。
本文作者认为:腋窝淋巴结转移率与肿瘤原发灶的位置有关,其与直接指向腋窝的淋巴引流丰富度有关。乳腺淋巴管主要分布于皮肤,尤以乳头乳晕区最为丰富,多中心原发灶的淋巴管分布广泛,外上象限者靠近腋窝淋巴结,因而肿瘤细胞沿淋巴管转移至腋窝淋巴结的几率较大。本研究中外上象限者转移率较低,可能与以下因素有关:原发灶位于腺体实质内,远离皮肤丰富的淋巴管,而腺体实质内淋巴管较少;原发灶位置较深,其淋巴引流至胸肌筋膜,导致内乳淋巴结转移[8];多因素分析结果表明:乳头乳晕区和多中心病灶不是腋窝淋巴结转移的独立危险因素,可能与病例数目较少有关,仅占全部病例的3.8%(26/688),有待扩大样本量后再行论证。
cT是乳腺癌临床分期的重要组成部分之一,本研究结果与以往文献[9]报道一致;同时本研究结果显示:pT分期越高,腋窝淋巴结转移率越高,两者之间呈线性关系。直径较大的原发灶易于突破基底膜,形成浸润灶,当此类肿瘤临近皮肤或乳头乳晕区时,因有较丰富的淋巴管引流,导致肿瘤细胞出现淋巴转移。
研究者[10-11]认为:病理分型影响腋窝淋巴结转移,其中浸润性导管癌的危险性最高,浸润性小叶癌的危险性次之。这可能与其生长方式有关,浸润性导管癌不断突破边界形成巨大浸润灶,存在脉管浸润的机率较高,而浸润性小叶癌沿原有组织结构浸润生长,存在脉管浸润的机率较低。浸润性导管癌是乳腺癌中最常见的病理类型,应予以重视。组织学分级与腋窝淋巴结转移的相关性较低。Tseng等[9]认为:组织学分级与肿物直径的相关性较高,从而间接地影响腋窝淋巴结转移的可能性较大。组织学分级与腋窝淋巴结转移的关系还需进一步研究。
脉管浸润提示肿瘤细胞突破脉管基底膜向瘤外组织转移是恶性肿瘤生物学行为的重要表现之一。本研究结果与以往文献[9]报道一致。同时,神经浸润阳性也是恶性肿瘤生物学行为的重要表现之一。因此,脉管和神经浸润增加了腋窝淋巴结转移的危险。
本研究中,ER、PR、HER-2和Ki-67与腋窝淋巴结的转移无关,而Luminal型是腋窝淋巴结转移的独立危险因素。通常乳腺癌细胞分化越好,细胞功能越接近正常,则其细胞上的 ER 及PR 表达水平越高,非激素依赖性的乳腺癌分化程度较低,侵袭性较强,本研究与此相反,与 Li等[10]和Tan等[11]的研究一致。HER-2与腋窝淋巴结转移的相关性较低,本研究结果与相关文献[12]报道一致。Tseng等[9]认为:HER-2阳性与肿物大小及组织分级相关,间接地影响腋窝淋巴结转移。HER-2基因复制本数目的增加可导致细胞表面HER-2蛋白的表达升高,从而导致细胞增生速度加快 ,该基因的过度表达或扩增可使肿瘤更具侵袭性。Ki-67指数决定细胞的生长分数,与肿瘤的临床进程密切相关。相关研究[13-15]证明:Ki-67指数越高,发生转移的淋巴结比例越大,原发肿瘤的转移潜能越大,Ki-67指数>15%或>20%为腋窝淋巴结转移的危险因素。本研究结果与此相反,Ki-67指数≥14%组发生转移的淋巴结比例为10.3%(63/611),Ki-67指数<14%组为11.4%(34/299)。研究文献[16]报道:分子分型与腋窝淋巴结转移、转移数目及病理N分期均无关系,而与肿物自身生物学特征等因素有关。以往关于三阴性乳腺癌(triple negative breast cancer, TNBC)的研究结果具有差异,有研究[17]认为TNBC型对腋窝淋巴结转移具有较低的危险性,其他研究[18]则与之相反。而本研究中TNBC型腋窝淋巴结转移率明显低于Luminal型,不是腋窝淋巴结转移的危险因素。本研究参考2011年 St.Gallen 乳腺癌国际研讨会分子分型划分共识,出现以上结果的差异,可能与检测技术及分子分型标准不一等原因有关。
综上所述,年龄、cT、病理分型、分子分型和脉管浸润是cT1-2N0期乳腺癌腋窝淋巴结是否存在转移的危险因素,其中脉管浸润最为重要。对于cT2N0期的浸润性导管癌、有神经和脉管浸润、激素受体阳性的病例,选择全乳切除术时,可考虑ALND;如果选择保乳术,应进行SLNB,若符合Z0011的标准,可放弃ALND。cT1N0期乳腺癌患者在无上述危险因素的情况下,如高龄患者,发生腋窝淋巴结转移的概率较低,是否应放弃常规的ALND以及SLNB还有待于更加深入的研究。
[1]Gentilini O, Veronesi U. Abandoning sentinel lymph node biopsy in early breast cancer? A new trial in progress at the European Institute of Oncology of Milan (SOUND: sentinel nodevsobservation after axillary ultrasound)[J].Breast, 2012, 21(5): 678-681.
[2]Giuliano AE, Hunt KK, Ballman KV, et al.Axillary dissectionvsno axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J].AMA, 2011, 305(6): 569-575.
[3]Ojeda-Fournier H, Nguyen JQ.Ultrasound evaluation of regional breast lymph nodes [A]//Seminars in roentgenology[M].Seminars in roentgerology.WB Saunders, 2011, 46(1): 51-59.
[4]Misselt PN, Glazebrook KN, Reynolds C, et al.Predictive value of sonographic features of extranodal extension in axillary lymph nodes[J].Ultrasound Med, 2010, 29(12): 1705-1709.
[5]Ibrahim-Zada I, Grant CS, Glazebrook KN, et al.Preoperative axillary ultrasound in breast cancer: safely avoiding frozen section of sentinel lymph nodes in breast-conserving surgery[J].Am Coll Surgeons, 2013, 217(1): 7-15.
[6]Esen G, Gurses B, Yilmaz MH, et al.Gray scale and power Doppler US in the preoperative evaluation of axillary metastases in breast cancer patients with no palpable lymph nodes[J].Eur Radiol, 2005, 15(6): 1215-1223.
[7]Orucevic A, Reddy VB, Bloom KJ, et al.Predictors of lymph node metastasis in T1 breast carcinoma, stratified by patient age[J].Breast J, 2002, 8(6): 349-355.
[8]Estourgie SH, Nieweg OE, Olmos RAV, et al.Lymphatic drainage patterns from the breast[J].Ann Surg, 2004, 239(2): 232-237.
[9]Tseng HS, Chen LS, Kuo SJ, et al.Tumor characteristics of breast cancer in predicting axillary lymph node metastasis[J].Med Sci Monitor: Int Med J Exp d Clin Res, 2014, 20: 1155-1161.
[10]Li L, Chen LZ.Factors influencing axillary lymph node metastasis in invasive breast cancer[J].Asian Pac J Cancer Prev, 2012, 13(1): 251-254.
[11]Tan LGL, Tan YY, Heng D, et al.Predictors of axillary lymph node metastases in women with early breast cancer in Singapore[J].Singapore Med J, 2005, 46(12): 693-697.
[12]Xie F, Yang H, Wang S, et al.A logistic regression model for predicting axillary lymph node metastases in early breast carcinoma patients[J].Sensors, 2012, 12(7): 9936-9950.
[13]俞理,胡滨,朱家安,等. 超声及其他多因素在乳腺癌腋窝淋巴结转移中的预测价值[J]. 中华临床医师杂志,2012,6(14) :3904-3908.
[14]Yin Y, Zeng K, Wu M, et al.The levels of Ki-67 positive are positively associated with lymph node metastasis in invasive ductal breast cancer[J].Cell Biochem Biophys, 2014, 70(2): 1145-1151.
[15]de Boer M, van Deurzen CHM, van Dijck JAAM, et al.Micrometastases or isolated tumor cells and the outcome of breast cancer[J].New Eng J Med, 2009, 361(7): 653-663.
[16]Jones T, Neboori H, Wu H, et al.Are breast cancer subtypes prognostic for nodal involvement and associated with clinicopathologic features at presentation in early-stage breast cancer?[J].Ann Surg Oncol, 2013, 20(9): 2866-2872.
[17]Crabb SJ, Cheang MCU, Leung S, et al.Basal breast cancer molecular subtype predicts for lower incidence of axillary lymph node metastases in primary breast cancer[J].Clin Breast Cancer, 2008, 8(3): 249-256.
[18]van Calster B, Bempt IV, Drijkoningen M, et al.Axillary lymph node status of operable breast cancers by combined steroid receptor and HER-2 status: triple positive tumours are more likely lymph node positive[J].Breast Cancer Res Treatment, 2009, 113(1): 181-187.
Analysis on related factors of axillary lymph node metastasis in patients with cT1-2N0breast cancer
CUI Zhushan,DU Ye,ZHU Zhu,GAO Pin,LI Jiawei, FAN Zhimin
(Department of Breast Surgery,First Hospital,Jilin University,Changchun 130021,China)
ObjectiveTo investigate the relationships between axillary lymph node metastasis and clinicopathologic features in the patients with cT1-2N0breast cancer and clarify the law of axillary lymph node metastasis,and to find the risk factor,and provide the theoretical basis for individuation therapy.Methods 687 patients with cT1-2N0breast cancer were divided into negative group and positive group according to the pathological results of axillary lymph node, and the clinicopathologic features were layered.The risk factors of axillary lymph node metastasis were screened out by Chi-square test and Logistic regression analysis. Results In 687 cases of cT1-2N0breast cancer,156 (22.7%) cases were observed with axillary lymph node metastasis. The age,cT stage,pT stage,pathological type,vascular invasion,perineural invasion estrogen receptor(ER), progesterone receptor(PR),and molecular subtyping were the factors that influenced axillary lymph node metastasis in univariate analyses.The age<35 years,cT2,invasive ductal carcinoma,vascular invasion positive and Luminal subtyping were the independent risk factors of axillary lymph nodes metastasis in multivariate analyses(r=3.440,P=0.010;r=1.770,P=0.007;r=3.397,P=0.001;r=7.434,P=0.000;r=2.212,P=0.015). Conclusion In the patients with cT1-2N0breast cancer,the age, cT,pathological type, vascular invasion and molecular subtyping are important predictors of axillary lymph node metastasis and vascular invasion was the most important predictor.The preoperative comprehensive analysis and evaluation of clinical data and preoperative pathological results obtained will help to select the right surgical operation.
breast neoplasms; neoplasms staging; axillary lymph node metastasis; ultrasonic diagnosis; vascular invasion; Luminal subtyping
1671-587Ⅹ(2015)06-1239-06
10.13481/j.1671-587x.20150627
2015-04-28
加拿大国际发展署项目资助课题(CIDA)(PSCLU 010-282/19156)
崔竹山(1989- ),男,山东省潍坊市人,在读医学硕士,主要从事乳腺癌诊断和综合治疗方面的研究。
范志民,教授,博士研究生导师 (Tel:0431-81875666,E-mail:fanzhimn@163.com)
R737.9
A

