血管性痴呆大鼠海马齿状回区D1受体的表达
万 朋,高俊涛,王 丹,王 师,金清华
(1. 吉林医药学院生理学教研室,吉林 吉林 132013;2. 延边大学医学院生理学与病理生理学教研室,吉林 延吉 133002)
血管性痴呆大鼠海马齿状回区D1受体的表达
万朋1,高俊涛1,王丹2,王师2,金清华2
(1. 吉林医药学院生理学教研室,吉林 吉林 132013;2. 延边大学医学院生理学与病理生理学教研室,吉林 延吉 133002)
目的: 观察血管性痴呆(VD)模型大鼠海马齿状回(DG)区的多巴胺(DA)浓度及D1受体表达情况,并探讨两者间的关系。方法:选用12只Sprague-Dawley雄性大鼠,随机分为VD组和假手术组,每组6只。利用双侧颈总动脉永久性结扎法制备VD大鼠模型,模型制备结束30 d后,利用脑部微量透析法和高效液相色谱法测定海马DG区细胞外液中的DA浓度,应用免疫组织化学法观察海马DG区D1受体的表达情况。结果:VD组大鼠海马DG区细胞外液中的DA浓度较假手术组明显降低(P<0.05)。在VD组和假手术组大鼠的海马DG区颗粒细胞层均有D1受体的表达,2组间比较差异无统计学意义(P>0.05);而2组大鼠海马门区均有D1受体的表达,VD组D1受体表达水平明显升高(P<0.05)。结论:VD模型大鼠海马DG区的DA浓度减少,其功能可能是通过海马门区D1受体的表达增加而代偿的。
血管性痴呆;海马齿状回;受体,多巴胺D1;大鼠,Sprague-Dawley
血管性痴呆(vascular dementia,VD)最明显的病理学改变是小血管病变导致的海马、尤其是海马齿状回(dentate gyrus,DG)区大量神经细胞的脱失[1-2]。VD的认知障碍包括对空间的认知和记忆障碍[3],研究[4-5]表明:损坏海马DG区的大鼠在完成空间参考记忆和工作记忆的任务时出现空间认知障碍。多巴胺(dopamine,DA)与学习记忆功能有密切的关系[6],而且有证据[7]显示:D1受体存在于海马背侧DG区的颗粒细胞和下脚复合体的绝大多数细胞内。研究[8-9]显示:海马内的DA可调控学习与记忆过程,可是这些研究主要集中在海马的CA1区和CA3区,对VD模型大鼠海马DG区的DA浓度及其D1受体的表达有何变化目前尚未见相关报道。因此,本实验在清醒自由活动大鼠的整体水平上,观察VD大鼠海马DG区DA浓度的变化,并应用免疫组织化学法检测D1受体在海马DG区的分布和表达情况,探讨海马DG内的DA及其D1受体在VD空间学习记忆中的作用。
1 材料与方法
1.1实验动物、主要试剂和仪器选用12只成年雄性Sprague-Dawley系大鼠,体质量250~300 g,由延边大学实验动物中心提供,动物许可证号:SCXK(吉)2011-0007。动物随机分为假手术组(n=6)与VD模型组(n=6)。甲醇(美国TEDIA公司),水合氯醛(天津市大茂化学仪器供应站), 氨基丁酸、L-天冬氨酸和L-谷氨酸(美国Sigma公司),兔抗鼠c-Fos多克隆抗体(SC-52)(美国Cell Signaling公司),山羊抗兔IgG、Regent A、Regent B、封闭用正常羊血清原液及浓缩型DAB显色试剂盒(北京中杉金桥生物技术有限公司)。HTEC-300型生物活性物质微量分析系统、ESP-64型微量灌流泵、EAS-20 自动进样器、CA-5ODS型高效液相分离柱和SI-300型手动进样器(日本EICOM公司),8R-6型脑立体定位仪(日本成茂公司)。
1.2VD大鼠模型的制备大鼠腹腔注射10%水合氯醛(300 mg·kg-1)进行麻醉,在大鼠颈部正中线左侧0.5 cm处做一个长约1 cm的切口,分离颈总动脉后用医用4号手术丝线双重结扎。7 d后于颈正中线右侧0.5 cm处做一个长约1 cm的切口,双重结扎右侧颈总动脉。假手术组除了不结扎双侧颈总动脉,其余步骤均与VD组相同。模型制备完成25 d后,通过5 d的Morris水迷宫实验观察大鼠的空间学习记忆能力,以空间学习记忆损害作为判定模型制备成功的标准[10]。利用脑部微量透析法和高效液相色谱(HPLC)法测定海马DG区细胞外液中DA浓度;利用免疫组织化学法检测海马DG区D1受体的分布和表达情况。
1.3微量透析探针的埋入模型制备完成30 d后,大鼠用10%的水合氯醛(300 mg·kg-1)行腹腔麻醉,根据Paxinos和Watson图谱进行脑部定位,以前囟为参考点,将透析用外套管垂直插入并固定于一侧海马高于DG区1.0 mm的位置(定位坐标为:AP 3.2 mm,L/R 1.6 mm,H 2.5 mm)。适应环境24 h后,将微量透析探针通过外套管插入到DG区。
1.4海马DG区DA浓度测定微量透析探针连接于数码式微量泵,灌流人工脑脊液(1.5 μL·min-1),稳定60 min后,经自动收集器收集微量透析样本, 每管样本收集10 min,共收集3个管,取平均值。收集样本注入到生物活性物质微量分析系统内,以0.5 μL·min-1的速度通过HPLC分离柱和电化学检测器,测定各个样本中DA浓度。
1.5免疫组织化学法灌注、取材、切片:采用10%水合氯醛腹腔麻醉,从大鼠左心室快速注入4℃生理盐水500 mL灌流冲洗,之后以4%多聚甲醛(pH 7.4)500 mL灌注固定。固定结束后,迅速在DA冰上断头取脑并置于4%多聚甲醛中浸泡固定2 h,其后置于20%蔗糖溶液中过夜直至下沉,再置于30%蔗糖溶液中过夜。将包含海马的脑组织用石蜡包埋,切片(厚度4 μm),常规免疫组织化学法进行海马DG区D1受体的染色。D1受体阳性细胞的计数方法:40倍光学显微镜下,在每只大鼠DG区的相应部位随机取 5个视野照相,并在颗粒细胞层和多形细胞层各自选取10 000 μm2的领域,利用数字图像分析系统对D1受体强阳性细胞进行计数。
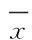
2 结 果
2.1VD模型大鼠海马DG区DA浓度VD组模型制备成功30 d后,应用脑部微量透析法和HPLC法测定海马DG区细胞外液中DA浓度。如图1的典型色谱图所示,VD大鼠海马DG区透析样本中的DA波形与假手术组比较明显降低。VD组海马DG区细胞外液中DA浓度为(0.75±0.11) μg·L-1,而假手术组DG区DA浓度为(0.21±0.03) μg·L-1,两组比较差异有统计学意义(P<0.05)。
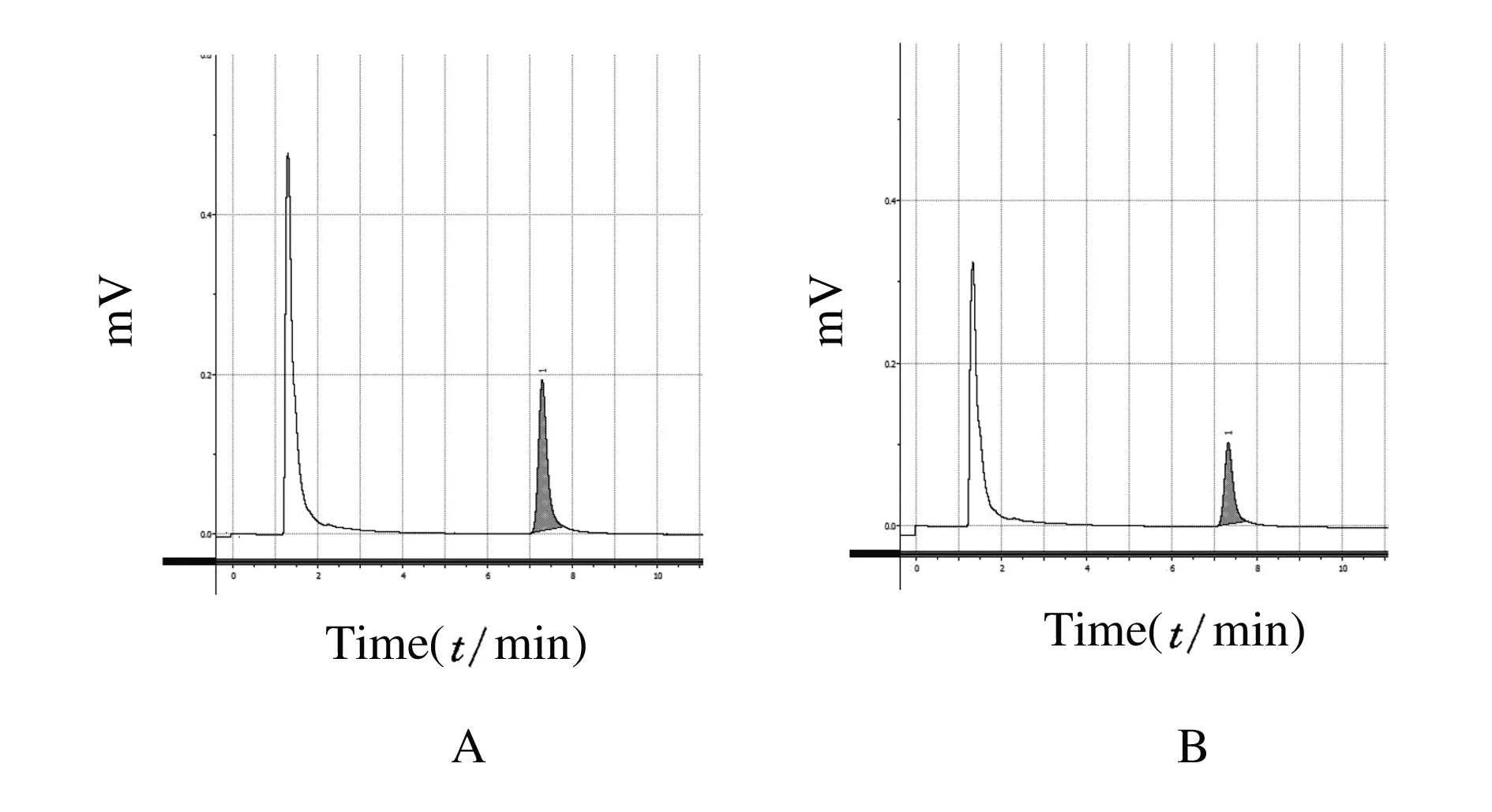
A:Sham operation group;B:VD group.
图1海马DG区微量透析样本中DA浓度检测的典型HPLC图
Fig.1Typical HPLC of DA in dialysate of hippocampal DG
2.2VD大鼠海马DG区D1受体表达情况采用免疫组织化学染色法观察海马DG区D1受体的表达情况。在每次染色过程中未加一抗的阴性对照切片均未出现明显的棕色颗粒。D1受体在DG的颗粒细胞层和多形细胞层均有表达(图2,见插页二),且2个部位表达情况不尽相同。在颗粒细胞层和多形细胞层各自选取10 000 μm2的领域,进行D1受体强阳性细胞的计数。结果发现:在DG区颗粒细胞层,VD模型组D1受体强阳性细胞数为(33.85±2.12)个,与假手术组[(29.14±3.33)个]比较差异无统计学意义(P>0.05);而在DG区多形细胞层(海马门区),VD模型组D1受体强阳性细胞数为(29.71±2.02)个,较假手术组[(24.57±1.36)个]明显增加(P<0.05)。
3 讨 论
DA是脑内重要的神经递质,海马不仅接受多巴胺神经元的投射[11],而且DA与海马空间学习记忆活动关系密切[12]。研究[12-13]表明:海马内灌注DA受体阻断剂可影响空间学习和被动回避反应的形成,而不影响已经形成的记忆。已被证实的中枢神经系统内DA能受体分为5种亚型,即D1~D5受体,其中D1受体在学习记忆中的作用备受关注[14-15]。研究[16-17]表明:海马CA1和CA3区的D1受体在各种学习记忆活动以及学习记忆相关的突触效应长时程增强(long-term potentiation,LTP)的形成和维持中起重要的调节作用。海马DG内也存在D1和D2受体,且以D1受体为主[7],海马DG内的DA可通过激活D1受体易化大鼠的空间学习记忆活动。因此,本文作者提出海马DG内的DA及其D1受体参与VD大鼠空间学习记忆损害的可能性。本实验结果显示:VD模型大鼠DG区DA浓度明显减少,提示DA浓度的减少可能是VD大鼠空间学习记忆损害的原因之一。
众所周知,信息在海马内的传递过程大致为:内嗅皮层的穿通纤维投射到DG区颗粒细胞,颗粒细胞经苔藓纤维投射到CA3区锥体细胞,后者再发出Schaffer侧支投射到CA1区的锥体细胞,而海马门是从DG颗粒细胞到CA3区锥体细胞的主要区域。本实验结果显示:VD模型大鼠海马DG区D1受体表达在颗粒细胞层未出现异常,但在DG多形细胞层(即海马门)内却出现表达明显增加。海马门是从DG颗粒细胞到CA3区锥体细胞的主要区域,其中存在着大量的GABA能抑制性中间神经元,其可以通过调节颗粒细胞的活动影响海马内的信息传递,而研究[18]发现:DA及其D1受体可通过影响GABA能中间神经元的活动来参与DG区空间信息处理过程。因此本文作者认为:VD大鼠海马门区D1受体表达增加是对海马区缺血的一种代偿反应,以D1受体增加来部分代偿VD大鼠DG区因DA减少而导致的信息传递的减弱。虽然本实验结果还提示D1受体在海马门区的作用对VD认知功能障碍的改善可能有积极的作用,但其具体的下游机制有待于进一步研究。
[1]Logue MW,Posner H,Green RC. Magnetic resonance imaging-measured atrophy and its relationship to cognitive functioning in vascular dementia and Alzheimer’s disease patients [J].Alzheimers Dement,2011,7(5):493-500.
[2]Kwon KJ,Kim MK,Lee EJ,et al.Effects of donepezil,an acetylcholinesterase inhibitor,on neurogenesis in a rat model of vascular dementia [J].J Neurol Sci,2014,347(1/2):66-77.
[3]Rockwood K.Vascular cognitive impairment and vascular dementia [J].Neurosci Rev,2002,203(15):23-27.
[4]Jeltsch H,Bertrand F,Lazarus C,et al.Cognitive performances and locomotor activity following dentate granule cell damage in rats:role of lesion extent and type of memory tested [J].Neurobiol Learn Mem,2001,76(1):81-105.
[5]Luo P,Lu Y,Li C,et al.Long-lasting spatial learning and memory impairments caused by chronic cerebral hypoperfusion associate with a dynamic change of HCN1/HCN2 expression in hippocampal CA1 region [J].Neurobiol Learn Mem,2015(123):72-83.
[6]Abi-Dargham A,Xu X,Thompson JL,et al.Increased prefrontal cortical D1 receptors in drug naive patients with schizophrenia:a PET study with NNC112 [J].J Psychopharmacol,2012,26(6):794-805.
[7]Gangarossa G,Longueville S,Bundel D De,et al.Characterization of dopamine D1 and D2 receptor-expressing neurons in the mouse hippocampus [J].Hippocampus,2012,22(12):2199-2207.
[8]Edelmann E,Lessmann V.Dopamine regulates intrinsic excitability thereby gating successful induction of spike timing-dependent plasticity in CA1 of the hippocampus[J].Front Neurosci,2013,doi:10.3389/fnins.2003.00025.eCollection 2013.
[9]Li SM,Cullen WK,Anwyl R,et al.Dopamine-dependent facilitation of LTP induction in hippocampal CAl by exposure to spatial novelty[J].Nat Neurosci,2003,6(5):526-531.
[10]Wan P,Wang S,Zhang Y,et al.Involvement of dopamine D1 receptors of the hippocampal dentate gyrus in spatial learning and memory deficits in a rat model of vascular dementia [J].Pharmazie,2014,69(9):709-710.
[11]Lisman J,Grace AA,Duzel E.A neoHebbian framework for episodic memory; role of dopamine-dependent late LTP [J].Trends Neurosci,2011,34(10):536-547.
[12]da Silva WC,Köhler CC,Radiske A,et al.D1/D5 dopamine receptors modulate spatial memory formation [J].Neurobiol Learn Mem,2012,97(2):271-275.
[13]O’Carroll CM,Martin SJ,Sandin J,et al.Dopaminergic modulation of the persistence of one-trial hippocampus dependent memory [J].Learn Mem,2006,13(6):760-769.
[14]Lee HE,Lee YW,Park SJ,et al.4-Hydroxybenzyl methyl ether improves learning and memory in mice via the activation of dopamine D1 receptor signaling [J].Neurobiol Learn Mem,2015,121(3):30-38.
[15]Karasinska JM,George SR,El-Ghundi M,et al.Modification of dopamine D1 receptor knockout phenotype in mice lacking both dopamine D1 and D3 receptors[J].Eur J Pharmacol,2000,399(2/3):171-181.
[16]Yang HW,Lin YW,Yen CD,et al.Change in bi-directional plasticity at CA1 synapses in hippocampal slices taken from 6-hydroxydopamine-treated rats:the role of endogenous norepinephrine [J].Eur J Neurosci,2002,16(6):1117-1128.
[17]Wen JL,Xue L,Wang RH,et al.Involvement of the dopaminergic system in the consolidation of fear conditioning in hippocampal CA3 subregion [J].Behav Brain Res,2015,278(1):527-534.
[18]Nazari-Serenjeh F,Rezayof A,Zarrindast MR.Functional correlation between GABAergic and dopaminergic systems of dorsal hippocampus and ventral tegmental area in passive avoidance learning in rats [J].Neuroscience,2011,196(24):104-114.
Expression of dopamine D1 receptors in hippocampal dentate gyrus in rats with vascular dementia
WAN Peng1,GAO Juntao1,WANG Dan2,WANG Shi2,JIN Qinghua2
(1. Department of Physiology,Jilin Medical University,Jilin 132013,China; 2.Department of Physiology and Pathophysiology,College of Medical Sciences,Yanbian University,Yanji 133002,China)
Objective To observe the extracellular content of dopamine (DA) and expression of D1 receptors in hippocampal dentage gyrus (DG) in the model rats with vascular dementia (VD),and to investigate the relationship between them.Methods 12 male SD rats were randomly divided VD group and sham-operation group,and the VD model was prepared by permanent bilateral carotid occlusion.The extracellular content of DA in the DG was determined byinvivomicrodialysis and HPLC,and the expression of D1 receptors was measured by immunehisto- chemistry.ResultsThe DA content in the DG of the rats in VD group was lower than that in sham-operation group (P<0.05).The number of D1 receptor-positive cells in the DG hilus in VD group was increased compared with sham-operation group (P<0.05),whereas the expression of D1 receptor in DG granule cell layer did not change (P>0.05).ConclusionThe DA content in the hippocampal DG is decreased in the VD rats,and its function may be compensated by the up-regulation of D1 receptors in the DG hilus.
vascular dementia; dentate gyrus; receptors,dopamine D1;rats,Sprague-Dawley
1671-587Ⅹ(2015)06-1130-04
10.13481/j.1671-587x.20150606
2015-03-17
国家自然科学基金资助课题(31160211)
万朋(1980-),男,吉林省农安县人,讲师,理学博士,主要从事神经生理学方面的研究。
金清华,教授,博士研究生导师(Tel:0433-2435131,E-mail:yqinghua@ybu.edu.cn)
R743;Q427
A
网络出版时间:2015-11-11 16:30:38
网络出版地址:http://www.cnki.net/kcms/detail/22.1342.r.20151111.1630.005.html

