RNA干扰血管紧张素原基因表达对前脂肪细胞3T3-L1分化的影响
黄志立,张丽君,伍丽华,王 妍,杨汝德
(1.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055;2.华南理工大学生物科学与工程学院,广东 广州 510640)
RNA干扰血管紧张素原基因表达对前脂肪细胞3T3-L1分化的影响
黄志立1,张丽君1,伍丽华2,王妍1,杨汝德2
(1.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055;2.华南理工大学生物科学与工程学院,广东 广州 510640)
目的:构建靶向血管紧张素原(AGT)基因的RNA干扰质粒,研究AGT基因对鼠前脂肪3T3-L1分化的影响。方法:设计靶向AGT的小分子RNA干扰片段(AGT-shRNA),以未靶向任何DNA的小分子RNA(Non-shRNA)为对照,利用载体psiRNA-U6.1/Neo构建重组表达质粒,转染鼠前脂肪细胞3T3-L1并筛选到稳定转染细胞株,RT-PCR和SDS-PAGE法分别检测AGT基因沉默效果,通过显微镜观察和脂肪细胞分化标志物检测来确定AGT基因干扰对3T3-L1细胞分化的影响。结果:成功构建AGT干扰质粒,与对照组比较,AGT基因转录水平受到显著抑制(P<0.05),AGT蛋白表达水平也仅为对照的43.86%。AGT基因干扰后3T3-L1细胞脂质水平和甘油-3-磷酸脱氢酶(GPDH)活性仍随分化时间延长呈上升趋势,但增长量明显低于对照组(P<0.05)。结论:RNA干扰AGT基因可明显抑制3T3-L1前脂肪细胞的分化,提示脂肪组织中的肾素-血管紧张素系统(RAS)与脂肪代谢有重要关联。
血管紧张素原;RNA干扰;3T3-L1;分化
肾素-血管紧张素系统(renin-angiotensin system,RAS)是人体内重要的体液调节系统,对稳定心血管系统功能、维持体液平衡和调节血压有重要作用,与高血压和糖尿病等疾病关系密切[1]。在RAS中,血管紧张素原(angiotensinogen,AGT)是产生具有生物活性血管紧张素的前体物质,其在肾素和血管紧张素转化酶催化下依次转化为血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)和血管紧张素Ⅱ(angiotensinⅡ,AngⅡ),AngⅡ是RAS最主要的生物活性肽,通过循环系统到达远端组织,与心脏、血管、肾脏及脑组织等靶器官的特异性受体(angiotensin receptor,AT)结合,产生信号传导而发挥其生理功能[2]。脂肪组织中表达RAS的所有组分,肥胖者同时伴有RAS的过度活跃,提示脂肪组织RAS与脂肪代谢及肥胖有密切关联[1,3]。以往研究[4-8]主要针对RAS活性物质AngⅡ以及其受体AT1与AT2展开,却得到相互矛盾的结果,部分研究[4-6]显示提高AngⅡ水平会促进人和鼠前脂肪细胞分化,而另一些研究[7-8]结果却表明RAS会抑制脂肪合成。为了排除RAS各组分间的相互影响,本研究以RAS的源头AGT为目标,构建靶向鼠前脂肪细胞AGT基因的RNA干扰(RNAi)质粒,转化3T3-L1细胞,通过沉默AGT基因来探讨RAS对脂肪细胞分化增殖的影响,为研究RAS影响脂肪细胞分化的机制以及RNAi新技术的应用提供实验依据。
1 材料与方法
1.1细胞、主要试剂和仪器鼠前脂肪细胞3T3-L1购自中国科学院广州生物医药与健康研究所。质粒psiRNAT-U6.1/Neo购自GenScript公司,大肠杆菌TOP-10由本实验室细胞服务平台提供。限制性内切酶BamHⅠ、HindⅢ、EcoRⅠ、KpnⅠ,DNA和RNA提取试剂盒,RT-PCR试剂盒SYBR○RPremix Ex TaqTM(Takara 公司,日本);DMEM培养基和胎牛血清(Gibco公司,美国),LipofectamineTM2000和TRIZOL(Life Technologies公司,美国),DEX、IBMX、胰岛素和DHAP(Sigma公司,美国)。二氧化碳恒温培养箱(BINDER公司,德国),酶标仪(Spectramax M2,美国),倒置荧光相差显微镜(LEICA DMIRB公司,德国),电泳及凝胶成像分析系统(Bio-Rad公司,美国),荧光定量PCR仪(Roche公司,德国)。引物合成和DNA测序委托上海生工生物工程公司完成。
1.2RNAi质粒的构建根据NCBI中查找到的小鼠AGT基因序列(NM 007428),利用Ambion提供的在线siRNA模板序列设计软件(http://www.ambion.com/techlib/misc/siRNA_finder.html)设计出2组靶向鼠AGT的siRNA序列,由于2组实验结果相近,论文数据只选取其中一组,将其命名为AGT-shRNA。此外,还设计一条与NCBI数据库中任何小鼠基因均无同源性的片段作为实验对照,标记为Non-shRNA。根据质粒载体psiRNAT-U6.1/Neo的基因序列,整条序列应该分别包括BamHⅠ酶切黏性末端互补片段、19个碱基靶序列、LOOP环、19个碱基靶序列的互补序列、终止信号以及HindⅢ酶切黏性末端的互补片段共6个区域。用于构建重组干扰质粒的寡核苷酸序列见表1。

表1 用于构建重组干扰质粒的寡核苷酸序列
委托生工生物工程(上海)公司合成表1中的寡核苷酸片段,90℃加热10 min,室温静置1 h,使之退火成双链。PsiRNAT-U6.1/Neo载体经BamHⅠ和HindⅢ双酶切成线性载体,再经T4连接酶分别与AGT-shRNA和Non-shRNA片段连接,重组质粒转化大肠杆菌TOP-10,筛选重组子,进行酶切分析和测序鉴定。
1.3稳定转染3T3-L1细胞株的获得及诱导分化鼠前脂肪细胞3T3-L1培养于含10%FCS的DMEM培养基中,按照每孔2×104个细胞接种于24孔板中,置于37℃、5%CO2培养箱中培养,细胞汇合至80%,更换无抗生素无血清DMEM培养基培养过夜。采用LipofectamineTM2000试剂,以每孔1 μg将重组质粒分别转染入3T3-L1鼠前脂肪细胞株中,37℃培养。6 h后更换无抗生素DMEM培养基(含10%FCS),37℃培养24 h。为了筛选稳定转染的3T3-L1细胞,在培养基中加入抗生素G418至终浓度为600 mg·L-1,37℃、5%CO2培养箱中培养,每隔2 d换液,10~14 d后,可见有抗性的克隆出现,停药培养,待其逐渐增大后,挑取单克隆增殖。对应重组质粒,将获得的细胞株分别用AGT-shRNA和Non-shRNA表示。将细胞在普通DMEM培养基中37℃培养2 d(将此时的细胞状态定义为0 d),更换诱导分化培养基(无血清DEME培养基中含有0.5 μmol·L-1胰岛素、0.25 μmol·L-1地塞米松和0.5 nmol·L-1IBMX),37℃分别培养0~12 d,根据实验需要在不同时间收获细胞。
1.4RT-PCR法检测AGT基因mRNA表达水平提取3T3-L1细胞总RNA,按照PrimeScriptTMRT reagent Kit操作方法逆转录获得cDNA,利用SYBR○RPremix Ex TaqTMKit进行RT-PCR,AGT基因的转录水平以管家基因β-actin为对照。其中扩增AGT基因的引物:上游引物,5′-GCTTGTCTAGGTTGGCGCTGA-3′; 下游引物,5′-CAGGTGCTCTTGTTGTGGTAAAGG-3′;扩增β-actin基因的引物:上游引物,5′-CATCCGTAAAGACCTCTATGCCAAC-3′; 下游引物,5′-ATGGAGCCACCGATCCACA-3′ 。PCR反应体系是20 μL,PCR循环反应条件:95℃、10 s,60℃(AGT)或56℃(β-actin)、10 s;72℃、10 s,实验数据采用PCR仪配套软件进行相对定量,AGT基因mRNA表达水平计算公式:2Ct(AGT,AGT-shRNA)-Ct(β-actin,AGT-shRNA)/2Ct(AGT,Non-shRNA)-Ct(β-actin,Non-shRNA),转染对照质粒的细胞AGT基因mRNA表达水平为100%,AGT基因干扰后其mRNA表达水平以相对于阴性对照的百分数表示。
1.5SDS-PAGE蛋白电泳检测AGT蛋白表达水平分别用AGT-shRNA质粒和Non-shRNA质粒转染3T3-L1细胞,同时进行无义转染作为空白对照,48 h后收集3组细胞,用Bradford法检测蛋白浓度。按照每孔20 μg的上样量对样品进行SDS-PAGE电泳,电泳结果经凝胶成像系统拍照后,采用Quantity One软件进行蛋白条带灰度的相对定量分析,结果以百分数表示。
1.6吸光光度法检测3T3-L1细胞的分化水平通过检测甘油-3-磷酸脱氢酶(glycerol phosphate dehydrogenase,GPDH)活性和胞内脂质水平反映前脂肪细胞的分化水平。分别在第4、8和12天收集细胞,培养6孔板,吸尽培养基,用PBS缓冲液冲洗细胞2~3次,每孔加入0.5 mL预冷的细胞超声破碎液,刮下贴壁细胞,使用超声破碎仪在冰浴中破碎30 s,4℃、12 000 g离心15 min,收集上清液至96孔板,并加入反应混合液(100 mmol·L-1三乙醇胺-HCl缓冲液, pH 7.5、2.5 mmol·L-1EDTA,0.12 mmol·L-1NADH和0.1 mmol·L-1β-巯基乙醇),加入0.2 mmol·L-1DHAP启动反应,以NADH的消耗速率测定GPDH活性。利用酶标仪在340 nm处检测数据,蛋白水平测定采用Bradford法,GPDH活性以U·g-1蛋白表示(1 U=1 mol NADH/min)[9]。分别收集在转染并诱导分化后第0、2、4、6、8、10和12天的3T3-L1细胞,用油红O染色方法测定细胞脂质积累变化,具体方法如下:吸尽培养液,细胞用PBS洗3次后加入10%甲醛溶液,固定30 min,加入异丙醇漂洗,待异丙醇彻底挥发后加入300 μL油红O,染色30 min,PBS冲洗3次,洗净未着色染料,于倒置显微镜下观察细胞分化程度,再加入250 μL异丙醇提取油红O,振荡10 min,取200 μL在波长500 nm处测吸光度(A)值,A值的大小直接反映细胞脂质水平,以此判定脂肪细胞的分化程度。

2 结 果
2.1RNAi质粒的酶切分析结果将AGT-shRNA和Non-shRNA基因片段(表1)分别与质粒psiRNA-U6.1/Neo重组,构建成重组质粒。将重组质粒分别用3种酶进行2组双酶切,琼脂糖凝胶电泳检测结果如图1所示。质粒psiRNA-U6.1/Neo经EcoRⅠ和HindⅢ双酶切后会产生大小为6 029 和351 bp的2条片段,而重组质粒双酶切后的2条片段大小分别为5 983和397 bp(图1A)。未重组质粒经EcoRⅠ和KpnⅠ双酶切后会产生6 035和345 bp 2条片段,而重组质粒由于KpnⅠ酶切位点被外源基因所替换,双酶切后只会产生一条大小为6 380 bp的片段(图1B),结果与预期相符。经上海生工生物工程公司测序,确定重组质粒已构建成功。

A:EcoRⅠ/HindⅢ; B:EcoRⅠ/KpnⅠ. M:100 bp ladder DNA marker;Lane 1:psiRNA-U6.1/Neo;Lane 2:AGT-shRNA; Lane 3:Non-shRNA .
图1重组质粒的酶切分析电泳图
Fig.1 Electrophoregram of degestion of recombinant plasmids with restriction endonucleases
2.2RT-PCR法与SDS-PAGE检测AGT基因mRNA及蛋白表达水平RT-PCR以β-actin作为本底对照, AGT基因干扰后其mRNA表达水平明显降低(P<0.05),只有阴性对照的(53.00±0.08)%。AGT蛋白电泳结果经Quantity One软件进行相对定量分析,得出AGT蛋白条带的灰度相对量:无义转染和阴性对照的AGT相对含量分别为总蛋白的7.12%和7.57%,结果接近,而AGT基因沉默组的AGT蛋白相对含量为总蛋白的3.32%,为阴性对照组的43.86%,见图2。上述结果表明:AGT基因干扰后,mRNA转录及蛋白表达水平均受到抑制。
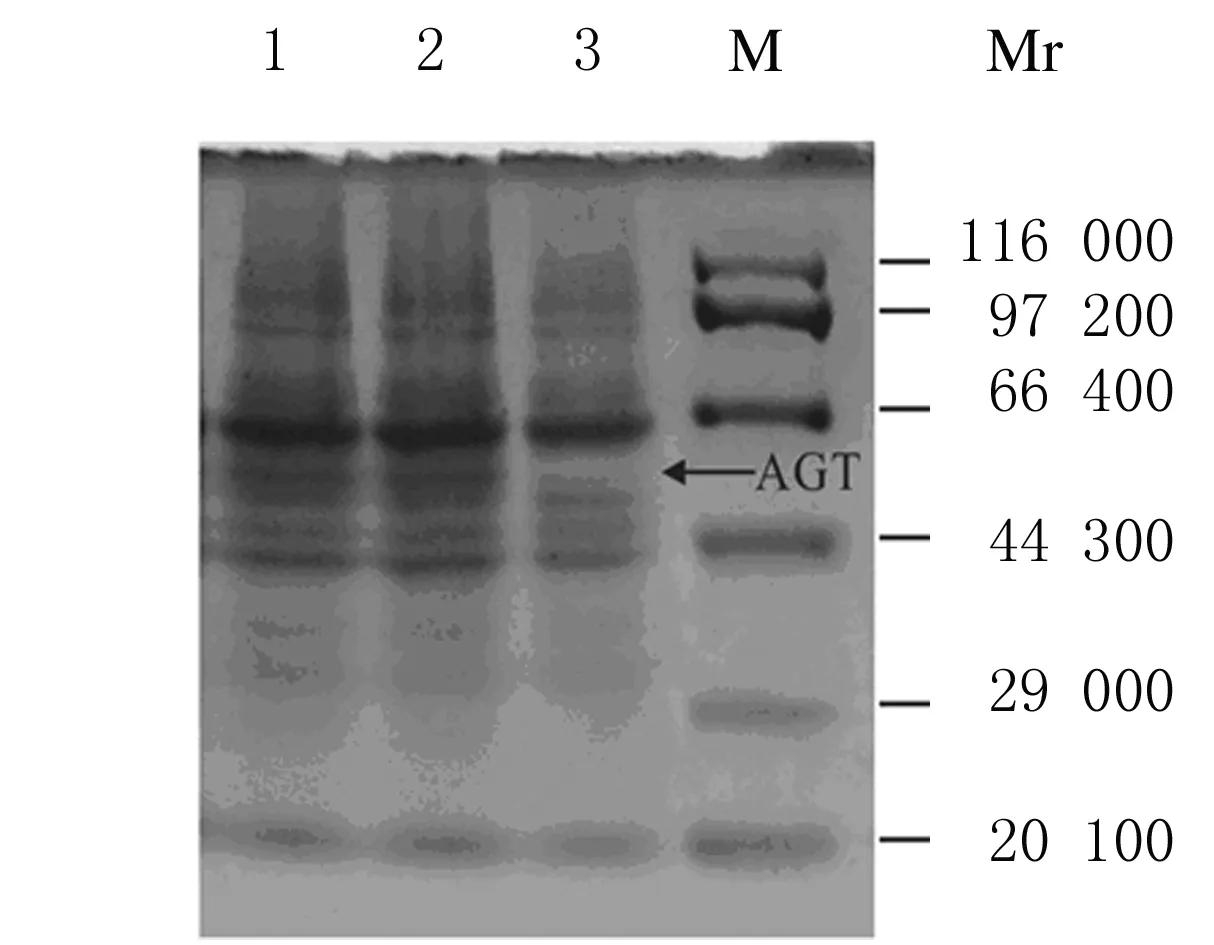
Lane 1:3T3-L1 group;Lane 2:Non-shRNA group;Lane 3:AGT-shRNA group;M:Protein marker.
图2SDS-PAGE电泳检测各组3T3-L1细胞中AGT蛋白表达电泳图
Fig.2Electrophoregram of expressions of AGT protein in 3T3-L1 cells in various groups detected by SDS-PAGE
2.32组3T3-L1细胞的分化水平诱导分化开始后,前脂肪细胞内的GPDH活性不断增加,并随着分化进行逐渐增加,在脂肪细胞分化末期(第12天)GPDH酶活性达到峰值。AGT基因沉默后细胞GPDH活性仍然随着分化时间的延长呈上升趋势,但与对照比较其活性水平降低,尤其在第8和12天差异有统计学意义(P<0.05)。见图3。细胞油红染色检测脂质水平:各组细胞的胞内脂质积累均在诱导第6天后迅速增加,但与对照比较,AGT基因抑制导致胞内脂质水平下降,其中第6和8天差异有统计学意义(P<0.05)。见图4。2组诱导分化至第12天时细胞经油红染色后在显微镜镜下观察,AGT基因沉默组细胞的脂质积累明显弱于阴性对照。见图5(插页四)。

* P<0.05 vs Non-shRNA.
Fig.3Activities of GPDH in 3T3-L1 adipocytes after AGT gene silencing

* P<0.05 compared with Non-shRNA.
Fig.4Levels of lipids in 3T3-L1 adipocytes after AGT gene silencing
3 讨 论
肥胖是继心脑血管病和癌症之后人类健康的第3大杀手。肥胖者往往伴有高血糖、高血压和高血脂等代谢综合征,并且是2型糖尿病的高危人群[1]。对脂肪组织中RAS的研究表明:该系统与脂肪细胞分化、积累、代谢,肥胖、高血压和2型糖尿病等疾病等有密切关联[10],但其相关机制仍不明确。以往的研究表明:RAS会促进脂肪细胞分化,但也有完全相反的报道[1-3,11]。究其原因:首先,RAS对脂肪细胞的调控机制复杂,脂肪细胞产生的Ang Ⅱ对自身的作用即有自分泌和旁分泌等方式[12];其次,各种生物活性因子之间相互影响,尤其是内源和外源RAS组分、脂肪来源与非脂肪来源的RAS组分之间相互影响[3];此外,实验方法的选用也可能是原因之一。在体外细胞实验中,常采用外源添加Ang Ⅱ和(或)Ang Ⅱ受体阻断剂的方法,但Huang等[13]在其研究中也质疑AT1受体阻断剂可能会与Ang Ⅱ互相干扰,导致对脂肪细胞影响结果不明,因此合理的研究方法至关重要。 RNAi是一门新兴技术,RNAi不是完全的基因敲除,而是通过小分子RNA来沉默目的基因,达到抑制、干扰其表达的目的,由于其具有操作方便、周期短和成本低等优点,已广泛应用在功能基因组学、药物筛选、细胞信号途径和基因治疗等研究领域[14-15]。本实验室首次报道了将该技术应用在RAS对前脂肪细胞分化影响的研究中[16],从而避免了前述各种外源添加因子相互干扰的现象。本课题组的前期研究[5-6]结果表明:外源添加Ang Ⅱ会促进3T3-L1分化和脂质积累,并上调多种相关转录因子的转录水平,在本研究中通过RNAi技术沉默AGT基因获得了相似的结果。转染了AGT-shRNA干扰质粒的3T3-L1细胞,其AGT基因mRNA和蛋白表达水平分别降低至对照的53%和43.86%,并且在分化过程中,细胞的GPDH酶活性和脂质水平也明显降低。GPDH是产生甘油-3-磷酸的唯一催化酶,是甘油三酯合成的限速酶,而甘油三酯是细胞中脂质水平的重要指标,甘油三酯和酯质水平是前脂肪细胞分化成熟重要标志,其水平的降低说明前脂肪细胞的分化随着AGT基因的沉默受到明显的抑制,该结论与本课题组在人前脂肪细胞HPA-v中的研究结果一致[16],证明AGT基因沉默对前脂肪细胞分化的抑制作用没有种属差异性,但其分子机制尚需研究。此外,本研究也验证了利用RNAi技术建立目的基因沉默的体外细胞模型是一种有效的研究方法。
[1]Kalupahana NS,Moustaid-Moussa N.The renin-angiotensin system:a link between obesity,inflammation and insulin resistance [J].Obes Rev,2012,13(2):136-149.
[2]Castrop H,Höcherl K,Kurtz A,et al.Physiology of kidney renin [J].Physiol Rev,2010,90(2):607-673.
[3]Frigoleta ME,Torresb N,Tovarb AR.The renin-angiotensin system in adipose tissue and its metabolic consequences during obesity [J].J Nutr Biochem,2013,24(12):2003-2015.
[4]de Kloet AD,Krause EG,Scott KA,et al.Central angiotensin Ⅱ has catabolic action at white and brown adipose tissue [J].Am J Physiol Endocrinol Metab,2011,301(6):E1081-E1091.
[5]张丽君,李世敏,黄志立.血管紧张素Ⅱ对前脂肪细胞分化相关转录因子表达的影响 [J].营养学报,2011,33(6):559-562
[6]张琨,李世敏,张丽君,等.血管紧张素Ⅱ对3T3-L1前脂肪细胞分化的影响 [J].华中农业大学学报,2008,27(1):131-134.
[7]Janke J,Engeli S,Gorzelniak K,et al.Mature adipocyte inhibitinvitrodifferentiation of human preadipocytes via angiotensin type 1 receptors [J].Diabetes,2002,51(6):1699-1707.
[8]Brücher R,Cifuentes M,AcuM J,et al.Larger anti-adipogenic effect of angiotensin Ⅱ on omental preadipose cells of obese humans [J].Obesity,2007,15(7):1643-1646.
[9]Bouraoui L,Gutiérrez J,Navarro I.Regulation of proliferation and differentiation of adipocyte precursor cells in rainbow trout (Oncorhynchus mykiss) [J].J Endocrinol,2008,198(3):459-469.
[10]Putnam K,Shoemaker R,Yiannikouris F,et al.The renin-angiotensin system:a target of and contributor to dyslipidemias,altered glucose homeostasis,and hypertension of the metabolic syndrome [J].Am J Physiol Heart Circ Physiol,2012,302(6):1219-1230.
[11]Fuentes P,Acuna MJ,Cifuentes M,et al.The anti-adipogenic effect of angiotensin Ⅱ on human preadipose cells involves ERK1,2 activation and PPARG phosphorylation [J].J Endocrinol,2010,206(1):75-83.
[12]Kumar R,Thomas CM,Yong QC,et al.The intracrine renin-angiotensin system [J].Clin Sci (Lond),2012,123(5):273-284.
[13]Huang WW,Hsieh TJ,Lin T,et al.Blockade of the rennin-angiotensin system ameliorates apelin production in 3T3-L1 adipoctyes [J].Cardiovasc Drug Ther,2011,25(1):3-12.
[14]Kim D,Rossi J.RNAi mechanisms and applications [J].Biotechniques,2008,44(5):613-616.
[15]邢光远,谢淑丽,邱伟,等.P27RF-Rho基因沉默对肝癌Bel7402细胞增殖的影响[J].吉林大学学报:医学版,2015,41(3):542-547.
[16]Ye ZW,Wu XM,Zhang LJ,et al.Knockdown of angiotensinogen by shRNA-mediated RNA interference inhibits human visceral preadipocytes differentiation [J].Int J Obes,2010,34(1):157-164.
Influence of angiotensinogen gene silencing on differentiation of preadipocytes 3T3-L1
HUANG Zhili1,ZHANG Lijun1,WU Lihua2,WANG Yan1,YANG Rude2
(1. School of Applied Chemistry and Biological Technology,Shenzhen Polytechnic,Shenzhen 518055,China;2. School of Bioscience and Bioengineering,South China University of Sciences and Technology,Guangzhou 510640,China)
Objective To construct the angiotensinogen (AGT)-targeting RNA interfering plasmids,and to explore the effect of AGT gene on the differentiation of preadipocytes 3T3-L1 in the mice.MethodsThe small hairpin RNA (AGT-shRNA) interference plasmids,with a scrambled Non-shRNA as control,were constructed on the basis of the activity of U6 promoter-driven expression vector psiRNA-U6.1/Neo and transfected into the mouse preadipocytes 3T3-L1.Two cell lines were generated from stable transfections.RT-PCR and SDS-PAGE were performed to monitor the mRNA and protein expressions of AGT gene, respectively.The effect of adipose AGT on the differentiation of 3T3-L1 was investigated through microscopic observation and profiling of adipocyte differentiation markers.ResultsBoth AGT-shRNA and Non-shRNA interference vectors were successfully constructed; the expression of AGT mRNA was inhibited(P<0.05)and the expression of AGT protein was 43.86% of control.Both adipocyte differentiation markers,intracytoplasmic lipid levels and glycerol-3-phophate dehydrogenase (GPDH) activities were increased during the differentiation of preadipocytes 3T3-L1,but the data were lower than those in control group(P<0.05).ConclusionAGT gene silencing can significantly inhibit the differentiation of preadipocytes 3T3-L1,which demonstrates that there is important relationship between adipocyte metabolism and renin-angiotensin system (RAS) in adipose tissue.
angiotensinogen; RNA interference; 3T3-L1; differentiation
1671-587Ⅹ(2015)06-1195-06
10.13481/j.1671-587x.20150619
2015-04-21
广东省教育厅产学研结合项目资助课题(2012B091100408);深圳市科技计划项目资助课题(07KJba160);广东省深圳市创新委新兴产业公共技术服务平台项目资助课题(GGJS20130331152344401)
黄志立(1974-),女,四川省兴文县人,副教授,工学博士,主要从事生物技术应用方面的研究。
张丽君,副教授(Tel:0755-26019560,E-mail:c7zlj@szpt.edu.cn)
R34;R329.28

