铁基载氧体在化学链制氢中的应用研究
张 鑫,马 波,梁 皓,尹泽群
(1.辽宁石油化工大学化学化工与环境学部,辽宁 抚顺 113001;2.中国石化抚顺石油化工研究院)
铁基载氧体在化学链制氢中的应用研究
张 鑫1,马 波1,梁 皓2,尹泽群2
(1.辽宁石油化工大学化学化工与环境学部,辽宁 抚顺 113001;2.中国石化抚顺石油化工研究院)
采用柠檬酸络合法制备载体LaNiO3,浸渍法制备铁基载氧体CeO2-Fe2O3/LaNiO3,并将其用于化学链制氢过程中。在剂烷比2∶1、进水量0.1 mL、常压的实验条件下,考察反应温度对载氧体反应性能的影响。结果表明:氢气产量随Fe负载量的增加先增大后减小,最佳负载量为15%;助剂CeO2的添加,提高了载氧体的性能。5%CeO2-15%Fe2O3/LaNiO3载氧体在固定床反应器、还原温度为800 ℃、氧化温度为800 ℃、剂烷比为2∶1、进水量为0.1 mL的实验条件下连续循环100次后仍保持高活性。
化学链制氢 载氧体 钙钛矿 甲烷
氢气作为一种清洁能源,可用作能源载体和燃料。在炼油厂,氢气主要用于加氢裂化、VGO加氢精制、馏分油加氢精制、石脑油加氢精制、芳烃饱和及异构化等。在工业生产中,氢气与其它物质一起用来制造氨水和化肥,同时也应用到玻璃磨光、黄金焊接、气象气球探测中[1-2]。目前工业上最主要的制氢方法是天然气水蒸气重整制氢,该技术以天然气为原料,制得合成气,再经过水汽变换反应进行制氢,最后脱除CO2得到较纯的氢气,该过程流程长、能耗大。除此以外,该过程还要向大气排放大量的温室气体,对环境不利[3-4]。
化学链制氢系统由燃料反应器、水蒸气反应器和空气反应器组成(见图1)。在燃料反应器中,Fe2O3与燃料发生反应生成CO2和H2O,通过冷凝脱水富集纯CO2,此时Fe2O3被还原为FeO,吸收热量;在蒸汽反应器中,还原态的FeO与水蒸气反应生成目标产物H2,此时FeO被氧化为Fe3O4;在空气反应器中,Fe3O4被氧化为Fe2O3,放出热量。反应式如下所示:
燃料反应器:

(1)
蒸汽反应器:

(2)
空气反应器:

(3)
总反应:

(4)
此系统解决了化石燃料制取氢气过程中大量的CO2排放问题以及分离气体所需要的高能耗与设备投入。

图1 化学链制氢示意
在化学链制氢过程中,载氧体既是晶格氧的载体,又是能量载体,制备价格低廉、高效、环境友好的载氧体对该技术至关重要[5]。目前,该过程多选用Fe基氧化物作载氧体,但是由于受到其还原过程中热力学平衡的限制,燃料气转化率较低[6]。另外,高温氧化再生过程中释放的巨大热量会造成载氧体颗粒逐渐烧结,降低了颗粒孔隙率和有效反应面积,导致载氧体的反应活性随循环次数的增加而逐渐降低。因此,通常将Fe基氧化物负载到载体上。目前文献中采用较多的载体主要有Al2O3、TiO2、MgO、SiO2、高岭土、铝酸盐等[7-8],这些载体都是惰性载体,在反应过程中基本不参与反应,如果采用活性载体,既能为金属氧化物提供支撑和分散的作用,又能参与反应、为反应提供一定的活性位,这种载体就可以提高载氧体的效率,具有很好的经济性。钙钛矿[9]是一种具有独特物理性质和化学性质的新型无机非金属材料,其分子通式为ABO3,该类氧化物A位一般是稀土或碱土元素离子,B位为过渡元素离子,A位和B位皆可被半径相近的其它金属离子部分取代,调整晶体的结构及其缺陷和密度,从而形成阴阳离子点阵的缺陷和价态的不同,促进其吸收、释放、储存、传输氧并提供活性。钙钛矿结构中的离子半径匹配应满足下面关系式:

式中:RA,RB,RO分别代表A,B,O的离子半径;t称为容差因子。
Fan Liangshi等[10]以煤为原料、气化后的合成气为燃料,对Ni,Cu,Cd,Co,Mn,Fe基金属氧化物作为载氧体进行实验。结果表明,Fe2O3为载氧体时,氢气产率最高,同时合成气转化率也很好。Zeng Liang等[11]以合成气为燃料,Fe2O3为载氧体,在燃料反应器、蒸汽反应器和空气反应器中进行循环实验,结果表明,CO转化率大于90%,99%CO2被富集。Yang Jingbiao等[12]以煤焦为原料,Fe2O3为载氧体,采用流化床反应器,用水蒸气代替空气作氧化剂,在反应温度800 ℃、燃料反应器中空速5 680 mL/(g·h)、蒸汽反应器空速2 840 mL/(g·h)的条件下焦炭转化率为97%,H2产量为167 mL/g Fe2O3。史奇良等[13]以CO为燃料,Fe2O3为活性组分,Al2O3和TiO2为载体,反应温度为900 ℃,对Fe2O3(90%)+Al2O3(10%),Fe2O3(60%)+Al2O3(40%),Fe2O3(60%)+TiO2(40%)3种载氧体进行还原、水蒸气氧化和空气氧化循环实验,评价结果表明:3种载氧体在循环中活性保持稳定,没有出现失活和烧结现象;增加载氧体中惰性载体的含量可以提高载氧体的活性。Murugan A[14]以CO为原料,对La0.6Sr0.4Co0.2Fe0.8O3-δ(LSCF6428),La0.7Sr0.3FeO3-δ(LSF731),60%Fe2O3/Al2O3(Fe 60),20%NiO/Al2O3(Ni 20) 4种不同的载氧体制氢性能进行了比较,结果表明:100次还原氧化循环反应后,LSCF6428和LSF731钙钛矿稳定性和活性与Fe60和Ni20相当。随着反应的进行,Fe60和Ni20产氢量降低,而且Ni20产生了积炭现象。程序升温实验结果表明,在开始的反应中,Fe60的产氢量高于LSF731,但是150个循环之后,两者产氢量相当,LSF731表现出更好的循环性能和稳定性。梁皓等[15-17]研究了镍基、铁基和钴基载氧体在化学循环制氢中的性能,以CH4为原料,Fe2O3/LaFeO3为载氧体,在反应温度900 ℃、常压下进行了还原氧化反应,评价结果表明:剂烷比为2∶1、进水量为0.1 mL、Fe质量分数为15%时载氧体性能最好,CH4转化率达到60%,单次循环氢气产量为45 mL。Ryden M[18]以CO为燃料,60%Fe2O3/MgAl2O4为载氧体,在流化床上对其进行评价,结果表明,在反应温度为900 ℃时,75% CO氧化成CO2,氢气产量为106 mL/g。
本研究采用LaNiO3作活性载体,Fe2O3作活性组分,CeO2作助剂,以CH4、水蒸气和空气为原料,考察载氧体的性能。
1 实 验
1.1 载氧体制备
1.1.1 载体制备 ①称取一定量的Ni(NO3)2·6H2O放入500 mL烧杯中,加入100 mL蒸馏水,然后把烧杯置于40 ℃水浴中。②称取一定量的La(NO3)3·6H2O,放入装有100 mL蒸馏水的烧杯中,搅拌至全部溶解。其中镍离子与镧离子的物质的量相等。把硝酸镧溶液滴加到硝酸镍溶液中,边滴加边搅拌。③取一定量的柠檬酸,柠檬酸与金属离子总量摩尔比为1.2∶1,搅拌至全部溶解,待上述混合溶液搅拌30 min后,缓慢地加入柠檬酸溶液,边滴加边搅拌。④搅拌5 h后,绿色溶液脱水变成黏稠状凝胶,将凝胶取出放入120 ℃的干燥箱中干燥过夜,以3 ℃/min的升温速率从室温升至400 ℃,恒温焙烧3 h,再以10 ℃/min的升温速率升至900 ℃,恒温焙烧4 h,得到金属氧化物载体LaNiO3。
1.1.2 负载活性组分 采用等体积浸渍法制备载氧体。首先称取一定量的金属氧化物前躯体Fe(NO3)3·9H2O、Ce(NO3)3·6H2O,加入适量蒸馏水溶解后混合均匀,称取一定量的LaNiO3载体粉末,将上述溶液分多次与LaNiO3混合并充分搅拌,得到均匀的浆状混合物。混合物在室温下干燥8 h后,将其转入干燥箱中于120 ℃下干燥8 h,然后转入马福炉中于900 ℃下焙烧4 h,使硝酸根彻底分解。最后,将得到的载氧体粉碎、筛分,选取40~60目之间的颗粒进行实验。
1.2 载氧体表征
催化剂的X射线衍射测试在日本理学株式会社生产的D/Max-2500型X射线粉末衍射仪上进行,Cu靶,Kα辐射源,石墨单色器,管电压40 kV,管电流80 mA。催化剂的程序升温还原表征采用美国MiCromeritics公司生产的AutoChem 2910型化学吸附仪,在300 ℃、Ar气氛下预处理60 min后冷却至室温,切换成10%H2+90%Ar的混合气,流速为30 mL/min,待色谱基线平稳后,以10 ℃/min的升温速率进行程序升温还原,TCD检测器。
1.3 载氧体性能评价
实验装置由进气系统、反应系统、分析系统3部分组成。进气系统由装有氮气、空气、甲烷的钢瓶组成。反应系统由等温固定床连续流动反应体系和PID温度控制器构成。反应管为内径8 mm的不锈钢反应器,外部由管式电炉均匀加热,管式电炉内壁装有直径1 mm的K型热电偶;反应管内部催化剂床层中也装有直径为1 mm的K型热电偶测量床层温度。反应系统的压力为常压。采用Agilent7820A气相色谱仪进行分析。
取40~60目的载氧体2.5 g,与石英砂等体积混合,装填反应管中,上、下两端由石英砂填充。先在N2(流量为50 mL/min)气氛下将装置升温至300 ℃,然后换成空气(流速为20 mL/min)预处理l h,再用N2(流速为90 mL/min)吹扫,升至反应温度。待温度稳定后,通入N2(流速为90 mL/min)与CH4(流速为10 mL/min)的混合气,反应 3 min,同时用气袋收集尾气,送入色谱进行分析。然后用N2吹扫10 min,通入H2O(流速为0.1 mL/min)与N2(流速为30 mL/min),反应5 min,同时用气袋收集尾气,送入色谱进行分析。最后通入空气(流速为15 mL/min),反应3 min后再用N2(流速为50 mL/min)吹扫10 min,这样就完成一次还原-氧化循环。载氧体稳定性考察采用相同的实验步骤,进行连续多次还原-氧化循环。
1.4 数据处理

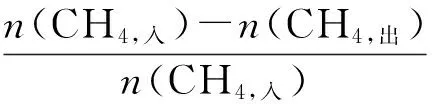

式中:n(CH4,入),n(CH4,出)分别为进、出反应器的甲烷的物质的量;FN2为N2流速;t为反应时间;φ为体积分数。
2 结果与讨论
2.1 活性组分Fe2O3负载量的影响
图2为Fe2O3负载量对Fe2O3/LaNO3载氧体晶型结构的影响。由图2可知,该载氧体在43.4°处出现了NiO的特征峰,在23.3°,32.8°,41.3°,48.1°,54.4°,58.8°处出现了LaNiO3的特征峰,在37.1°,49.8°,65°处出现了Fe2O3的微弱特征峰,在32.5°、59.9°处出现了LaFeO3的特征峰。其中Fe2O3和NiO为活性组分,LaNiO3和LaFeO3为载体。随着负载量的增加,LaNiO3的特征峰逐渐减弱,Fe2O3和LaFeO3的特征峰在负载量(w)为15%时最强,说明Fe2O3逐渐负载在LaNiO3表面,使其表面积逐渐减小,Fe2+部分取代了LaNiO3B位中的Ni2+形成了LaFeO3。

图2 Fe2O3负载量对载氧体晶型结构的影响(XRD图谱)★—LaFeO3; ●—LaNiO3; ◆—Fe2O3; ▲—NiO


图3 Fe2O3负载量对Fe2O3/LaNiO3载氧体还原性能的影响(H2-TPR)Fe2O3负载量(w): a—10%; b—15%; c—20%; d—25%

图4 Fe2O3负载量对载氧体性能的影响■—LaNiO3; ●— 10% Fe2O3/LaNiO3; ▲—15% Fe2O3/LaNiO3;—20% Fe2O3/LaNiO3; ◆—25% Fe2O3/LaNiO3
在剂烷比为2∶1、进水量为0.1 mL、反应温度为800 ℃的条件下,对不同Fe2O3负载量的载氧体进行性能评价,结果见图4。由图4可知,第一次循环甲烷转化率、氢气产量较低,之后随循环次数增加甲烷转化率、氢气产量相应增加。这是由于在第一次循环中,载氧体的表面氧参与反应,随着循环次数的增加,载氧体中的晶格氧释放出来,使反应能够彻底进行,从而提高了甲烷转化率、氢气产量。此外,第二次循环开始,甲烷几乎全部转化,这是由于NiO氧化甲烷的能力强于Fe2O3,NiO先与甲烷反应,再与Fe2O3反应。根据热力学计算Ni不与水蒸气反应,说明在燃料反应器中是载氧体中的NiO与甲烷反应,而不是Fe2O3与甲烷反应。随着Fe2O3负载量的增加,氢气产量先逐渐增加后有所下降,其中当负载量(w)为15%时,氢气产量最高。说明Fe2O3对水分解制氢反应起到促进作用。Fe2O3存在一个最佳负载量。当负载量较低时,Fe2O3能较好地负载在LaNiO3上,因此,随着负载量的增大,表现为反应活性提高。但是,当负载量继续增大时,会有一部分Fe2O3在LaNiO3载体表面形成较大的团聚颗粒,降低了表面的多孔性,而且容易从LaNiO3表面脱落下来,使其在催化剂研磨和筛分过程中大量损失,从而导致Fe2O3的实际负载量降低。此结果与上述H2-TPR结果相符。
2.2 15%Fe2O3/LaNiO3反应性能的研究
图5给出了15% Fe2O3/LaNiO3载氧体在剂烷比为2∶1、进水量为0.1 mL、反应温度为800 ℃下还原反应和氧化反应中气体组成变化。由图5可知,还原反应中甲烷与载氧体反应生成CO2、H2和少量CO,而且随循环次数的增加,各气体浓度变化不大。氧化反应中水蒸气与载氧体反应生成H2,此外还有少量CO和CO2生成,说明在还原反应中有积炭形成。图6给出了15% Fe2O3/LaNiO3载氧体还原反应中的积炭量随循环次数的变化。由图6可见,随循环次数的增加,积炭量降低,这是由于随着循环次数的增加,反应进行得越来越充分,CO和CO2含量降低。

图5 15%Fe2O3/LaNiO3载氧体反应气体组成变化■—H2; ●—CO2; ▲—N2; —CH4; ◆—CO

图6 15% Fe2O3/LaNiO3载氧体还原反应中的积炭量随循环次数的变化
2.3 助剂对铁基载氧体稳定性的影响

图7 Fe2O3/LaNiO3载氧体稳定性评价结果
在剂烷比为2∶1、进水量为0.1 mL、反应温度为800 ℃的条件下,对Fe2O3/LaNiO3进行稳定性评价,结果如图7所示。由图7可见,Fe2O3/LaNiO3能促使甲烷全部转化,但是多次循环后氢气产量明显下降,这是因为多次循环后,Fe2O3/LaNiO3载氧体变成一个含有多价态铁的混合物,并且部分钙钛矿结构发生分解,与新鲜载氧体相比结构和成分都发生了变化。因此,要考虑在载氧体中添加助剂。图8给出了CeO2-Fe2O3/LaNiO3、载氧体稳定性能的评价结果。由图8可知:该载氧体能促使甲烷全部转化,而且经过100次循环后,H2产量仍能保持较高的水平。这是因为在100次循环过程中,CeO2-Fe2O3/LaNiO3载氧体中Ce与Fe逐渐形成CeFeO3固溶体,提高了载氧体的含氧量,使载氧体循环100次后仍保持高活性,但是随反应的进行,还原过程可能产生积炭,随载氧体转移到氧化过程,形成CO2和CO,使H2产量受到影响。

图8 助剂CeO2对CeO2-Fe2O3/LaNiO3载氧体评价结果的影响
2.4 反应温度的影响
2.4.1 还原温度的影响 图9给出了5%CeO2-15%Fe2O3/LaNiO3在氧化温度800 ℃、不同还原温度下的评价结果。由图9可知,在800 ℃以上,从第二个循环开始,甲烷全部转化,升高温度有利于甲烷转化,并且提高了气体的分子扩散,促进了载氧体的还原。反应温度高对设备要求高,从而提高成本,因此该反应的最佳温度为800~850 ℃。

图9 还原温度对CeO2-Fe2O3/LaNiO3载氧体评价结果的影响■—900 ℃; ●—850 ℃; ▲—800 ℃; ℃

图10 氧化温度对CeO2-Fe2O3/LaNiO3载氧体评价结果的影响■—800 ℃; ●—850 ℃; ▲—900 ℃
2.4.2 氧化温度的影响 图10给出了还原温度900 ℃、不同氧化温度下的评价结果。由图10可知,甲烷转化率和氢气产量随循环次数增加略有提高,这是由于随反应的进行,载氧体还原程度不断加深。此外,甲烷转化率受氧化温度影响不大,850 ℃下,氢气产量最高,升高温度,在动力学上有利于提高水分解制氢的反应速率。900 ℃时,氢气产量较低,可能是因为过高的温度导致载氧体发生烧结或分解堵塞管路使气体含量降低。因此,该反应最佳温度为800~850 ℃。
3 结 论
(1) 采用柠檬酸络合法制备载体LaNiO3、浸渍法制备铁基载氧体CeO2-Fe2O3/LaNiO3,随着Fe2O3负载量的增加,甲烷能够全部转化,当Fe2O3的负载量(w)为15%时,氢气产量最高。结合H2-TPR分析结果可知,Fe2O3存在一个最佳负载量。
(2) 助剂CeO2的添加提高了载氧体的反应性能,使其经过100次循环后,仍保持一定的稳定性。并且5%CeO2-15%Fe2O3/LaNiO3载氧体在固定床反应器、还原温度为800 ℃、氧化温度为800 ℃、剂烷比为2∶1、进水量为0.1 mL的条件下连续循环100次后仍可保持高活性。
[1] 蔡炽柳.氢能及其应用前景分析[J].能源与环境,2008(5):39-41
[2] 张西子.氢能源及其利用[J].科技致富向导,2012(23):62-63
[3] 刘少文,吴广义.制氢技术现状及展望[J].贵州化工,2003,28(5):4-6
[4] 褚洪岭,王桂芝,龚凡,等.制氢工艺技术经济与新技术[J].化工技术经济,2005,23(9):36-40
[5] Otsuka K,Yamada C,Kaburagi T.Hydrogen storage and production by redox of iron oxide for polymer electrolyte fuel cell vehicles[J].Int J Hydrogen Energy,2003,28(3):335-342
[6] Li Fanxing,Zeng Liang,Velazquez-Vargas L G.Syngas chemical looping gasification process:Bench-scale studies and reactor simulations[J].AIChE Journal,2010,56(8):2186-21
[7] 段维慧,张建民,陈磊.化学链燃烧技术的研究现状[J].山西能源与节能,2007,44(1):31-34
[8] 刘黎明,赵海波,郑楚光.化学链燃烧方式中氧载体的研究进展[J].煤炭转化,2006,29(3):83-92
[9] 马晓瑜,李燕,王欢龙,等.钙钛矿储氧材料的制备与表征[J].内蒙古科技大学学报,2012,31(4):333-336
[10]Fan Liangshi,Li Fanxing,Ramkumar Shwetha.Utilization of chemical looping strategy in coal gasification processes[J].Particuology,2008,6:131-142
[11]Zeng Liang,He Feng,Li Fanxing,et al.Coal-direct chemical looping gasification for hydrogen production:Reactor modeling and process simulation[J].Energy Fuels,2012,26(6):3680-3690
[12]Yang Jingbiao,Cai Ningsheng,Li Zhenshan.Hydrogen production from the steam-iron process with direct reduction of iron oxide by chemical-looping combustion of coal char[J].Energy Fuels,2008,22(4):2570-2579.
[13]史奇良,陈时熠,薛志鹏,等.铁基载氧体化学链制氢特性实验研究[J].中国电机工程学报,2011(S1):168-174
[14]Murugan A,Thursfield A,Metcalfe I S.A chemical looping process for hydrogen production using iron-containing perovskites[J].Energy & Environmental Science,2011,4(11):4369-4649
[15]梁皓,宋喜军,尹泽群,等.化学链制氢中Fe2O3/LaFeO3载氧体的性能研究[J].燃料化学学报,2013,41(12):1513-1519
[16]Liang Hao,Zhang Xiwen,Fang Xiangchen,et al.Performance of Ni-based,Fe-based and Co-based oxygen carriers in chemical-looping hydrogen generation[J].China Petroleum Processing and Petrochemical Technology,2013,15(2):53-58
[17]梁皓,尹泽群,张喜文,等.化学链燃烧反应中LaFe1-xCoxO3载氧体的性能研究[J].石油炼制与化工,2013,44(6):12-16
[18]Ryden M,Lyngfelt A.Using steam reforming to produce hydrogen with carbon dioxide capture by chemical-looping combustion[J].International Journal of Hydrogen Energy,2006,31(10):1271-1283
STUDY ON APPLICATION OF Fe-BASED OXYGEN CARRIER IN CHEMICAL LOOPING HYDROGEN GENERATION
Zhang Xin1, Ma Bo1, Liang Hao2, Yin Zequn2
(1.DepartmentofChemicalIndustryandEnvironment,LiaoningShihuaUniversity,Fushun,Liaoning113001; 2.SINOPECFushunResearchInstituteofPetroleumandPetrochemicals)
Fe2O3/LaNiO3and CeO2-Fe2O3/LaNiO3were prepared by citric acid complexation method and immersion method, and was used as the oxygen carrier in chemical looping hydrogen generation. The experiment was conducted under the conditions:ratio of Fe2O3to CH4of 2∶1, water 0.1 mL, and atmospheric pressure to investigate the effect of reaction temperature. The results show that H2output increases first and then decreases with increasing Fe loading. The optimum loading of Fe is 15%; Addition of CeO2improves the stability of the oxygen carrier. Under the condition of atmospheric pressure, ratio of Fe2O3to CH4of 2, 0.1 mL of water, reduction and oxidation reaction temperature of 800 ℃, the 5%CeO2-15%Fe2O3/LaNiO3oxygen carrier can be repeatedly used for 100 times with high activity.
chemical looping hydrogen generation; oxygen carrier; perovskite; methane
2014-08-26; 修改稿收到日期: 2015-02-12。
张鑫,硕士研究生,从事化学链制氢研究。
马波,E-mail:mb6062@sohu.com。

