Pseudomonas sp. LKY-5产生的表面活性剂提取及其稳定性研究
李 琳,赵朝成,刘其友,刘春爽
(中国石油大学(华东)化学工程学院,山东 青岛 266580)
Pseudomonas sp. LKY-5产生的表面活性剂提取及其稳定性研究
李 琳,赵朝成,刘其友,刘春爽
(中国石油大学(华东)化学工程学院,山东 青岛 266580)
针对二苯并噻吩高效降解菌Pseudomonassp. LKY-5降解过程中产生表面活性剂的现象,进行碳源优化,将提取分离出的表面活性剂进行化学组分分析和理化性质测定,考察温度、pH、无机离子对其表面活性稳定性的影响。结果表明,花生油为Pseudomonassp. LKY-5产生表面活性剂的最佳碳源,产生的表面活性剂为鼠李糖脂,产量为0.15 gL,临界胶束浓度(CMC)为180 mgL,亲水亲油平衡值(HLB)为12.3,对柴油24 h的乳化能力达61%。该表面活性剂在温度30~80 ℃、pH 6~13的条件下表面活性稳定,能够耐受200 gL的NaCl或MgCl2以及20 gL的CaCl2,稳定性能良好。
假单胞菌 生物表面活性剂 鼠李糖脂 稳定性
近年来,随着国内高硫原油进口量的迅速增长,在运输、储存以及加工过程中不可避免地对土壤、地下水和海洋环境造成严重污染。二苯并噻吩(DBT)是一种具有综合多芳香环结构的含硫杂环化合物,是高硫原油的重要组成,具有致癌性和生物富集性,难以被微生物降解[1-2]。二苯并噻吩的生物可利用性低是限制其微生物降解的主要因素,表面活性剂可以增强其在水相基质的溶解,强化与微生物间的质量传递[3]。生物表面活性剂是由细菌、酵母菌和真菌在代谢过程中分泌的次级代谢产物,如糖脂、多糖脂、脂肽、脂蛋白以及中性类脂衍生物等。与化学表面活性剂相比,生物表面活性剂具有低毒、选择性好、可原位生长和环境友好等优点,因而非常适合应用在环境污染治理领域[4-5]。利用生物表面活性剂或其产生菌强化环境中难降解污染物的生物降解已成为目前的研究热点[6]。Pedetta等[7]利用可产生表面活性剂的假单胞菌来提高菲的生物利用性,在72~168 h对菲的降解率可以达到75%~100%。Singh等[8]通过研究发现生物表面活性剂的浓度和咔唑的降解速率成正比。本课题选用前期筛选得到的二苯并噻吩高效降解菌Pseudomonassp. LKY-5[9],针对其在降解过程中产生表面活性剂的现象,进行碳源优化,提取并分析其产生的表面活性剂,研究温度、pH、无机离子对其稳定性的影响,为应用生物表面活性剂产生菌强化石油污染土壤的生物修复提供理论基础。
1 实 验
1.1 实验材料
1.1.1 培养基 无机盐培养基:Na2HPO40.6 g,KH2PO40.2 g,NaNO34.0 g,CaCl20.01 g,FeSO40.01 g,MgSO40.3 g,酵母膏0.5 g,蒸馏水1 000 mL,pH 7.2~7.5。
发酵培养基:在无机盐培养基中,加入不同碳源(甘油、花生油、液体石蜡等),其中花生油为市售食用油,呈淡黄透明状,密度(30 ℃)0.908 g/cm3,运动黏度(20 ℃)82.56 mm2/s,含不饱和脂肪酸(80%)以及软脂酸、硬脂酸和花生酸等饱和脂肪酸(20%)。
LB培养基:蛋白胨10 g,酵母粉 5 g,NaCl 5 g,琼脂 20 g(固体培养基用),pH 7.2~7.5。
将培养基经121 ℃灭菌20 min,不适合高温高压灭菌的药品需要经过0.22 μm微孔滤膜过滤除菌。
1.1.2 菌种来源 从胜利油田石油污染土壤中分离筛选出二苯并噻吩高效降解菌Pseudomonassp. LKY-5,经LB培养基富集后,用无菌的无机盐培养基制成菌悬液,菌含量为2.9×108CFU/mL。
1.2 实验方法
1.2.1 碳源优化 分别在100 mL无机盐培养基中接种2 mL的甘油、0号柴油、液体石蜡、正十六烷、花生油、20 g/L葡萄糖、100 mg/L DBT作为碳源,于摇床160 r/min、30 ℃条件下培养72 h后,在室温下采用EasyDyne型表面张力仪(德国KRUSS)板法测定发酵液的表面张力。
1.2.2 表面活性剂的提取、分离及薄层色谱(TLC)分析 将培养72 h的发酵液在8 000 r/min、4 ℃下离心20 min,将上清液用6 mol/L的盐酸调节pH至2.0,放入4 ℃的冰箱中过夜,然后加入等体积氯仿/甲醇(2∶1)混合液萃取2次,合并有机相,用无水Na2SO4干燥后,在40 ℃下减压蒸馏除去有机溶剂,得到浅黄色浆状物,将其在冷阱温度-54 ℃、压力5~10 Pa的条件下冷冻干燥,得到表面活性剂粗产物。
取0.1 g粗产物溶于1 mL氯仿中,点样于硅胶G板进行TLC分析,展开后,喷洒显色剂于100 ℃下加热3~6 min。展开剂为氯仿/甲醇/乙酸(体积比96∶4∶0.5),显色剂为α-萘酚试剂(1.59 g α-萘酚溶于51 mL无水乙醇和4.6 mL 18 mol/L H2SO4)。
2 结果与讨论
2.1 碳源优化
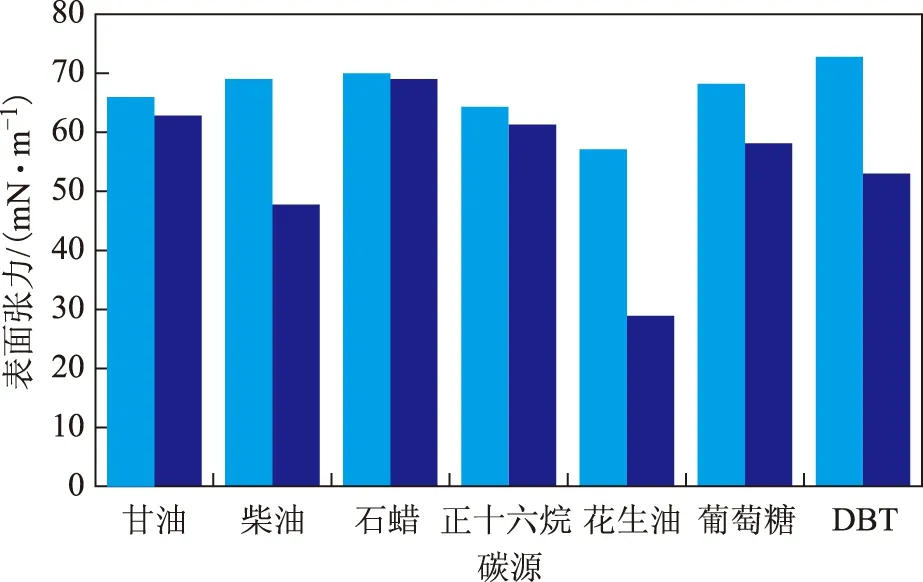
图1 不同碳源对发酵液表面张力的影响■—空白; ■—发酵液
碳源是菌株生长和合成表面活性剂的能量来源,对生物表面活性剂的产量和特性有重要影响[10]。不同碳源对Pseudomonassp. LKY-5产生的表面活性剂特性的影响如图1所示。从图1可以看出:以甘油、液体石蜡、正十六烷、葡萄糖、二苯并噻吩(DBT)为碳源时,发酵液的表面张力降低不明显,均在50 mN/m以上;以柴油和花生油作为碳源时,发酵液表面张力明显降低,尤其是以花生油作为碳源时,发酵液的表面张力能够降至28.9 mN/m,有利于生物表面活性剂的产生。原因可能是油性基质相比水溶性基质更能诱导微生物产生表面活性剂,而葡萄糖所产生的分解代谢物会遏制某些适应性酶的合成[11-12]。
2.2 表面活性剂的化学组分分析及其理化性质测定
2.2.1 表面活性剂的化学组分分析 以氯仿/甲醇/乙酸(体积比96∶4∶0.5)为展开剂,将氯仿提取的粗产物在硅胶G板上展开后,显色反应表明在Rf=0.56处出现淡橙黄色的斑点,对鼠李糖脂显色剂(α-萘酚试剂)呈正反应。同时发现样品点和鼠里糖脂纯品点的Rf值相同,对萘酚试剂都有显色反应,进一步结合相关文献对假单胞菌产生的表面活性剂基本是鼠李糖脂的报道[8,12],初步将Pseudomonassp. LKY-5产生的表面活性剂定性为鼠李糖脂。
2.2.2 表面活性剂的理化性质 经过提取、分离和冷冻干燥后获得的表面活性剂粗产物为淡黄色固体粉末,产量为0.15 g/L。不同浓度表面活性剂的表面张力变化曲线如图2所示。从图2可以看出,随着表面活性剂浓度的增加,溶液的表面张力迅速降低,但随着表面活性剂浓度的进一步增加,溶液的表面张力趋于稳定值(28.9 mN/m),经作图求得临界胶束浓度(CMC)为180 mg/L,远低于十二烷基硫酸钠的CMC(2 200 mg/L)[13]。
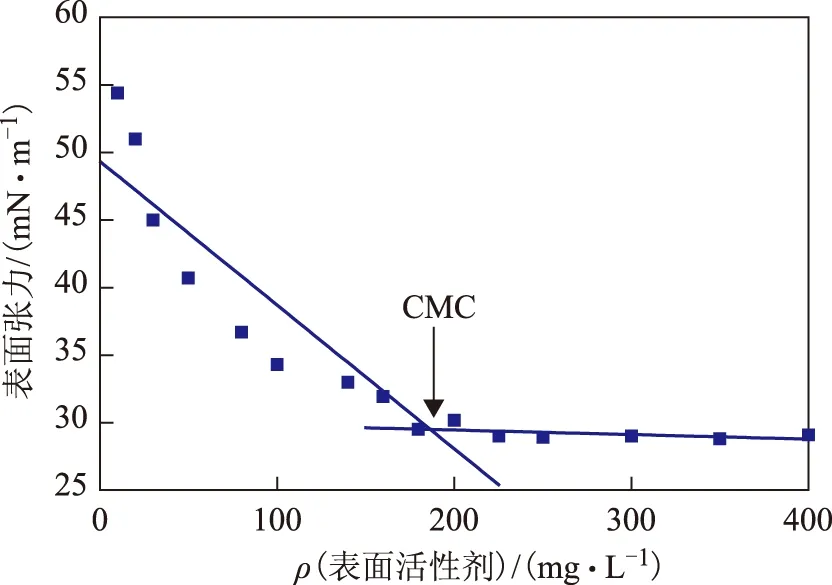
图2 不同浓度表面活性剂的表面张力
一般认为亲水亲油值(HLB)在8~18范围内的表面活性剂可以作为乳化增溶剂[12]。经测定该生物表面活性剂的HLB为12.3,表明其可以对疏水性物质起到增溶作用。乳化性能是表面活性剂的另一个重要指标。表1为浓度1 000 mg/L的该表面活性剂溶液对液体石蜡和柴油的乳化能力,同时以相同浓度的阴离子表面活性剂十二烷基硫酸钠(SDS)水溶液作为对比。从表1可看出,该表面活性剂溶液对柴油和液体石蜡的乳化能力均较SDS水溶液差,对柴油的乳化能力则优于液体石蜡,对柴油24 h的乳化能力达到61%,120 h后还可以保持在56%,乳化相较为稳定。

表1 Pseudomonas sp. LKY-5产生的表面活性剂的乳化能力 %
2.3 表面活性剂的稳定性研究
2.3.1 温度对表面活性剂稳定性的影响 温度对表面活性剂稳定性的影响如图3所示。由图3可以看出,经过30~80 ℃的热处理后表面活性剂的表面张力没有明显变化。Pseudomonassp. LKY-5产生的表面活性剂能够耐受80 ℃高温1 h而不失活,说明其对高温具有较强的耐受性,具有良好的稳定性。
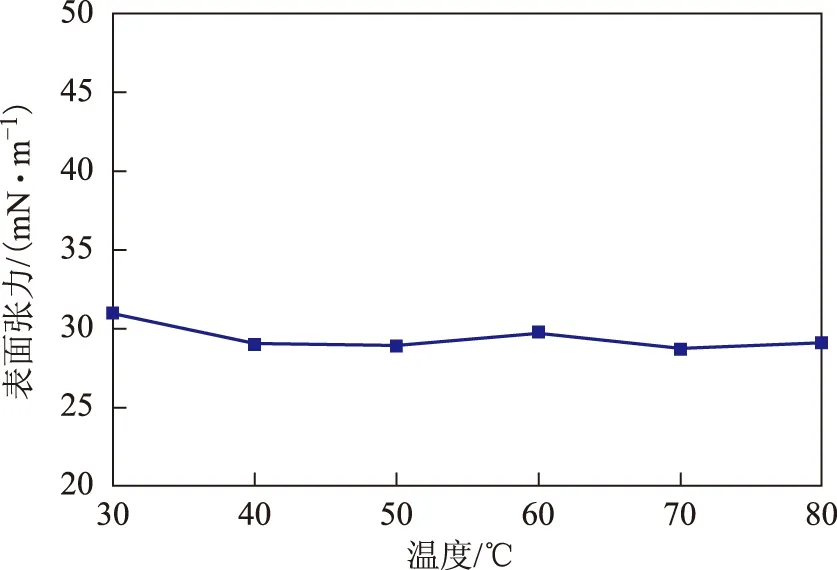
图3 温度对表面活性剂稳定性的影响
2.3.2 pH对表面活性剂稳定性的影响 图4为pH对表面活性剂溶液表面张力的影响。由图4可以看出:表面活性剂溶液的表面张力受pH影响较大;当pH<6时,表面活性剂溶液浑浊而不稳定,表面张力随着pH的降低而迅速增大;当6 图4 pH对表面活性剂稳定性的影响 2.3.3 无机离子对表面活性剂稳定性的影响 不同浓度的NaCl,CaCl2,MgCl2对该生物表面活性剂稳定性的影响见图5。由图5可以看出:NaCl、MgCl2在10~200 g/L范围内对表面活性剂表面张力的影响较小,表面张力基本稳定在30 mN/m;当添加20 g/L以下的CaCl2时,表面张力可以保持在35 mN/m左右,但随着CaCl2浓度的增加,该表面活性剂溶液的表面张力明显上升。与梁生康[12]对铜绿假单胞菌O-2-2产生的鼠李糖脂溶液的研究结果相比(可耐受60 g/L 的NaCl,5 g/L 的MgCl2以及2 g/L的CaCl2),该表面活性剂对盐离子的耐受性能较好。这可能是因为不同菌株产生的鼠李糖脂的组分不完全一样,所以对盐离子的适应程度不同。 图5 无机离子对表面活性剂稳定性的影响●—MgCl2; ▲—CaCl2; ■—NaCl (1) 花生油相比其它碳源更加适合Pseudomonassp. LKY-5产生表面活性剂,可以将发酵液表面张力降至28.9 mN/m,表面活性剂的产量为0.15 g/L。 (2) 经化学组分分析将Pseudomonassp. LKY-5产生的表面活性剂定性为鼠李糖脂,其CMC为180 mg/L,HLB为12.3;乳化性能比十二烷基硫酸钠差,对柴油的乳化能力优于液体石蜡,对柴油24 h的乳化能力达到61%,120 h后仍可保持在50%以上。 (3)Pseudomonassp. LKY-5产生的表面活性剂可以耐受80 ℃的高温,在pH 6~13范围内保持良好的表面活性,添加200 g/L以下的NaCl或MgCl2以及20 g/L以下的CaCl2时其表面张力基本不变。该表面活性剂在高温、高pH、高盐度等极端环境下仍具有很好的表面活性和稳定性能,可以进一步应用于强化盐碱地区石油污染土壤的生物修复。 [1] Eastmond D A,Booth G M,Lee M L.Toxicity, accumulation, and elimination of polycyclic aromatic sulfur heterocycles in Daphnia magna[J].Arch Environ Contam Toxicol,1984,13:105-111 [2] Mezcua M,Boltes K,Leton P,et al.Determination of PASHs by various analytical techniques based on gas chromatography-mass spectrometry:Application to a biodesulfurization process[J].Talanta,2008,75(5):1158-1166 [3] 梁生康,王修林,单宝田,等.生物表面活性剂强化疏水性有机污染物生物降解研究进展[J].化工环保,2005,25(4):276-280 [4] 牛明芬,李凤梅,韩晓日,等.生物表面活性剂产生菌的筛选及表面活性剂稳定性研究[J].生态学杂志,2005,24(6):631-634 [5] 花莉,洛晶晶,胡阳阳,等.产表面活性剂石油降解菌株的筛选及鉴定[J].陕西科技大学学报,2014,32(1):34-38 [6] Christofi N,Ivshina I B.Microbial surfactants and their use in field studies of soil remediation[J].Journal of Applied Microbiology,2002,93(6):915-929 [7] Pedetta A,Pouyte K,Herrera Seitz M K,et al.Phenanthrene degradation and strategies to improve its bioavailability to microorganisms isolated from brackish sediments[J].International Biodeterioration & Biodegradation,2013,84:161-167 [8] Singh G B,Gupta S,Gupta N.Carbazole degradation and biosurfactant production by newly isolatedPseudomonassp. strain GBS.5[J].International Biodeterioration & Biodegradation,2013,84:35-43 [9] Li Lin,Zhao Chaocheng,Liu Qiyou,et al.Optimization for the microbial degradation of dibenzothiophene byPseudomonassp.LKY-5 using response surface methodology[J].China Petroleum Processing and Petrochemical Technology,2014,16(1):19-26 [10]余焱,张志坚,宋柏函,等.一株高效生物表面活性剂产生菌的分离、鉴定及培养条件的优化[J].复旦学报(自然科学版),2012,51(4):501-506 [11]孙燕,洪青,李顺鹏.一株生物表面活性剂产生菌的分离及其特性研究[J].微生物学通报,2009,36(8):1110-1116 [12]梁生康.鼠李糖脂生物表面活性剂对石油烃污染物生物降解影响的研究[D].青岛:中国海洋大学,2005 [13]张建华,冯利智,区尚仁.可见吸收光谱线型参数分析法测定十二烷基硫酸钠临界胶束浓度[J].理化检验-化学分册,2006,42:885-888 STUDY ON BIOSURFACTANT PRODUCED BY PSEUDOMONAS SP. LKY-5 AND ITS STABILITY Li Lin, Zhao Chaocheng, Liu Qiyou, Liu Chunshuang (CollegeofChemicalEngineering,ChinaUniversityofPetroleum(Huadong),Qingdao,Shandong266580) ThePseudomonassp. LKY-5 produces biosurfactant during biodegradation process of dibenzothiophene. This work optimizes the carbon sources for biosurfactant production, verifies the biosurfactant by thin-layer chromatography, and then determines its physicochemical properties, and investigates the influence of temperature, pH and inorganic ions on the active stability of biosurfactant. The results show that the biosurfactant produced is rhamnolipid, and peanut oil is the optimal carbon source for the production of biosurfactant with a yield of 0.15 g/L. The critical micelle concentration (CMC) and hydrophile-lipophile balance (HLB) value of biosurfactant are 180 mg/L and 12.3, respectively. Twenty-four hours diesel emulsification ability is 61%. The biosurfactant is stable at conditions of a temperature of 30—80 ℃, a pH of 6—13, and can tolerate the environment of 200 g/L NaCl (or MgCl2) or 20 g/L CaCl2. Pseudomonas; biosurfactant; rhamnolipid; stability 2014-07-10; 修改稿收到日期: 2014-09-10。 李琳,博士研究生,研究方向为石油污染土壤生物修复。 赵朝成,E-mail:zhaochch@upc.edu.cn。 中央高校基本科研业务费专项资金资助项目(No.12CX06043A);国家自然科学基金资助项目(No.21307160)。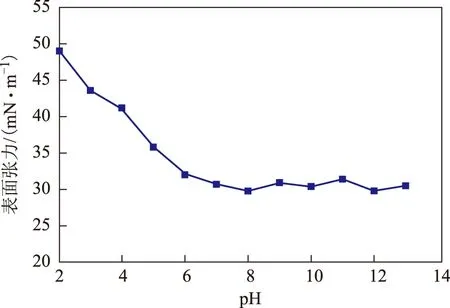

3 结 论

