黄芪注射液对高糖诱导的肾小管上皮细胞凋亡的影响
梅莎莎,宋恩峰,项 琼
(武汉大学人民医院中医科,武汉430060)
黄芪注射液对高糖诱导的肾小管上皮细胞凋亡的影响
梅莎莎,宋恩峰,项琼
(武汉大学人民医院中医科,武汉430060)
[目的]研究黄芪注射液对高糖环境下肾小管上皮细胞(HK-2)凋亡的影响。[方法]传代培养人近曲肾小管上皮细胞,细胞用无血清培养基同步化24 h后,将细胞分为5组:低糖对照组、高糖组、高糖+不同浓度黄芪注射液组(2、20、200 μg/mL),每组设3个复孔。将细胞置于37℃恒温培养箱中培养至24、48、72 h,收集细胞及细胞上清液。用流式细胞仪测定细胞凋亡率。[结果]24、48、72 h,低糖对照组细胞凋亡率明显低于高糖组(P<0.05)。细胞培养24 h,黄芪干预组200和20 μg/mL细胞凋亡率明显低于高糖组(P<0.05)。细胞培养48和72 h,黄芪注射液干预组细胞凋亡率明显低于高糖组(P<0.05)。黄芪注射液干预组各组之间凋亡率比较差异也都有显著性(P<0.05),其干预作用呈剂量依赖性。[结论]黄芪注射液能抑制高糖诱导的肾小管上皮细胞的凋亡,有助于糖尿病肾病的治疗。
糖尿病肾病;肾小管上皮细胞;黄芪注射液;细胞凋亡
近年来糖尿病肾病(DN)发病呈上升趋势,严重威胁着人们的健康,其发病机制仍不十分清楚。有研究表明肾小管损伤在糖尿病肾病发病早期就已经存在,肾小管损伤的其中一种表现形式为肾小管上皮细胞凋亡。高血糖在糖尿病肾病的发病机制中可作为独立危险因子,对肾间质及肾小管都有损伤作用,可诱导肾小管上皮细胞凋亡率的增加。肾小管上皮细胞的凋亡在糖尿病肾病早期就已经发生,过度的凋亡可导致肾小管结构和功能损害,最终导致肾功能衰竭,因此肾小管上皮细胞凋亡与糖尿病肾病发病关系密切。黄芪注射液是黄芪植物中提炼出来的有效成分,对肾脏组织有保护作用,但是否对肾小管上皮细胞凋亡有影响仍不清楚。本实验通过高糖诱导肾小管上皮细胞发生凋亡,探讨黄芪注射液对细胞凋亡的影响。
1 材料与方法
1.1材料人近曲肾小管上皮细胞株(HK-2),武汉大学人民医院肾内科实验室惠赠;黄芪注射液,哈尔滨圣泰制药股份有限公司,国药准字Z23020820;DMEM高糖、低糖培养液,吉诺生物医药技术有限公司;胎牛血清,赛默飞世尔生物化学制品有限公司;0.25%胰酶溶液、青-链霉素溶液、磷酸盐缓冲液(PBS),吉诺生物医药技术有限公司;DMSO,Sigma公司;Annexin V/PI凋亡试剂盒,Clontech公司;流式细胞仪,Becton Dickinson公司。
1.2方法
1.2.1细胞培养将HK-2细胞培养于浓度为10%胎牛血清及1%双抗的DMEM低糖完全培养基。放入37℃、5%二氧化碳(CO2)培养箱中培养。用倒置显微镜观察HK-2细胞成鹅卵石或铺路石样排列,并铺满瓶底面积约80%~90%时可进行细胞传代,传代比例为1∶2~1∶4,每2~3 d传代1次,取第7代细胞用于实验。
1.2.2实验分组与处理待细胞融合至80%,将培养基换成无血清DMEM低糖培养基同步化24 h后,弃去无血清培养基。将细胞分为5组:1)低糖对照组(A组):低糖培养基含D-葡萄糖5.5 mmol/L。2)高糖组(B组):高糖培养基含D-葡萄糖25 mmol/L。3)高糖+黄芪注射液小剂量组(C组):高糖培养基+2 μg/mL黄芪注射液。4)高糖+黄芪注射液中剂量组(D组):高糖培养基+20 μg/mL黄芪注射液。5)高糖+黄芪注射液大剂量组(E组):高糖培养基+ 200 μg/mL黄芪注射液,每组设3个复孔。于37℃培养箱中培养24、48、72 h,收集细胞及细胞上清液用于后续实验。
1.2.3流式细胞术测定HK-2细胞凋亡率将对数期生长细胞接种于6孔板中,待细胞融合至70%~80%时,将培养基换成无血清DMEM低糖培养基同步化24 h后,将细胞按上述分组,每个样本设置3个复孔,分别于培养24、48、72 h后进行细胞收集。吸取细胞上清液至15 mL离心管中。用PBS溶液清洗贴壁细胞,并将PBS吸取至离心管中。用胰酶消化细胞后,将细胞混悬液转移至离心管中。1 000 rpm离心10 min,弃上清液,用4℃预冷PBS洗涤细胞两次。用250 μL结合缓冲液重悬细胞,并调节细胞浓度为1×105~1×106/mL,在重悬液中依次加入5 μL Annexin-Ⅴ-FITC和5 μL Propidium Iodide(PI),混匀后避光在冰上孵育15min。在反应管中加入400μL 1×Binding Buffer后,上流式细胞仪进行定量分析。1.3统计学方法采用SPSS 17.0软件处理。所有的数据均以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,P<0.05为差异有统计学意义。
2 结果
黄芪注射液对高糖诱导的HK-2细胞凋亡的影响。Annexin-Ⅴ/PI双染流式细胞仪检测显示,细胞培养24、48、72h后,B组凋亡率明显高于A组(P<0.05),提示高糖有诱导HK-2细胞凋亡的作用;细胞培养24 h,E组和D组凋亡率明显低于B组(P<0.05),E组凋亡率明显低于D和C组(P<0.05);细胞培养48和72 h,C、D、E组凋亡率明显低于B组(P<0.05),且C、D、E 3组之间凋亡率比较差异也都有显著性(P<0.05),其凋亡率随着黄芪注射液浓度的升高逐渐下降,提示黄芪注射液有抑制细胞凋亡的作用,并与浓度呈正比,呈剂量依赖性。见表1,图1。
表1 不同浓度黄芪注射液对HK-2细胞凋亡率的影响Tab.1Influence of cell apoptotic rates by different concentration of Astragalus injection in HK-2 cells
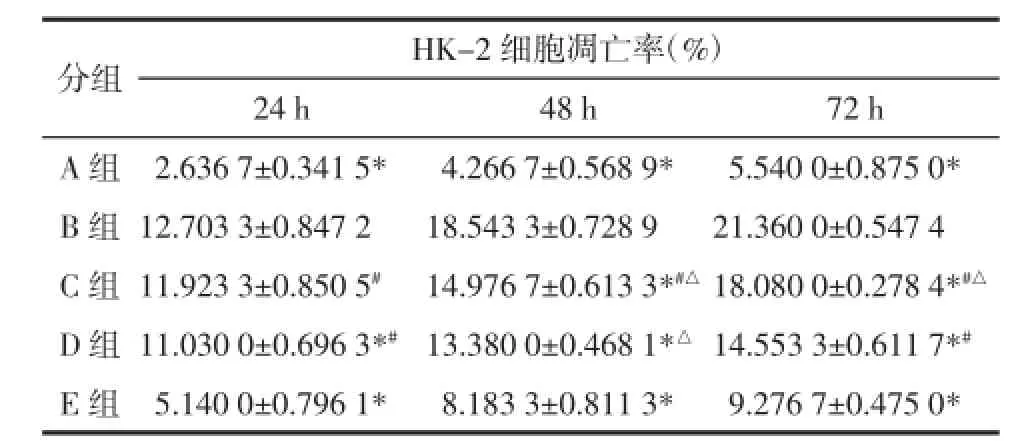
表1 不同浓度黄芪注射液对HK-2细胞凋亡率的影响Tab.1Influence of cell apoptotic rates by different concentration of Astragalus injection in HK-2 cells
注:与B组比较,*P<0.05;与E组比较,#P<0.05;与D组比较,△P<0.05。
分组A组B组C组D组E组HK-2细胞凋亡率(%)24 h48 h72 h 2.636 7±0.341 5*4.266 7±0.568 9*5.540 0±0.875 0* 12.703 3±0.847 218.543 3±0.728 921.360 0±0.547 4 11.923 3±0.850 5#14.976 7±0.613 3*#△18.080 0±0.278 4*#△11.030 0±0.696 3*#13.380 0±0.468 1*△14.553 3±0.611 7*#5.140 0±0.796 1*8.183 3±0.811 3*9.276 7±0.475 0*
3 讨论
随着现代生活水平的提高以及人口老龄化的趋势,糖尿病发病率明显升高,糖尿病肾病作为糖尿病的常见并发症也逐渐引起人们的关注[1]。既往研究表明肾小球损伤是DN的主要发病机制,近年发现肾小管损伤可能早于肾小球损伤,在DN患者蛋白尿排泄率正常时可能就已经发生了肾小管的损伤[2]。在糖尿病肾病发病过程中肾小管损伤的重要表现之一就是肾小管上皮细胞的凋亡。有研究表明对DN患者取肾脏组织进行病理检查发现肾小管及肾小球细胞都有明显凋亡,肾小管的凋亡程度与糖尿病病程及低密度脂蛋白胆固醇有相关性[3]。
在糖尿病肾病发病过程中高血糖是一个重要的独立危险因子,有研究证明长期高血糖诱发糖尿病肾病,从80年代开始的两个研究—糖尿病前瞻性研究和糖尿病控制与并发症实验都得出结论:控制高血糖可以减少DN的发生[4-5]。高血糖也可诱导肾小管上皮细胞凋亡率的增加。在糖尿病肾病的早期阶段就发生了细胞凋亡,过度的凋亡可导致肾小管结构和功能的损害,最终导致肾功能衰竭。近年的研究表明细胞凋亡与糖尿病肾病的发病机制密切相关。有研究表明在高糖状态下培养肾小管上皮细胞及大鼠糖尿病体内实验中,肾小管上皮细胞凋亡率明显增加,认为细胞凋亡参与了DN的发病过程,这与本实验高糖组细胞凋亡率明显高于低糖对照组相一致,但高糖诱导肾小管上皮细胞凋亡的机制仍不明确,目前人们较为认可的观点有Toll样受体途径[6],细胞外信号调节激酶途径[7],c-Jun氨基末端激酶途径[8],p38丝裂原活化蛋白激酶途径[9]等诱导细胞凋亡。
肾小管凋亡与糖尿病肾病发病关系密切外,还可引起肾脏缺血再灌注损伤,导致肾功能障碍[10-13]。其机制可能与肾缺血再灌注期间,叉头框蛋白FOXO3a能激活Fas配体,协同JNK激活促进肾小管上皮细胞凋亡,加剧肾缺血再灌注损伤有关[14]。
研究表明中医药能降低糖尿病肾病患者血糖,减轻蛋白尿,保护肾功能及减轻并发症等作用[15-17]。黄芪是补气的传统中药,有益气固表,托毒生肌,利水消肿等作用。在现代医学领域主要治疗糖尿病、慢性肾炎、冠心病、心力衰竭、脑梗死等。药理研究表明黄芪有效成分能增加机体免疫力,清除体内自由基,保护肝脏,抑制细胞凋亡[18-20]等作用,对人体多个系统都有影响。
黄芪注射液的有效成分有皂苷类、黄芪多糖及大量微量元素。黄芪注射液可用于治疗病毒性心肌炎、心力衰竭、慢性肝炎、白细胞减少症、血小板减少性紫癜、慢性肾炎、肾病综合征、糖尿病肾病等。研究发现黄芪水煎剂能抑制肾缺血再灌注损伤大鼠肾小管细胞的凋亡,并呈剂量依赖性,其机制是通过促进抗凋亡基因的表达及抑制促凋亡基因的表达实现的[21]。黄芪甲苷孵育脂肪源性干细胞对顺铂诱导肾小管上皮细胞凋亡也有抑制作用,作用机制可能与增加胰岛素样生长因子1分泌,抑制caspase-3表达,上调Bcl-2水平有关[22]。
图1 24、48、72 h各组HK-2细胞凋亡情况Fig.1Apoptotic rates in different groups of HK-2 in 24,48 and 72 h
本实验流式细胞检测表明24、48、72 h,高糖组细胞凋亡率明显高于低糖对照组(P<0.05),黄芪注射液干预组细胞凋亡率低于高糖组,但仍高于低糖对照组,且细胞凋亡率随黄芪注射液的浓度升高而降低,提示黄芪注射液浓度和细胞凋亡率呈负相关,有剂量依赖性。但黄芪注射液作为中药提取物,其成分复杂,对HK-2细胞抗凋亡具体成分及作用机制并不十分清楚,还有待进一步研究,为临床治疗糖尿病肾病提供依据。
[1]中华中医药学会.糖尿病中医防治指南[M].北京:中国中医药出版社,2007.
[2]Abdel Aziz MT,Wassef MA,Ahmed HH,et al.The role of bone marrow derived-mesenchymal stem cells in attenuation of kidney function in rats with diabetic nephropathy[J].Diabetol Metab Syndr,2014,6(1):34.
[3]Verzola D,Gandolfo MT,Ferrario F,et al.Apoptosis in the kidneys of patients with typeⅡdiabetic nephyopathy[J].Kidney Int,2007(72):1262-1272.
[4]The Control and Complication Trial Research Group.The effect of intensive treatment of diabrtes on the development and progression of long-term complication in insulin-depentment diabetes mellitus[J].N Engj Med,1993:329-342.
[5]Prospective Diabetes Study(UPDS)Group.Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes[J]. Lancet,1998(352):837-845.
[6]Allam R,Scherbaum CR,Darisipudi MN,et al.Histones from dyingrenal cells aggravate kidney injury via TLR2 and TLR4[J].J Am Soc Nephrol,2012,23(8):1375-1388.
[7]Mohamed R,Jayakumar C,Ranganathan PV,et al.Kidney proximal tubular epithelial-specific overexpression of netrin-1 suppresses inflammation and albuminuria through suppression of COX-2-mediated PGE2 production in streptozotocin-induced diabetic mice[J].Am J Pathol,2012,181(6):1991-2002.
[8]Benedetti G,Fredriksson L,Herpers B,et al.TNF-α-mediated NF-κB survival signaling impairment by cisplatin enhances JNK activation allowing synergistic apoptosis of renal proximal tubular cells[J].Biochem Pharmacol,2013,85(2):274-286.
[9]Gong X,Wang Q,Tang X,et al.Tetramethylpyrazine prevents contrast-induced nephropathy by inhibiting p38 MAPK and FoxO1 signaling pathways[J].Am J Nephrol,2013,37(3):199-207.
[10]Havasi A,Borkan SC.Apoptosis and acute kidney injury[J].Kidney Int,2011,80(1):29-40.
[11]Wang Y,Ji HX,Xing SH,et al.SP600125,a selective JNK inhibitor,protects ischemic renal injury via suppressing the extrinsic pathways of apoptosis[J].Life Sci,2007,80(22):2067-2075.
[12]康伟,徐燕颖.地黄多糖对糖尿病肾病大鼠模型的治疗作用及对RAGE/NF-κB信号通路的影响[J].天津中医药,2015,32(6):364-367.
[13]马丽,车树强.消渴肾方对早期糖尿病肾病血液流变学、尿白蛋白排泄率及血浆内皮素1的影响[J].天津中医药,2011,28(6):454-456.
[14]徐剑,王艳,姬怀雪,等.FoxO3a激活FasL介导肾缺血再灌注中肾小管上皮细胞凋亡的作用及机制[J].中国临床药理学杂志,2014,30(10):929-931.
[15]俞翔,陈敏.中西医结合治疗糖尿病肾病疗效观察[J].现代中西医结合杂志,2012,21(28):3107-3108.
[16]刘伟敬,梁碧婵,胡海滢,等.“益气养阴通络法”通过调控SIRT1延缓糖尿病肾病进展的研究[J].中国中西医结合肾病杂志,2013,14(3):198-202.
[17]周静鑫,吴丽丽,秦灵灵,等.中医药治疗糖尿病肾病临床研究现状[J].中国中西医结合肾病杂志,2012,13(10):935-937.
[18]闫凤霞,高维娟,钱涛,等.黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的作用[J].中国药理学通报,2011,27(1):85-90.
[19]宋光,何蕾,江朝光.黄芪注射液对培养乳鼠心肌细胞再灌注损伤的保护作用[J].中国体外循环杂志,2007,5(4):832-834.
[20]杨明,杨敏,黄为民,等.黄芪有效成分抗PC12细胞缺氧损伤作用的研究[J].中国优生与遗传杂志,2008,16(10):38-43.
[21]陈宜方,桂定坤,陈建国,等.黄芪水煎剂对肾缺血再灌注损伤大鼠肾小管细胞凋亡的影响[J].中华中医药学刊,2012,30(6):1293-1295.
[22]王葳,姜燕,王巍巍,等.黄芪甲苷孵育脂肪源性干细胞对顺铂诱导肾小管上皮细胞凋亡的影响[J].中国组织工程研究,2014,18(28):4498-4503.
(本文编辑:马英,高杉)
Influence of Astragalus on cell apoptosis induced by high glucose in human proximal renal tubular epithelial cells
MEI Sha-sha,SONG En-feng,XIANG Qiong
(Department of Traditional Chinese Medicine,Renmin Hospital of Wuhan University,Wuhan 430060,China)
[Objective]To investigate the influence of Astragalus on cell apoptosis induced by high glucose in human proximal renal tubular epithelial cells(HK-2).[Methods]Human renal proximal tubular cells were cultured and divided into five groups:low glucose as control group,high glucose group,Astragalus pretreatment group with concentration of 2,20 and 200 μg/mL.Each group has three samples,cultured in 37℃incubator for 24,48 and 72 hours,and collected cells and cell supernatant fluid.Apoptosis rate was measured by flow cytometry.[Results]When cells were cultured 24,48 and 72 h,and the apoptosis rate of control group were significantly lower than high glucose group(P<0.05).When cells were cultured 24 h,the apoptosis rate of 200 and 20 μg/mL group significantly lower than high glucose group(P<0.05).When cells were cultured 48 and 72 h,the apoptosis rate of 200,20 and 2 μg/mL group significantly lower than high glucose group(P<0.05).The apoptosis were significant different between Astragalus injection groups(P<0.05),and the effect of Astragalus were showed in dose-dependent manner.[Conclusion]Astragalus can suppress cell apoptosis induced by high glucose in human proximal renal tubular epithelial cells,which could be a novel approach of treating diabetic nephropathy.
diabetic nephropathy;renal tubular epithelial cell;Astragalus injection;cell apoptosis
R587.2
A
1672-1519(2015)10-0610-04
10.11656/j.issn.1672-1519.2015.10.08
梅莎莎(1986-),女,硕士,住院医师,主要从事糖尿病肾病的中西医结合治疗研究。
宋恩峰,E-mail:songef@126.com。
(2015-05-20)

