不同氧条件下吉非替尼对肺非小细胞肺癌细胞增殖的影响
武玲等

[摘要] 目的 对比研究常氧(21%)、低氧(5%)和高氧(40%)条件下不同浓度吉非替尼(gefitinib)对人非小细胞肺癌(NSCLC)细胞株A549、HCC827、SK-MES-1增殖的影响,并探讨可能的机制。方法 分别在常氧、低氧和高氧条件下以0、10、20、40、60 μmol/L gefitinib处理A549、HCC827、SK-MES-1细胞,培养24 h 后收集细胞, 以CCK-8法检测细胞增殖抑制率;应用实时荧光定量PCR检测HIF-1α mRNA、VEGF-C mRNA、EGFR mRNA的表达情况。 结果 常氧、低氧及高氧条件下,细胞增殖抑制率随吉非替尼浓度的增加、氧浓度的升高而增加(均P<0.001)。高氧条件下,与乏氧相关的HIF-1α、VEGF-C、EGFR mRNA在A549细胞、HCC827细胞均明显减弱(P<0.05),而SK-MES-1细胞组无统计学意义。结论 吉非替尼可以显著抑制肿瘤细胞增殖,且随着氧浓度增加作用增强,可能机制是提高氧浓度可以进一步下调活化的HIF-1α、VEGF-C、EGFR mRNA的表达。
[关键词] 氧浓度;非小细胞肺癌;细胞增殖;吉非替尼;表皮生长因子受体
[中图分类号] R59 [文献标识码] A [文章编号] 1674-0742(2015)06(c)-0112-03
[Abstract] Objective To investigate the effects of gefitinib on the proliferation of non-small cell lung cancer (NSCLC) cell line A549, HCC827, and SK-MES-1 under different oxygen conditions and explore the underlying molecular mechanism. Methods Under the condition of normal oxygen, low oxygen and high oxygen, Human NSCLC A549, HCC827, SK-MES-1cells were cultured in 0,10,20,40,60μmol/L gefitinib. The cells were collected one day after and cell proliferation inhibition rate were investigated by CCK-8 assay and of real-time fluorescent quantitative PCR was applied to detect the expression of HIF-1α mRNA, VEGF-C mRNA, EGFR mRNA. Results CCK-8 assay results showed that under the condition of normal oxygen, low oxygen and high oxygen, cell proliferation inhibition rate increase with the increasing of the concentration of gefitinib and the rising of oxygen concentration (P<0.001) .Under the condition of high oxygen, related to the lack of oxygen of HIF - 1 alpha, VEGF - C, EGFR mRNA in A549 cells, HCC827 cells were significantly reduced (P < 0.05), while SK - MES - 1 cell groups has no statistical significance. Conclusion Gefitinib can significantly inhibit tumor cell proliferation and its effect enhances with the increasing of oxygen concentration. The possible mechanism is that the improvement of the oxygen concentration can further lower the expression of activated HIF-1α, VEGF-C, EGFR mRNA
[Key words] Oxygen concentration; Non-small-cell lung cancer; Cell proliferation; Gefitinib; Epidermal growth factor
绝大多数的恶性实体肿瘤具有肿瘤细胞增殖速度快和肿瘤血管结构、功能异常的特点,导致肿瘤组织内乏氧,药物通过物理性弥散途径到达作用靶区困难,降低疗效,从而造成肿瘤细胞耐药性的发生[1-2]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是肿瘤细胞为适应乏氧微环境环境而启动的一系列生物学改变的关键调控因子[2]。目前,阻断表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂吉非替尼是人肺非小细胞肺癌癌(non-small cell lung cancer,NSCLC)靶向治疗临床应用广泛的药物[3]。如何通过改善肿瘤微环境提升人肺非小细胞肺癌细胞对吉非替尼的敏感性需要进一步研究。该研究采用CCK-8法和RT-PCR法探讨适度提高氧浓度,吉非替尼对A549、HCC827、SK-MES-1细胞株增殖的影响及其可能的内在机制,现报道如下。endprint
1 材料与方法
1.1 细胞及主要试剂
实验时间为2014年1月—2015年1月,A549、HCC827、SK-MES-1细胞株均购自中国科学院细胞库, 吉非替尼由英国Astra Zeneca有限公司惠赠。F12K培养基、RPMI-1640培养基、MEM培养基购于HyClone公司。胎牛血清购于天津康源生物有限公司;0.25%胰酶-EDTA购自HyClone公司;CCK-8试剂盒购自日本化工公司;DMSO购自Sigma公司;细胞RNA提取试剂盒购自北京康为世纪生物科技有限公司;PCR反转录试剂盒购自TaKaRa公司;PCR试剂盒购自上海生工生物工程股份有限公司;RT-PCR试剂盒购自TaKaRa公司。
1.2 方法
1.2.1 细胞培养与分组 ①A549细胞培养于含 10% FBS的F12K培养基中。②HCC827细胞培养于含10%FBS的RPMI-1640培养基中。③SK-MES-1细胞培养于含10%FBS的MEM培养基中。细胞贴壁80%时以0.25%胰酶消化重悬,调整细胞密度按氧条件、药物浓度分组,待各组细胞处于对数生长期,实验组加入相应浓度吉非替尼,对照组加相应体积的二甲基亚砜溶液。
1.2.2 药物配制和使用 取gefitinib(250 mg/片)一片制成粉末,溶于4 mLDMSO配制成140 mmol/L的药物原液置于-20℃保存, 实验前用无血清RPMI-1640培养液稀释成所需浓度, 每次实验中DMSO的最高终浓度小于0.03%。
1.2.3 细胞增殖检测 取对数生长期细胞, 每孔100μL接种于96孔培养板中。24 h后分别加入不同浓度的gefitinib( 0、10、20、40、60 μmol/L)、对应的全培养液为空白对照, 每组设置3个平行复孔。置不同氧浓度、37℃、5% CO2的培养箱中培养24 h后, 每孔加CCK-8 10μL混匀, 37℃孵育4 h,酶标仪检测波长450 nm的每孔吸光度值(A值)求其平均值。据吸光度值计算细胞抑制率。上述实验重复3次。
1.2.4 实时荧光定量PCR检测 三种人肺癌细胞调整细胞浓度为5×105/mL,每孔 1 mL接种于6孔板,培养约6 h后细胞贴壁,取出各块培养板,吸去各孔上清液,按分组每孔2mL加入0、40 μmol/L的gefitinib。空白对照组以相同体积的培养基代替。按分组培养24 h后收集细胞悬液12 000rpm离心1 min弃上清得到细胞沉淀。细胞充分裂解,提取出RNA,反转录为cDNA,反转录反应条件设置为42℃ 15 min。RT-PCR每个体系为20 μL,其中cDNA为1.4 μL、引物1.6 μL。每孔均需设置3个复孔。此实验重复3次。
1.3 统计方法
用SPSS 17.0软件进行3×3×5析因设计、两两比较采用F检验,实验数据以(x±s)表示, t检验和方差分析。
2 结果
2.1 常氧、低氧和高氧条件下,吉非替尼对人肺癌A549、HCC827、SK-MES-1细胞株增殖的抑制
同一氧浓度下,不同浓度的gefitinib作用于同一细胞株24 h,细胞增殖抑制率显著高于对照组(P<0.05),由表1、2、3得细胞增殖抑制率随gefitinib浓度增加而增加(P<0.05)。但同一氧浓度下,随药物浓度增加,不同细胞的增殖能力不同(P<0.05),可见高氧条件下,HCC827细胞增殖能力最差。在处理同一种细胞时,随着药物浓度、氧浓度越高,细胞增殖能力明显减弱(P<0.05),3种细胞均可见高氧条件下gefitinib浓度为60 μmol/L时细胞增值抑制率最高。就相同作用时间、相同浓度gefitinib而言,高氧、常氧和低氧条件下细胞增殖抑制率有差异有统计学意义(P<0.05)。且有HCC827细胞在高氧条件下,在gefitinib浓度为60 μmol/L时的OD值最小,细胞增殖能力最差。
2.2 常氧、低氧和高氧条件下相关指标比较
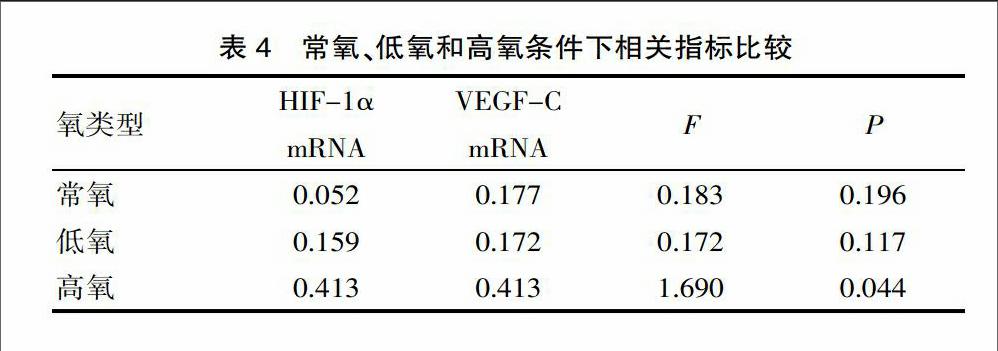
常氧、低氧和高氧条件下,运用0、40 μmol/L的gefitinib作用于A549细胞24 h后,HIF-1α mRNA、VEGF-C mRNA表达量在高氧条件下明显下降,其表达量分别为0.413μm ol/L和0.479 μmol/L,与常氧、低氧相较差异有统计学意义(P<0.05),但常氧和低氧条件下差异无统计学意义。见表4。
3 讨论
吉非替尼是一种选择性酪氨酸酶抑制剂,通过与ATP竞争性结合胞外的配体结合位点,阻断酪氨酸激酶的活化过程,抑制EGFR激活,从而抑制细胞增殖和血管生成,促进肿瘤细胞凋亡[3]。值得注意的是,药物临床有效率低[4]。考虑与实体肿瘤细胞和细胞间质两者之间所构成的肿瘤-宿主界面微环境的平衡状态有关[5]。肿瘤微环境的新生血管的结构与功能异常、乏氧,导致远离血管的肿瘤组织不能达到有效的治疗药物浓度[5],这是实体肿瘤非手术治疗疗效差的主要因素,增加了恶性肿瘤的侵袭性和远处转移几率[6]。
该实验选用人非小细胞肺癌细胞株原发耐药株A549、敏感株HCC827、鳞状细胞癌SK-MES-1为研究对象,改变氧浓度及药物浓度,检测其对细胞增殖、HIF-1α、VEGF-C 及EGFR 的mRNA表达的研究。以探讨能否通过改变氧浓度提高细胞对于药物的敏感性。研究结果显示,随着氧浓度的适度提高、药物浓度的增加,A549、HCC827、SK-MES-1细胞的增殖受到明显抑制,且以HCC827细胞株为著。另外,A549细胞株可见HIF-1α mRNA、VEGF-C mRNA、EGFR mRNA表达量在高氧条件下明显下降,值得注意的是在常氧和低氧条件下,EGFR mRNA的表达随氧浓度增加而下降,HIF-1α mRNA、VEGF-C mRNA表达无差异。HCC827细胞VEGF-C mRNA、EGFR mRNA表达量随着氧浓度升高,表达量下降,而HIF-1α mRNA表达量仅在高氧条件下明显下降。SK-MES-1细胞24 h后,HIF-1α mRNA、VEGF-C mRNA、EGFRmRNA表达量无明显改变。已有研究证实通过调节HIF-1α的表达可以改善乏氧微环境导致的吉非替尼耐药的发生[7]。西妥昔单抗、雷帕霉素均已被证实可以作用于乏氧微环境下非小细胞肺癌中乏氧诱导因子HIF-1α的表达来诱导肿瘤细胞的凋亡[8-9]。多项研究发现[8-10],血管内皮生长因子(vascular endothelial growth factor ,VEGF)是HIF-1α下游的一个重要的靶点,在肿瘤细胞乏氧微环境中HIF-1α和VEGF的表达明显上调,VEGF mRNA表达量随HIF-1α mRNA表达量增高而增高。实验证实[10],通过一些手段阻断HIF-1α表达可以抑制肿瘤细胞产生VEGF,抑制肿瘤异常血管生成。该实验说明适度给予高氧可以下调HIF-1α mRNA的表达,进一步下调肿瘤细胞A549、HCC827细胞VEGFmRNA的表达来参与抑制肿瘤异常血管的新生,改善正常血管的血供,从而改善肿瘤乏氧的微环境,提高肿瘤微环境的药物浓度。然而肺鳞癌SK-MES-1细胞株各实验组的结果与二者有差异,可能是由其他机制导致,尚需进一步深入研究。该研究数据与目前国内外研究成果相近,但该研究数据显示,高氧情况下吉非替尼能够有效抑制A549、HCC827以及SK-MES-1细胞的增值。该研究中,常氧、低氧和高氧条件下,运用0、40 μmol/L的gefitinib作用于A549细胞24 h后,HIF-1α mRNA、VEGF-C mRNA表达量在高氧条件下明显下降,其表达量分别为0.413 μm ol/L和0.479 μmol/L,与常氧、低氧相较差异有统计学意义(P<0.05),但常氧和低氧条件下差异无统计学意义。endprint
综上所述,该研究通过适度提高肿瘤微环境的氧浓度,论证能否提高肿瘤细胞对吉非替尼的敏感性。结果表明,高氧情况下吉非替尼可以显著抑制A549、HCC827、SK-MES-1细胞的增殖,且可能通过下调HIF-1相关基因表达有关。研究结果提示,适度提高氧浓度能够改善肿瘤组织缺氧所致的低氧应激基因的表达和肿瘤细胞凋亡功能异常,从而提高肿瘤细胞对药物的敏感性,且这种改变具有一定的普遍性,有一定的临床指导意义。
[参考文献]
[1] Otrock ZK,Hatoum HA,Awada AH,et al.Hypoxia-inducible factor in cancer angiogenesis: structure, regulation and clinical perspectives[J].Crit Rev Oncol Hematol,2012,70(2):93-102.
[2] HANNA S C,KRISHNAN B,BAILEY S T,et al.HIF1alpha and HIF2alpha independently activate SRC to promote melanoma metastases[J].J Clin Invest,2013,123(5) : 2078-2093.
[3] Negoro S,Nakagawa K,Fukuoka M,et al.Final results of a phase I in termittent doseescalation trial of ZD1839(Iressa)in Japanese patients with various solid tumours [J].Proc Am Soc Clin Oncol,2013,20(12):1292.
[4] Chang A,Parikh P,Thongprasert S,et al.Gefitinib(IRRESSA)in patients of Asian origin with refractory advanced nonsmall cell lung cancer:subset analysis from the ISEL study[J].Thorac Oncol,2013,1(8):847-855.
[5] MARIE EGYPTIENNE D T,LOHSE I,HILL R P.Cancer stem cells,the epithelial to mesenchymal transition (EMT) and radioresistance:potential role of hypoxia[J].Cancer Lett,2013,341(1) : 63-72.
[6] Hennessey D,Martin L M,Atzberger A,et al.Exposure to hypoxia following irradiation increases radioresistance in prostate cancer cells[J].Urol Oncol,2013,31(7 ) :1106-1116.
[7] Rho JK,Choi YJ,Lee JK,et al.Gefitinib circumvents hypoxiainduced drug resistance by the modulation of HIF-1alpha[J].Oncol Rep,2012,21(3): 801-807.
[8] Li X, Fan Z.The epidermal growth factor receptor antibody cetuximab induces autophagy in cancer cells by downregulating HIF-1alpha and Bcl-2 and activating the beclin 1/hVps34 complex[J]. Cancer Res,2011,70(14):5942-5952.
[9] Chen B,Yuping S,Ni J.Rapamycin decreases survivin expression to induce NSCLC cell apoptosis under hypoxia through inhibiting HIF-1alpha induction[J].Mol Biol Rep,2012,39(1): 185-191.
[10] Baldewijns MM, Thijssen VL, Van den Eynden GG, et al. High-grade clear cell renal cell carcinoma has a higher angiogenic activity than low-grade renal cell carcinoma based on histomorphological quanti-ication and qRT-PCR mRNA expression profile[J]. Br J Cancer,2013, 96(12):1888-1895.
(收稿日期:2015-03-27)endprint

