肌肽对局灶性脑缺血大鼠bcl-2、bax表达的影响
朱洁,马茜,王辛,刘翠梅,王爱红
肌肽对局灶性脑缺血大鼠bcl-2、bax表达的影响
朱洁,马茜,王辛,刘翠梅,王爱红△
目的研究肌肽对局灶性脑缺血大鼠缺血皮质区B淋巴细胞瘤/白血病-2(bcl-2)、bcl-2相关蛋白X (bax)表达的影响。方法30只SPF级雄性SD大鼠随机分为假手术组、模型组和肌肽组,每组10只。模型组和肌肽组以线栓法制作大鼠永久性脑缺血模型,肌肽组于造模后予肌肽水溶液灌胃[1 000 mg/(kg·d)],其余2组予等量生理盐水灌胃。分别于造模后清醒时、24 h、72 h通过神经功能缺损评分观察神经功能,于72 h采用2,3,5-三苯基氯化四氮唑(TTC)染色观察脑梗死体积、HE染色观察病理形态学改变,并用免疫组化法检测bcl-2和bax表达。结果肌肽组神经功能评分72 h较模型组降低(P<0.05);脑组织缺血损伤病理学改变轻于模型组;脑梗死体积72 h较模型组减小(P<0.01);脑缺血后72 h与假手术组相比,模型组bcl-2表达下降、bax表达上升、bcl-2/bax比值下降(均P<0.05);经肌肽处理后bcl-2表达上升、bax表达下降,bcl-2/bax比值上升(P<0.01或P<0.05)。结论肌肽处理能提高bcl-2表达、降低bax表达及提高bcl-2/bax比值,这可能是肌肽发挥神经保护作用的分子机制之一。
肌肽;脑缺血;基因,bcl-2;bcl-2相关X蛋白质;bcl-2/bax
缺血性脑卒中占全脑卒中的85%左右[1],其中大多由大脑中动脉阻塞引起。脑缺血引起神经细胞凋亡,细胞凋亡在迟发型神经元死亡中起重要作用。B淋巴细胞瘤/白血病-2(bcl-2)和bcl-2相关蛋白X(bax)在细胞凋亡中起重要调控作用,bcl-2具有抗细胞凋亡作用,而bax作用相反[2]。近年来,研究发现bcl-2和bax调节细胞凋亡不仅取决于自身的表达水平,还与bcl-2/bax比值有关[3]。研究表明,肌肽对缺血性脑损伤具有保护作用,且具有剂量依赖性,以1 000 mg/kg剂量效果最佳[4-5]。但研究大多集中于脑缺血后24 h,且大多未观察肌肽对bcl-2/bax比值的影响。本研究通过制作局灶性脑缺血大鼠模型,观察肌肽对脑缺血大鼠损伤脑组织bcl-2、bax蛋白表达和bcl-2/bax比值的影响,探讨肌肽的脑保护作用的可能机制,为其治疗缺血性脑血管疾病提供实验依据。
1 材料与方法
1.1实验动物及分组健康雄性SD大鼠30只,SPF级,体质量280~320 g,由南京中医药大学实验动物中心提供[合格证编号:SCXK(浙)2008-0033]。随机数字表法分为假手术组、模型组和肌肽组,每组10只。
1.2实验材料和仪器大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)线栓(北京沙东生物技术有限公司);肌肽、2,3,5-三苯基氯化四氮唑(TTC,美国sigma公司);bcl-2、bax抗体(巴傲得生物技术有限公司);ElivisionTMsuper免疫组化试剂盒(福建迈新生物技术有限公司);Histostar包埋机、Finesse E+手动切片机(美国Thermo公司);BX41显微镜(日本OLYMPUS公司);全自动染色机(英国Shandon公司);ASP300S全自动真空组织脱水机(德国Leica公司)。
1.3实验方法
1.3.1大鼠局灶性脑缺血模型建立本实验采用线栓法制作大鼠MCAO模型[6]。腹腔注射10%水合氯醛溶液(3.5 mL/ kg)麻醉。大鼠术后单笼饲养,自由饮水和进食。假手术组只分离血管,不插入线栓,其余步骤与模型组相同。
1.3.2治疗方法肌肽组予肌肽水溶液灌胃,剂量为1 000 mg/(kg·d),溶剂为生理盐水[4-5],每天1次;假手术组和模型组予等量生理盐水灌胃,每天1次;灌胃剂量按照100 g大鼠每天灌胃1 mL计算;首次灌胃时间为造模清醒后2 h以内[7]。
1.3.3神经功能缺损评分参照Bederson[8]5级4分法评定大鼠神经功能缺损。0分:无神经功能缺损。1分:轻微缺损,提尾倒悬时不能完全伸展左侧前肢。2分:中度缺损,行走时向左侧转圈。3分:重度缺损,向左侧倾倒。4分:不能自发行走,意识水平下降。评分为0分和4分的大鼠为造模不成功,均被剔除;符合评分但有蛛网膜下腔出血、术中术后死亡亦予以剔除,用同一批次的大鼠造模成功后随机补充,补足数目保证分组且每组大鼠数量不变。
1.3.4TTC染色术后72 h处死大鼠,在冰上迅速取脑,将脑组织放入-20℃冰箱快速冷冻20 min,待组织冻硬后进行冠状切片(片厚2 mm)。将切片放入1%TTC溶液中,37℃避光染色30 min,每隔10 min翻1次,以保证染色均匀。用4%多聚甲醛固定24 h后拍照,计算梗死体积,正常脑组织染色后呈鲜红色,梗死区呈苍白色。计算公式为:用分辨率(固定为118.11像素/cm)的平方除以总像素,得到以/cm2为单位的面积,得出实际面积(A1~A5),切片厚度(t)固定2 mm,代入公式V=t×[0.5×(A1+A5)+A2+A3+A4]。
1.3.5脑组织病理学检查术后72 h各组随机取4只大鼠,麻醉后仰卧位固定,用预冷的4%多聚甲醛溶液心脏灌注,然后迅速断头取脑,分离大脑皮质,切取小块置于4%多聚甲醛中固定24 h,再脱水透明,石蜡包埋切片,HE染色,光化学显微镜下观察大脑皮质形态结构。
1.3.6bcl-2、bax免疫组化染色术后72 h断头取脑,进行免疫组化染色,参照ElivisionTMsuper免疫组化试剂盒说明检测bcl-2和bax的表达情况。bcl-2和bax表达以胞浆着色呈棕黄色的细胞为阳性细胞。将每张切片于镜下同一强度随机读取右侧皮质5个不重叠的400倍视野进行摄片,用Image-Pro Plus 6.0图像分析软件,测量阳性区域的累积光密度(integrated optical density,IOD)来反映照片中相应蛋白表达的总量。染色阳性程度越高,IOD值越高,所测得值的均值即分别为bcl-2和bax含量。
1.4统计学方法所有数据采用SPSS 16.0软件包进行分析。正态分布计量资料以均数±标准差(±s)表示,组间比较采用两组独立样本t检验,非正态计量资料采用中位数M (P25,P75)表示,组间比较采用Mann-Whitney U检验;多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1大鼠神经功能缺损评分比较假手术组未见神经功能缺损表现,模型组和肌肽组均出现不同程度神经功能损伤;脑缺血后24 h,肌肽组与模型组神经功能评分差异无统计学意义(P>0.05);而脑缺血后72 h,肌肽组神经功能评分明显低于模型组(P<0.05)。见表1。

Tab.1 Comparison of neurological deficit score and infarct volume between three groups表1 各组大鼠神经功能评分及脑梗死体积的比较
2.2大鼠脑梗死体积比较假手术组无明显梗死灶;模型组出现明显梗死灶;肌肽组脑梗死体积较模型组明显减小(P<0.01)。见表1,图1。
2.3大鼠损伤脑组织病理观察假手术组:大鼠脑实质各层结构清晰,神经细胞未见肿胀、空泡变性,核正常,无核固缩,神经细胞未见坏死,形态结构正常,未见明显的病理性损伤。模型组:大鼠大脑皮质神经元重度坏死,神经元数目明显减少,细胞核固缩,胞体缩小变形,间质水肿,血管周间隙明显增宽。肌肽组:大鼠大脑皮质神经元轻度变性坏死,神经元数目减少得到改善,细胞核固缩、胞体缩小变形、间质水肿、血管周间隙增宽得到明显改善。见图2。
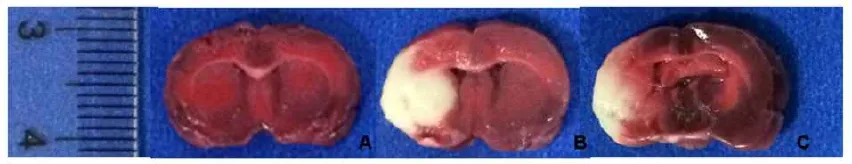
Fig.1 TTC staining of rat brain tissue of three groups图1 各组大鼠脑组织TTC染色结果
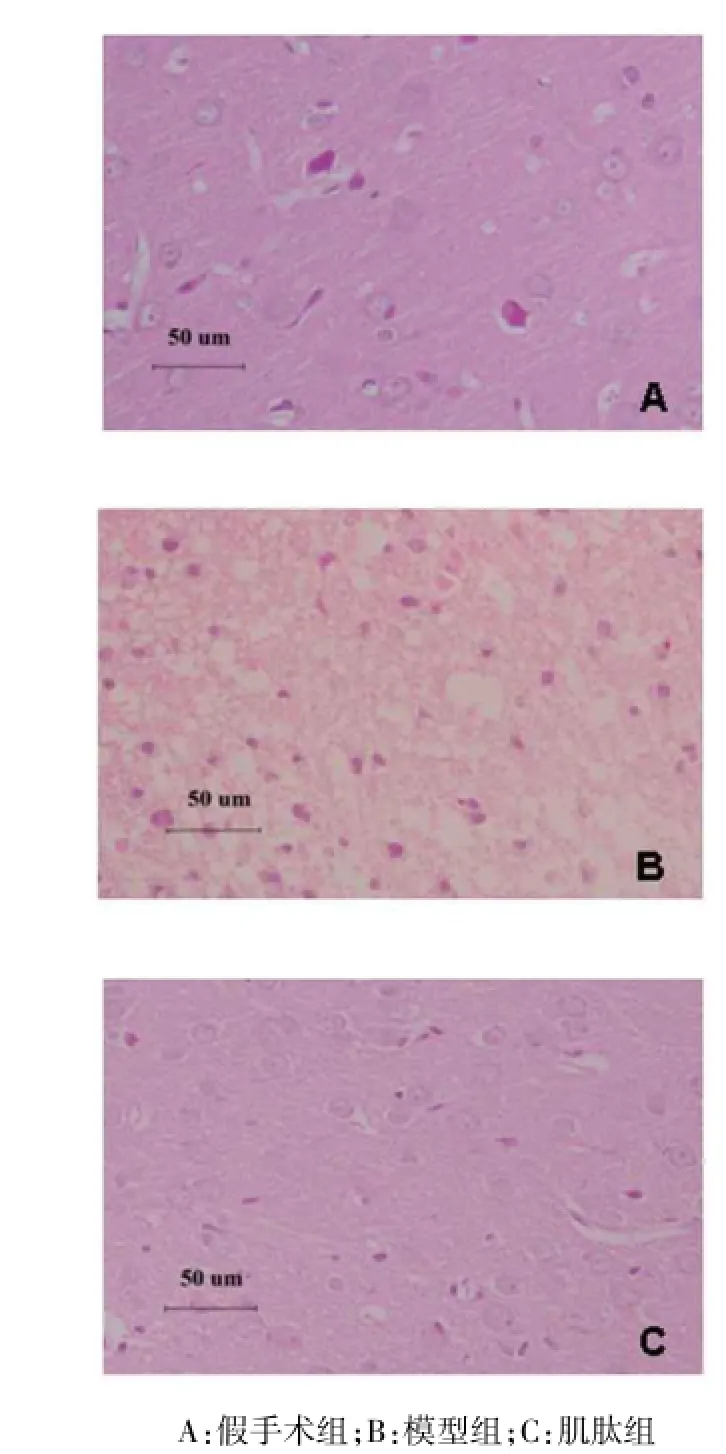
Fig.2 HE staining of rat brain tissue of three groups图2 各组大鼠脑组织HE染色结果(HE染色,×400)
2.4bcl-2、bax蛋白表达及bcl-2/bax比较与假手术组比较,模型组bcl-2阳性表达明显降低,bax阳性表达明显升高,bcl-2/bax比值明显降低,肌肽组bcl-2阳性表达明显升高(P<0.05);与模型组比较,肌肽组bcl-2阳性表达明显升高(P<0.01),bax阳性表达明显降低,bcl-2/bax比值明显升高(P<0.05)。见表2,图3、4。
Tab.2 Comparison of the IOD values of bcl-2 and bax protein expression in cortex of rats between three groups表2 各组大鼠皮质区bcl-2及bax蛋白表达比较(n=4,±s)
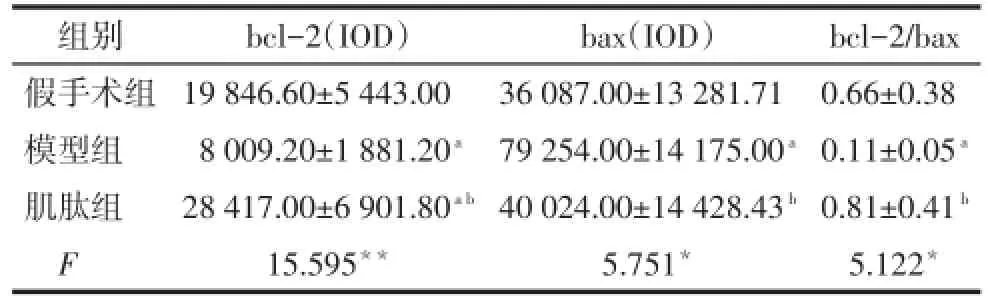
Tab.2 Comparison of the IOD values of bcl-2 and bax protein expression in cortex of rats between three groups表2 各组大鼠皮质区bcl-2及bax蛋白表达比较(n=4,±s)
*P<0.05,**P<0.01;a与假手术组比较,b与模型组比较,P<0.05
组别假手术组模型组肌肽组F bcl-2(IOD)19 846.60±5 443.00 8 009.20±1 881.20a28 417.00±6 901.80a b15.595**bax(IOD)36 087.00±13 281.71 79 254.00±14 175.00a40 024.00±14 428.43b5.751*bcl-2/bax 0.66±0.38 0.11±0.05a0.81±0.41b5.122*
3 讨论
3.1肌肽可改善脑缺血后继发性的脑损伤脑缺血后继发性的脑损伤是缺血性脑卒中最终致残的关键因素,脑组织缺血、缺氧的病理生理改变最终导致神经元死亡和神经功能受损。脑梗死体积和神经功能缺损评分是评价脑缺血损伤的金标准[9]。本研究中模型组较假手术组出现明显脑组织损伤和神经功能障碍,与有关报道一致[4-5]。
肌肽是一种由β-丙氨酸和L-组氨酸组成的水溶性二肽,主要存在于脊椎动物的骨骼肌肉中,在脑组织及心肌中仍能检测到肌肽[10]。肌肽是目前为止发现的结构最简单的生物活性肽之一,具有抗氧化、抗炎、清除自由基、免疫调节等功能[11]。研究表明,肌肽对缺血性脑损伤具有保护作用,且具有剂量依赖性,1 000和2 000 mg/kg肌肽具有脑保护作用,但低剂量(500、750 mg/kg)是否具有脑保护作用尚存在争议[4-5],故本研究肌肽剂量选择1 000 mg/kg。本研究显示,肌肽可明显改善神经功能缺损、减小脑梗死体积、改善脑组织病理损伤,具有脑保护作用。考虑原因可能是肌肽具有抗氧化、清除自由基、抗炎等功能[11]。
3.2bcl-2和bax蛋白在脑缺血后神经细胞凋亡中的作用近年来研究表明,在脑缺血引起脑组织损伤进程中,有许多机制在起作用,如氧化应激、酸中毒、兴奋性毒性、炎症、细胞凋亡等[12]。细胞凋亡在缺血性脑损伤进程中可能起重要作用。bcl-2和bax是bcl-2基因家族中与细胞凋亡密切相关的两种基因。当bcl-2表达增高时,可形成bcl-2-bax异源二聚体,抑制细胞凋亡;相反,当bax表达增高时,可形成bax/bax同源二聚体,促进细胞凋亡[13]。bcl-2和bax的比值能反映细胞受刺激后趋向于凋亡还是存活。当bcl-2表达增加,bax表达下降,两者比值增加时,细胞趋向存活[3]。本研究中模型组bcl-2蛋白表达及bcl-2/bax比值较假手术组明显下降,bax蛋白表达较假手术组明显上升,表明脑缺血后细胞凋亡增加,与有关报道一致[9,14]。然而,关于肌肽能否调节bcl-2、bax蛋白表达及bcl-2/bax比值,目前研究不多。
3.3bcl-2、bax蛋白与肌肽脑保护机制的关系本研究中肌肽组bcl-2蛋白表达明显高于假手术组和模型组,bax蛋白表达低于模型组,bcl-2/bax比值高于模型组,表明肌肽可抑制脑缺血后神经细胞凋亡,这与既往研究结果也一致[5,15]。其原因可能与肌肽调节bcl-2、bax蛋白表达,进而提高bcl-2/bax比值有关。与Cheng等[15]体外实验不同,本研究通过在体实验进一步证实前人研究结果。
综上所述,肌肽可通过调节bcl-2、bax蛋白表达及bcl-2/bax比值而发挥脑保护作用,但肌肽发挥抗凋亡作用最佳干预时间及持续时间还需进一步探讨。
(图3、4见插页)
[1]Beal CC.Gender and stroke symptoms:a review of the current literature[J].J Neurosci Nurs,2010,42(2):80-87.
[2]Colitti M.BCL-2 family of proteins and mammary cellular fate[J]. Anat Histol Embryol,2012,41(4):237-247.doi:10.1111/j.1439-0264.2012.01134.x.
[3]Yang D,Guo S,Zhang T,et al.Hypothermia attenuates ischemia/reperfusion-induced endothelial cell apoptosis via alterations in apoptotic pathways and JNK signalings[J].FEBS Lett,2009,583(15): 2500-2506.doi:10.1016/j.febslet.2009.07.006.
[4]Bae ON,Serfozo K,Baek SH,et al.Safety and efficacy evaluation of carnosine,an endogenous neuroprotective agent for ischemic stroke[J]. Stroke,2013,44(1):205-212.doi:10.1161/STROKEAHA.112.673954.
[5]Wang JP,Yang ZT,Liu C,et al.L-carnosine inhibits neuronal cell apoptosis through signal transducer and activator of transcription 3 signaling pathway after acute focal cerebral ischemia[J].Brain Res,2013,1507:125-133.doi:10.1016/j.brainres.2013.02.032.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1): 84-91.
[7]Rajanikant GK,Zemke D,Senut MC,et al.Carnosine is neuroprotective against permanent focal cerebral ischemia in mice[J].Stroke,2007,38(11):3023-3031.
[8]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[9]Li C,Wang GL,Wang HY,et al.A long-term neuroprotective effect of propofol on cerebral ischemia-reperfusion injury in rats[J].Tianjin Med J,2011,39(4):357-360.[李翠,王国林,王海云,等.丙泊酚后处理对大鼠脑缺血再灌注损伤的长时程保护作用[J].天津医药,2011,39(4): 357-360].doi:10.3969/j.issn.0253-9896.2011.04.024.
[10]Li YF,He RR,Tsoi B,et al.Anti-stress effects of carnosine on restraint-evoked immunocompromise in mice through spleen lymphocyte number maintenance[J].Plos One,2012,7(4):e33190.doi: 10.1371/journal.pone.0033190.
[11]Guiotto A,Calderan A,Ruzza P,et al.Carnosine and carnosine-related antioxidants:a review[J].Curr Med Chem,2005,12(20):2293-2315.
[12]Kao TK,Ou YC,Liao SL,et al.Opioids modulate post-ischemic progression in a rat model of stroke[J].Neurochem Int,2008,52(6): 1256-1265.doi:10.1016/j.neuint.2008.01.007.
[13]Hu ZL,Huang XP,Chen JX.Protective effects of epigallocatechin gallate on cerebral ischemia-reperfusion in rats[J].China Journal of Modern Medicine,2010,20(11):1627-1630.[胡宗礼,黄晓萍,陈珺霞.表没食子儿茶素没食子酸酯对大鼠脑缺血再灌注损伤的保护作用[J].中国现代医学杂志,2010,20(11):1627-1630].
[14]Wu DH,Wang GY.Effect of mild hypothermia in combination of acupuncture on Bcl-2 and Bax protein expressions of local cerebral ischemia/reperfusion rats[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2011,31(11):1506-1509.
[15]Cheng J,Wang F,Yu DF,et al.The cytotoxic mechanism of malondialdehyde and protective effect of carnosine via protein cross-linking/ mitochondrial dysfunction/reactive oxygen species/MAPK pathway in neurons[J].Eur J Pharmacol,2011,650(1):184-194.doi:10.1016/j. ejphar.2010.09.033.
(2014-08-20收稿2014-10-27修回)
(本文编辑李鹏)
The influence of carnosine in expression levels of bcl-2 and bax after focal cerebral ischemia in rats
ZHU Jie,MA Qian,WANG Xin,LIU Cuimei,WANG Aihong△
Institute of Nursing,Nanjing University of Chinese Medicine,Nanjing 210023,China
△Corresponding AuthorE-mail:wah710630@163.com
ObjectiveTo explore the effect of carnosine in the expression of B cell lymphomal/leukemia-2(bcl-2)and bcl-2-associated X protein(bax)after focal cerebral ischemia in rats.MethodsThirty male SD rats(SPF scale)were randomly divided into 3 groups:sham-operated group,model group and carnosine treated group(n=10 for each group).The middle cerebral artery occlusion model(MCAO)was induced in model group and carnosine treated group.Rats were received carnosine[1 000 mg/(kg·d),orally]in carnosine treated group,and the other rats were received the same volume of normal saline(NS)in shame-operated group and model group.The neurological deficit score was used to evaluate the neurological function at 24 h and 72 h after MCAO.Morphological changes were observed by HE staining.TCC staining was used to label infarct volume,and immunohistochemistry was used to detect the expression of bcl-2 and bax.ResultsCompared with model group,the score of neurological function and infarct volume were significantly declined in carnosine treated group at 72 h after injury(P<0.05 or P<0.01).The changes of ischemic impairment were lighter in carnosine treated group than that of model group.Compared with sham-operated group,the expression levels of bcl-2 and the ratio of bcl-2/bax were decreased while the expression of bax was increased in model group(P<0.05).Compared with model group,carnosine could significantly increase the expression of bcl-2 and the ratio of bcl-2/bax,and reduce the expression of bax(P<0.01 or P<0.05). ConclusionCarnosine can enhance bcl-2 expression,decrease bax expression and increase the ratio of bcl-2/bax,which is likely to be one of the mechanisms of neuroprotection.
carnosine;brain ischemia;genes,bcl-2;bcl-2-associated X protein;bcl-2/bax
R743.33
ADOI:10.11958/j.issn.0253-9896.2015.03.010
江苏省青蓝工程项目资助、江苏省优势学科项目资助项目(YSHL0201-26)
南京中医药大学护理学院(邮编210023)
朱洁(1989),女,硕士在读,主要从事脑血管疾病的基础与临床方面研究
△E-mail:wah710630@163.com

