MACC1及c-Met在前列腺癌组织中的表达
何彬,吴长利,胡海龙,王晖△
MACC1及c-Met在前列腺癌组织中的表达
何彬1,吴长利1,胡海龙2,王晖1△
目的探讨结肠癌转移相关基因1(MACC1)及肝细胞生长因子受体(c-Met)在前列腺癌中的表达及其与前列腺癌发展、浸润和转移的关系。方法采用枸椽酸-微波-SP免疫组织化学染色法检测67例前列腺癌组织及30例前列腺增生(BPH)组织中MACC1和c-Met的表达情况,并结合临床病理因素进行相关分析。结果MACC1 及c-Met表达水平在前列腺癌组织中不同Gleason分级、病理分级、前列腺特异性抗原(PSA)水平及根治术后是否发生骨转移方面差异有统计学意义(P<0.05或P<0.01),而不同年龄,是否吸烟的表达水平差异无统计学意义;且Ⅲ期和Ⅳ期前列腺癌中MACCl的高表达率明显高于BPH(P<0.05),c-Met蛋白高表达率仅在Ⅳ期前列腺癌高于BPH (P<0.05)。前列腺癌中MACC1与c-Met的表达呈正相关(P<0.01)。Kaplan-Meier生存曲线表明前列腺癌组织中MACC1及c-Met高表达较低表达无骨转移生存时间短且生存率低。结论MACC1和c-Met的异常高表达可能与前列腺癌的发展及浸润密切相关,且预示骨转移的发生,可能成为多种恶性肿瘤判断预后、诱导转移的预测指标。
原癌基因蛋白质c-Met;前列腺肿瘤;免疫组织化学;结肠癌转移相关基因1
前列腺癌是世界范围导致男性肿瘤相关死亡的第六大疾病,在美国居第一位[1]。在我国的发病率逐年上升,成为老年人群的常见病[2]。结肠癌转移相关因子 1(metastasis-associated in colon cancer 1,MACC1)是2009年Stein等[3]在结肠癌中发现的一种因子,在诱导肿瘤细胞转移、侵袭和增殖等机制中与肝细胞生长因子(hepatocyte growth factor,HGF)/肝细胞生长因子受体(c-Met)信号系统密切相关。但有关MACC1在前列腺癌发生发展中的具体机制仍不明确。本实验观察MACC1及c-Met在前列腺癌和前列腺增生(benign prostatic hyperplasia,BPH)组织中的表达及与临床病理特征和随访中骨转移发生的关系,为判断预后及指导临床治疗提供依据。
1 材料与方法
1.1标本来源选取天津医科大学第二医院2006年1月—2009年6月前列腺癌标本67例,BPH组织标本30例。Gleason分级:4~6分13例,7分17例,8~10分37例。TNM分期:Ⅰ期1例、Ⅱ期32例、Ⅲ期22例、Ⅳ期12例。Ⅰ期、Ⅱ期和部分Ⅲ期标本(9/22)来自前列腺根治性手术切除标本,其余Ⅲ期和Ⅳ期患者均来自前列腺癌穿刺或经尿道电切。所有患者均在术前行MRI或PET-CT提示分期,且术前均未行放疗和内分泌治疗。
1.2免疫组化方法将组织蜡块4 μm连续切片,切片脱蜡至水,在3%过氧化氢-微波-甲醇中浸泡10 min以灭活内源性过氧化氢酶,采用枸椽酸-微波-SP法在10 mmol/L枸橼酸(pH 6.0)中煮沸5 min,保温10 min,10%羊血清封闭。即用型PV900试剂盒及DAB显色剂(购自北京中杉生物技术公司)和兔抗人MACC1多克隆抗体(购自Abcam)。兔抗人c-Met多克隆抗体(购自北京博奥森生物技术有限公司),PBS代替一抗作阴性对照,MACC1阳性表达的结肠癌肝转移切片作阳性对照;c-Met阳性表达的乳腺癌组织切片做阳性对照。
1.3结果判定随机读取有代表性的10个高倍镜视野观察阳性细胞。每个视野计数100个肿瘤细胞,采用双评分半定量法进行评分。(1)根据染色程度:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。(2)按阳性细胞百分比评分:不着色为0分,<25%为1分,25%~50%为2分,>50% 为3分。以两者积分相加为该片得分:0~2分为低表达状态,3~6分为高表达状态。
1.4统计学方法采用SPSS 19.0对数据进行统计学分析。免疫组化结果中表达强度的比较采用χ2检验。表达强度的相关性分析采用Spearman相关。以P<0.05为差异有统计学意义。
2 结果
2.1MACC1及c-Met免疫组化结果结果显示,MACC1在前列腺癌中主要定位于胞浆,少数伴有胞核着色,呈淡黄色、棕黄色或棕褐色颗粒状。c-Met在前列腺癌中主要定位于胞膜,部分有胞浆着色,呈淡黄色、棕黄色或棕褐色颗粒状;MACC1和c-Met在良性增生组织可存在表达,见图1。
2.2BPH和前列腺癌中MACC1和c-Met表达情况
2.2.1MACC1在不同组织及临床分期表达情况BPH与前列腺癌组织中MACCl的高表达率分别为40%(12/30)和71.6%(48/67),差异有统计学意义(χ2=8.793,P=0.003);其中前列腺癌Ⅰ~Ⅱ期的MACCl蛋白的表达水平与BPH差异无统计学意义,Ⅲ、Ⅳ期均高于BPH,且Ⅳ期高于Ⅲ期,见表1。前列腺癌组织中不同Gleason分级、病理分级、前列腺特异性抗原(prostate specific antigen,PSA)水平及根治术后是否发生骨转移MACC1的表达水平差异有统计学意义,而不同年龄、是否吸烟的表达水平差异无统计学意义,见表2。
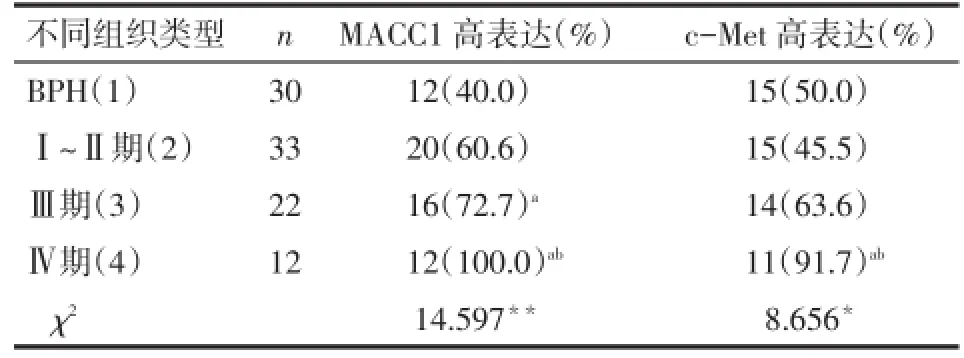
Tab.1 Comparison of MACC1 and c-Met expressions in benign prostatic hyperplasia tissues and prostate cancer tissues表 1BPH与前列腺癌组织中MACC1和c-Met的表达情况比较 例(%)
2.2.2c-Met在不同组织及临床分期表达情况BPH与前列腺癌组织中c-Met的高表达率分别为50.0%(15/30)、59.7%(40/67),差异无统计学意义(χ2=0.794,P=0.373);其中前列腺癌Ⅰ~Ⅱ期和Ⅲ期c-Met蛋白表达水平与BPH相比差异无统计学意义,而Ⅳ期c-Met表达水平高于BPH和Ⅰ~Ⅱ期,见表1。前列腺癌组织中不同Gleason分级、病理分级、PSA水平及根治术后是否发生骨转移c-Met的表达水平差异有统计学意义,而不同年龄、是否吸烟的表达水平差异无统计学意义,见表2。
2.2.3前列腺癌组织中MACC1和c-Met表达的相关性分析结果显示,MACC1和c-Met在前列腺癌组织中的表达呈正相关,见表3。
2.2.4随访情况67例前列腺癌中有42例行前列腺癌根治术,术后随访12~60个月,其中发生骨转移16例,骨转移发生时间为6~40个月,中位发生时间为17个月,Ⅰ~Ⅱ期、Ⅲ期前列腺癌组织中骨转移发生率分别为30.3%(10/33)和66.7%(6/9)。Kaplan-Meier分析结果表明前列腺癌组织中MACC1及c-Met的高表达组较低表达组无骨转移生存时间短且生存率低,见图2、3。
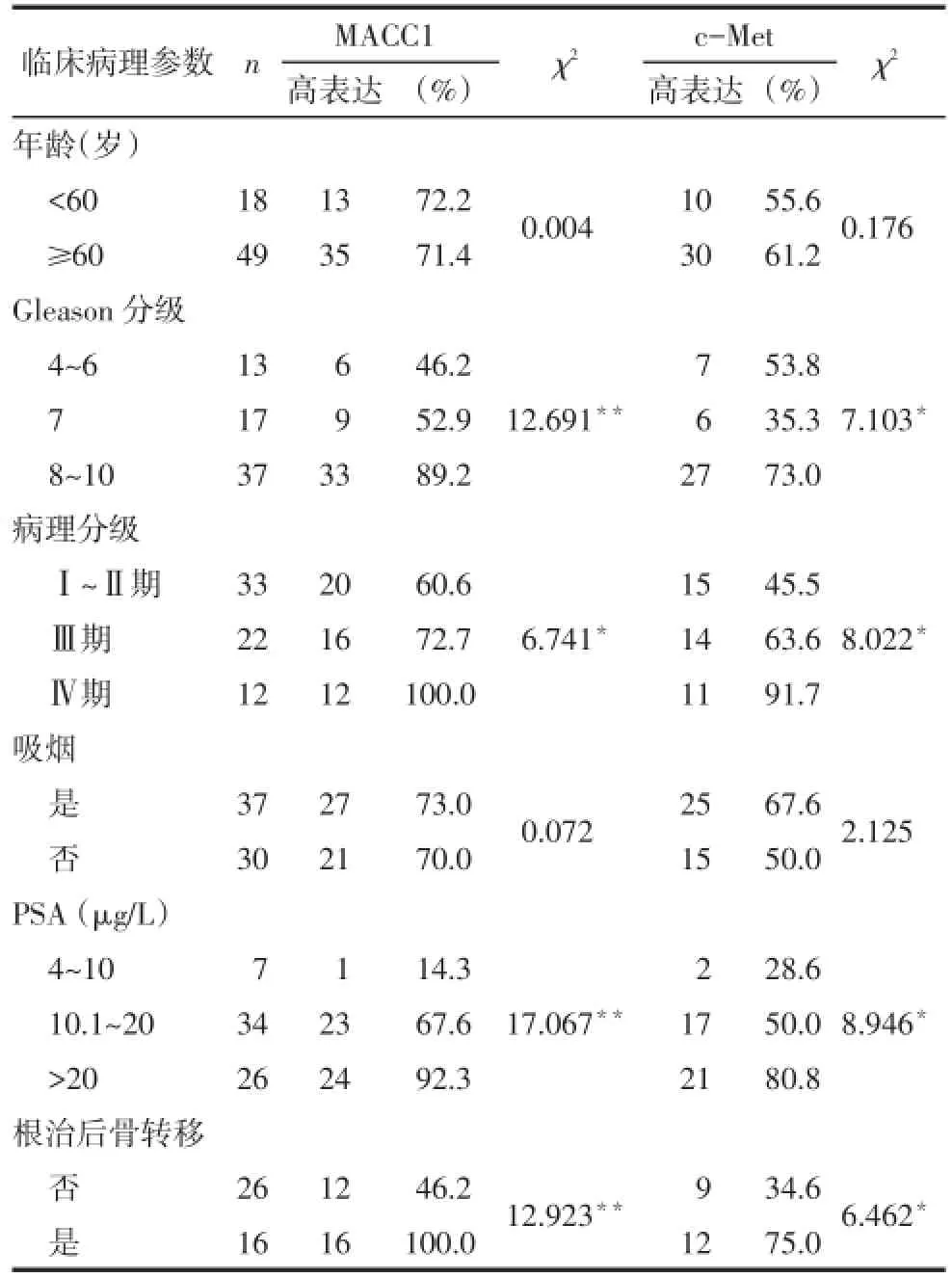
Tab.2 Expression of MACC1 and c-Metin in prostate cancer tissues表2 MACC1和c-Met蛋白在前列腺癌中的表达情况
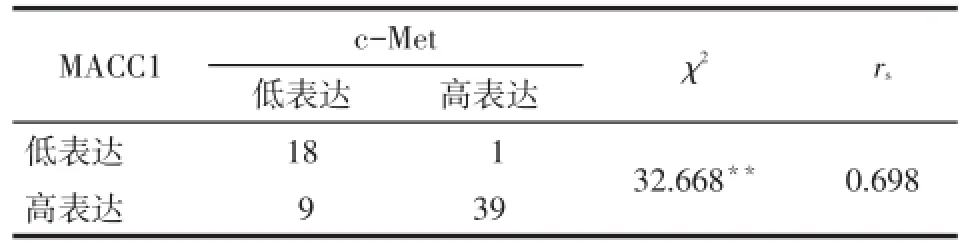
Tab.3 Correlation between MACC1 and c-Met expression in prostate cancer tissues表3 MACC1和c-Met在前列腺癌组织中表达的相关性
3 讨论
3.1MACC1蛋白的结构及其功能MACC1蛋白含有852个氨基酸,其中包括ZU5结构域、SH3结构域、富含脯氨酸模体、DD1区和DD2区结构片段[3]。Stein等[4]在SW480结肠癌细胞培养中发现MACC1可以诱导肿瘤细胞的转移、侵袭和增殖,且在异体移植的模型上,MACC1可以诱导结肠肿瘤细胞在肺、肝脏上出现转移。其在除肠癌以外的许多实体肿瘤,如胃癌、肝癌、胰腺癌、肺癌、卵巢癌、乳腺癌、鼻咽癌、肾癌及胶质母细胞瘤等中均有表达,且诱导肿瘤细胞转移、侵袭和增殖等[5]。
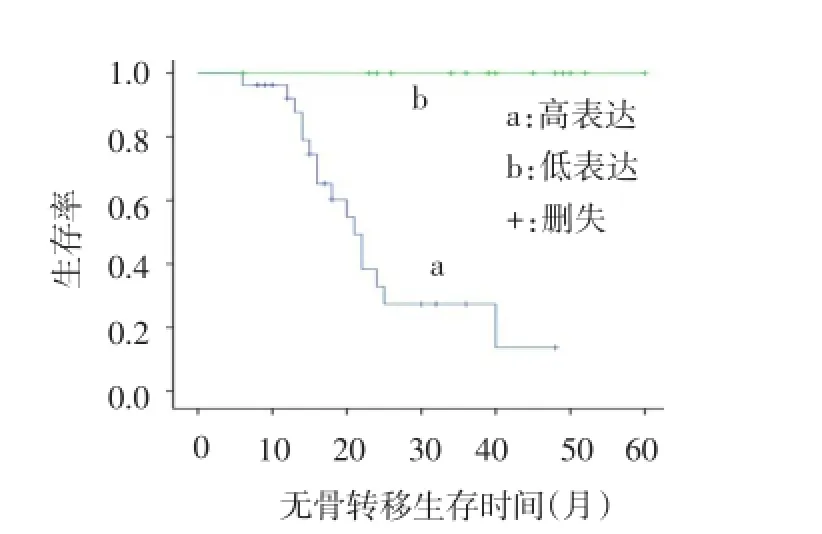
Fig 2 The metastatic bone-free survival curves of high and low MACC1 expression groups图2 MACC1高表达与低表达组的无骨转移生存曲线

Fig 3 The metastatic bone-free survival curves of high and low c-Met protein expression groups图3 c-Met高表达与低表达组的无骨转移生存曲线
3.2HGF/c-Met信号通路及其在肿瘤组织中的异常高表达HGF/c-Met信号通路广泛存在于各种组织中,对多种组织器官的生长发育具有重要的生理调节作用[6]。生理条件下,HGF主要由间质细胞产生,c-Met存在于上皮细胞的细胞膜,HGF与其特异性受体c-Met结合后可诱导c-Met蛋白发生构象改变,激活受体胞内蛋白激酶结构域中的蛋白酪氨酸激酶(PTK),PTK的激活可导致多种底物蛋白的酪氨酸磷酸化,再经级联式磷酸化反应,将信号逐级放大,最终转入细胞核,引起一系列生物效应[7]。近年来则发现在一些恶性肿瘤组织,如胃癌、直结肠癌、胰腺癌、肺癌、甲状腺癌、脑胶质瘤、肝癌等中存在HGF及c-Met过度表达而且预示肿瘤预后差[8]。c-Met蛋白异常高表达在前列腺癌进展过程中也起了重要作用,尤其是在发生骨转移及去势抵抗性前列腺癌中异常高表达,因此在晚期或进展期前列腺癌中应用c-Met抑制剂将成为一种新的治疗手段[9]。
3.3MACC1与HGF/c-Met信号通路的关系进一步研究发现MACC1是HGF/c-Met信号通路的一个关键调节因子[4]。Stein等[10]认为MACC1与HGF/c-Met之间存在一个正反馈环路:HGF促进MACC1由胞浆转移至胞核内,在核内MACC1与c-Met启动子区的Spl结合,进而激活c-Met启动子,上调c-Met的转录,从而使得更多的HGF与过度表达的c-Met结合,激活下游信号通路,进而使肿瘤细胞活性增强及肿瘤组织大量增殖,间质细胞中HGF也出现异常高表达,这又促进MACC1不断转移至胞核内,激活HGF/ c-Met信号通路,不断启动细胞内下游信号传导通路。
3.4MACC1与c-Met表达及根治术后随访情况分析本文的前列腺癌组织中MACC1与c-Met的表达呈正相关,这符合了MACC1与HGF/c-Met信号通路之间存在一个正反馈环路,且MACC1恰恰是HGF/c-Met信号通路的一个关键调节因子。本文MACC1蛋白在前列腺癌组织中,Ⅲ期及Ⅳ期的表达明显高于Ⅰ~Ⅱ期中的表达,即MACC1蛋白的表达在肿瘤发生周围侵犯或转移的情况下明显高表达。体外研究报道,MACC1在前列腺癌高转移细胞株中的表达明显增高;反义干预MACC1后能明显减弱前列腺癌细胞的侵袭、转移及细胞增殖能力[11]。本文中c-Met蛋白仅在发生转移的Ⅳ期前列腺癌组织中表达率明显增高,且高于BPH及Ⅰ~Ⅱ期前列腺癌中的表达,但Ⅰ~Ⅱ期及Ⅲ期的c-Met蛋白与BPH表达水平相比差异不明显,这与Russo等[12]结果一致,Russo认为无肿瘤人群尿中c-Met表达与每个局限性前列腺癌的亚组无明显差异(P=0.17),而与前列腺癌出现转移时c-Met表达有明显差异(P<0.000 1)。本文考虑c-Met蛋白参与了BPH组织的增殖,可大量出现于增生组织中,因此,与局限性Ⅰ~Ⅱ期及Ⅲ期前列腺癌比较差异无统计学意义,但当出现转移时c-Met才会异常高表达。而MAC⁃Cl蛋白的表达不仅在发生转移的Ⅳ期与BPH相比差异明显,而且Ⅲ期与BPH相比也同样存在差异,故本文推测在MACC1的作用机制中不仅通过c-Met的表达,还可通过其他机制实现。Galimi等[13]在结肠癌的相关实验中也得到了相似的结论。本文中42例根治患者术后随访仅16例出现骨转移,生存曲线显示MACC1和c-Met高表达组均较低表达组无骨转移生存时间短及生存率低,故本文考虑前列腺癌组织中当MACC1及c-Met高表达时根治术后易发生骨转移,其可能成为恶性肿瘤判断预后的预测指标。
综上所述,本文认为MACC1及c-Met的高表达与病理分期、Gleason分级、PSA数值及根治术后是否发生骨转移有关,这提示MACC1及c-Met在前列腺癌的侵袭及转移过程中起了重要作用,且与肿瘤预后密切相关,为肿瘤的治疗提供了新的治疗靶点。
(图1见插页)
[1]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancerdeaths[J].CA Cancer JClin,2011,61(4):212-236.doi: 10.3322/caac.20121.
[2]Wang G,Yang K,Meng S,et al.Key genes in the pathogenesis of pros⁃tate cancer in Chinese men a bioinformatic study[J].Natl J Androl,2010,16(4):320-324.[王刚,杨阔,孟帅,等.中国人前列腺癌发病关键基因的生物信息学研究[J].中华男科学杂志,2010,16(4):320-324].
[3]Stein U,Dahlmann M,Walther W.MACC1-more than metastasis?Facts and predictions about a novel gene[J].J Mol Med(Berl),2010,88(1):11-18.doi:10.1007/s00109-009-0537-1.
[4]Stein U,Walther W,Arlt F,et al.MACC1,a newly identified key reg⁃ulator of HGF-MET signaling,predicts colon cancer metastasis[J]. Nat Med,2009,15(1):59-67.doi:10.1038/nm.1889.
[5]Stein U.MACC1-a novel tatget for solid cancers[J].Expert Opin Ther Targets,2013,17(9):1039-1052.doi:10.1517/14728222.2013.815727.
[6]Bottaro DP,Rubin JS,Faletto DL,et al.Identification of the hepato⁃cyte growth factor as the C-met proto-oncogene product[J].Science,1991,251(4995):802-804.doi:10.1126/science.1846706.
[7]Rosario M,Birchmeier W.How to make tubes:signaling by the Met receptor tyrosine kinase[J].Trends Cell Biol,2003,13(6):328-335. doi:10.1016/S0962-8924(03)00104-1.
[8]Gherardi E,Birchmeier W,Birchmeier C,et al.Targeting MET in cancer:rationale and progress[J].Nat Rev Cancer,2012,12(2):89-103.doi:10.1038/nrc3205.
[9]Varkaris A,Corn PG,Gaur S,et al.The role of HGF/c-Met signal⁃ing in prostate cancer progression and c-Met inhibitors in clinical trials[J].Expert Opin Investig Drugs,2011,20(12):1677-1684.doi: 10.1517/13543784.2011.631523.
[10]Stein U,Smith J,Walther W,et al.MACC1 controls Met:what a dif⁃ference an Sp1 site makes[J].Cell cycle,2009,8(15):2467-2469.doi: 10.4161/cc.8.15.9018.
[11]Lyu X.The effect of MACC1 on invasion and metastasis in prostate cancer cell lines[D].The Huazhong University of Science and Tech⁃nology,2001.[吕煊.MACC1对前列腺癌体外侵袭转移能力的影响[D].华中科技大学,2011].
[12]Russo AL,Jedlicka K,Wernick M,et al.Urine analysis and protein networking identify met as a marker of metastatic prostate cancer[J]. Clin Cancer Res,2009,15(13):4292-4298.doi:10.1158/1078-0432.CCR-09-0599.
[13]Galimi F,Torti D,Sassi F,et al.Genetic and expression analysis of MET,MACC1,and HGF in metastatic colorectal cancer:response to met inhibition in patient xenografts and pathologic correlations [J].Clin Cancer Res,2011,17(10):3146-3156.doi:10.1158/1078-0432.CCR-10-3377.
(2014-06-24收稿2014-10-13修回)
(本文编辑李鹏)
Expressions of MACC1 and c-Met genes in prostate cancer tissues
HE Bin1,WU Changli2,HU Hailong2,WANG Hui1△
1 Department of Intestine,The Second Hospital of Tianjin Medical University,Tianjin Research Institute of Urology,Tianjin 300211,China;2 Department of Urology,The Second Hospital of Tianjin Medical University,Tianjin Research Institute of Urology
△Corresponding Author E-mail:doctorwh888@126.com
ObjectiveThis study is to investigate the expressions of MACC1 and c-Met genes in prostate cancer tis⁃sues and to explore the relationship between these gene expressions with the development,invasion and metastasis of pros⁃tate cancer.MethodsThe expressions of MACC1 and c-Met genes were examined in 30 cases of benign prostatic hyperpla⁃sia and 67 cases of prostate cancer using citron acid-microwave-SP immunohistochemical method and analysed with their clinical pathological features.ResultsExpressions of MACC1 and c-Met in prostate tissues show statistical difference ac⁃cording to Gleason score,PSA level,pathological stages and whether bone metastasis occurs after radical surgery(P<0.05 or P<0.01),but their expressions in prostate tissue show no significant difference among different sex,age and whether smoking or not.Expression of MACC1 in prostate tissue of stageⅢandⅣcancer is significantly higher than that in benign prostatic hyperplasia(BPH)tissues(P<0.05)while the expression of c-Met only shows statistical difference in prostate tis⁃sue of stageⅣcancer compared with that in BPH(P<0.05).There is a positive correlation between the expression of MACC1 with expression of c-Met in prostate cancer tissues(P<0.01).Kaplan-Meier curves revealed that the survival rates was lower and survival time of bone-free metastasis were shorter in patients with high MACC1 and c-Met expressions in prostate tissue than those with low expressions of MACC1 and c-Met in prostate tissue.ConclusionExpression of MACC1 and c-Met is closely related to the development,invasion and metastasis of prostate cancer,so MACC1 and c-Met may be used as promising diagnostic and prognostic markers for prostate tumor,and as new therapeutic targets for prostate cancer.
proto-oncogene proteins c-Met;prostatic neoplasms;immunohistochemistry;metastasis-associated in co⁃lon cancer 1(MACC1)
R737.25
ADOI:10.11958/j.issn.0253-9896.2015.02.016
国家自然科学基金资助项目(30700834);天津市自然科学基金资助项目(12ZCDZSY16600)
1天津医科大学第二医院肛肠外科,天津市泌尿外科研究所(邮编300211),2天津医科大学第二医院泌尿外科,天津市泌尿外科研究所
何彬(1980.11),女,主治医师,硕士在读。研究方向:泌尿外科
△E-mail:doctorwh888@126.com

