探讨口服普萘洛尔治疗婴幼儿血管瘤对身高、体质量的影响
胡 丽, 黄惠真, 仇雅璟, 马 刚, 陈 辉, 金云波, 胡晓洁, 林晓曦, 李 伟
论 著
探讨口服普萘洛尔治疗婴幼儿血管瘤对身高、体质量的影响
胡 丽, 黄惠真, 仇雅璟, 马 刚, 陈 辉, 金云波, 胡晓洁, 林晓曦, 李 伟
目的 探讨口服普萘洛尔治疗婴幼儿血管瘤对患儿身高、体质量增长的影响。方法 收集我院血管瘤专科2009-2012年口服普萘洛尔治疗IH患儿的身高、体质量的生长资料,分别绘制身高和体质量生长曲线,生长速度下降定义为疗程中生长曲线出现2次及以上百分位数较用药前下降10%;同时计算停药时年龄别体质量Z值(WAZ)、年龄别身高Z值(HAZ)和身高别体质量Z值(WHZ),观察有无营养不良。结果 47例生长资料完整的患儿纳入本研究,共有11例患儿出现生长速度下降,其中9例患儿出现身高增长速度下降,并在停药后平均8.8个月回归正常;6例患儿出现体质量增长速度下降,83.3%(5/6)患儿在停药后平均8.7个月回归正常;Z评分结果显示,无患儿出现营养不良。结论 口服普萘洛尔治疗婴幼儿血管瘤安全有效,对患儿身高体质量增长的影响微小且是暂时性的。
婴幼儿血管瘤; 普萘洛尔; 身高体质量
婴幼儿血管瘤(infantile hemangioma, IH)是婴幼儿最常见的良性肿瘤之一,通常在出生后数天到1个月内发现,经过数月至1年的快速增生后进入缓慢的消退期[1-2]。多数病灶经过自然病程或局部用药后可获得较好的消退,但对于一些大面积、快速增生及特殊部位的病灶,则会引起局部溃疡、瘢痕、视力和语言功能障碍,甚至危及生命[3-5]。因此,这些严重的血管瘤在瘤体增生早期即需要进行积极的干预治疗。激素一直是治疗严重IH的金标准[6],直到2008年,法国医师C Leaute-Labreze等首次报道普萘洛尔成功用于IH的治疗[7]。随后国内外多篇文献陆续报道了口服普萘洛尔促进严重IH消退的病例,且没有出现严重不良反应[8-10]。普萘洛尔逐渐取代激素成为严重IH的一线治疗药物[9,11-13]。笔者通过收集用药患儿身高、体质量的生长资料,分析疗程中生长曲线的变化和Z评分结果,探讨普萘洛尔对于患儿身高、体质量增长的影响,进一步证明其安全性。
1 对象与方法
1.1 临床资料 收集2009-2012年在上海交通大学医学院附属第九人民医院血管瘤专科门诊就诊的严重IH病例,统计人口学特征,告知该治疗为超处方用药,签署知情同意书。排除标准包括早产儿及低体质量儿,既往接受过其他治疗方法,以及患有支气管哮喘、过敏性鼻炎、其他呼吸道疾病、先天性心脏病、感染性疾病者。
1.2 一般资料 2009-2012年共有100例患儿进行口服普萘洛尔治疗,剔除失随访及数据不全者,最终将47例患儿纳入本研究,其中女性30例,男性17例;头面部病灶33例(70.2%),躯干9例(19.2%),四肢5例(10.6%);年龄23.0~68.5个月(平均33.2个月,该处年龄为最后一次随访时月龄),开始服药月龄2.0~10.5个月(平均4.3个月),疗程持续3.5~15.0个月(平均8.0个月),随访时间12.0~48.0个月(平均27.8个月)。
1.3 治疗方法 用药前进行血常规、肝肾功能、空腹血糖、血钾、血压、心动超声及心电图检查,检查结果无异常后给予口服普萘洛尔。首日剂量为1.0 mg/kg,第2天剂量为1.5 mg/kg,第3天剂量为2.0 mg/kg,之后剂量维持在2.0 mg/(kg·d),均分3次口服。用药过程中密切观察患儿有无出现精神萎靡、面色苍白、肢端发冷、呼吸困难及食欲变化或持续腹泻等异常症状。疗程一般为6~10个月,停药时缓慢减量,持续2周。
1.4 生长资料及评价 收集患儿身高和体质量的生长资料。用药前发放资料记录表:0~1岁每个月监测,1~2岁每3个月监测,2岁后每6个月监测。身高及体质量数据转化成相应的百分位数,分别绘制成身高和体质量曲线。生长速度下降定义为疗程中,生长曲线中出现2次及以上百分位数较用药前下降10%[14];同时,应用WHO-Anthro软件计算停药时年龄别体质量Z值(WAZ)、年龄别身高Z值(HAZ)和身高别体质量Z值(WHZ),观察有无营养不良:低体质量-WAZ<-2;超重-WAZ>2;生长迟缓-HAZ<-2;消瘦-WHZ<-2;肥胖-WHZ>2。
1.5 统计学处理 对患儿一般资料进行描述性统计,对出现生长速度下降患儿的临床资料(包括开始服药月龄与疗程持续时间)单独统计,根据相应的平均值分别分成两组,应用χ2检验分析组间差异,P<0.05为差异有统计学意义。
2 结果
11例患儿在用药过程中出现生长速度下降,分别表现为身高或体质量增长速度下降或两者同时下降,其中10例(90.9%)患儿在停药后随访期内均回归到用药前水平。47例患儿中(图1,2),3例患儿在用药1个月内出现轻度腹泻,1例患儿出现一过性食欲下降,而出现生长速度下降的11例患儿,在用药过程中并未出现相应并发症。
2.1 身高增长速度下降 9例患者出现身高增长速度下降,6例女性和3例男性。大部分出现在用药后3~4个月,所有患儿在停药后0~26个月(平均8.7个月),回归到用药前百分位数水平(图3,4)。
2.2 体质量增长速度下降 6例患儿(男女各3例)出现体质量增长速度下降,多数在6~9月龄时出现,83.3%(5/6)的患儿在停药后0~26个月(平均8.7个月),回归到用药前曲线增长趋势,仅1例女性患儿在3周岁随访时仍未恢复正常,该患儿4个月龄开始用药,疗程持续14个月。见图5,6。
2.3 Z评分结果 Z评分法是评价儿童生长发育的常用指标,Z值=(实测值-参考值中位数)/参考值标准差,包括3个评价指标:年龄别体质量Z值(WAZ):WAZ<-2为低体质量, WAZ≥ 2为超重,是判断儿童近期及长期营养状况的指标;年龄别身高Z值(HAZ):HAZ<-2为生长迟缓,反映儿童慢性营养不良;身高别体质量Z值(WHZ):WHZ<-2为消瘦 , WHZ≥ 2为肥胖,是反映近期营养状况的敏感指标。统计结果显示,停药时47例患儿均未出现低体质量、生长迟缓和消瘦,2例(4.3%)患儿超重,3例(6.4%)患儿肥胖(表1)。
2.4 χ2检验结果 在11例生长速度下降的患儿中,4.3个月以内开始用药与4.3个月后用药之间差异无统计学意义(P>0.05);疗程短于8个月与超过8个月之间差异也无统计学意义(P>0.05)。
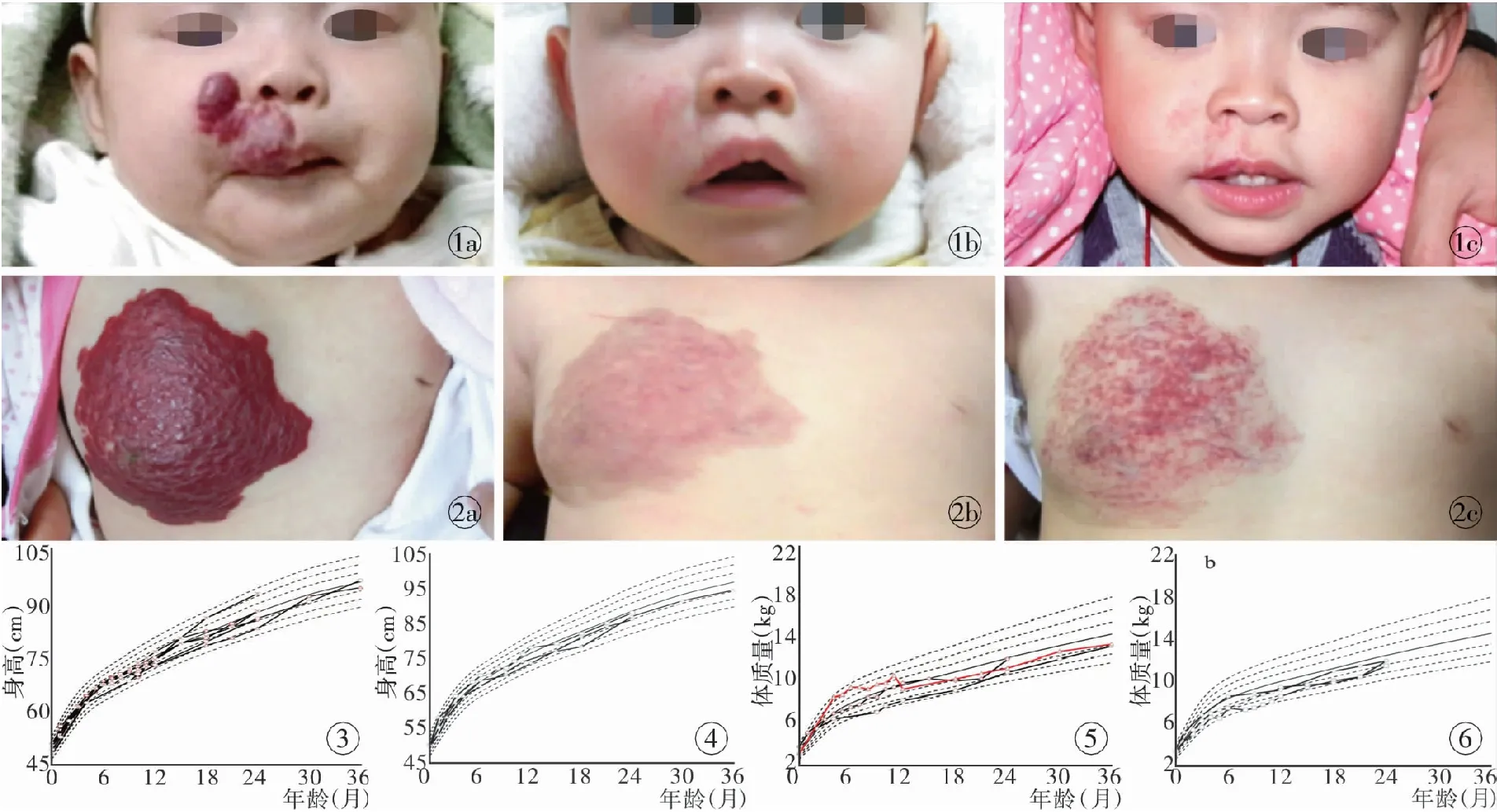
图1 女性患儿右面部IH治疗前后对比 a. 用药前 b. 停药时 c. 2周岁随访 图2 女性患儿右胸部IH治疗前后对比 a. 用药前
b. 停药时 c. 2周岁随访 图3 6例女性患儿身高曲线变化 图4 3例男性患儿身高曲线变化 图5 3例女性患儿体质量曲线变化,其中1例患儿未恢复到用药前水平(红线) 图6 3例男性患儿体质量曲线变化
Fig 1 Female patient with IH on left face. a. before treatment. b. stopping propranolol. c. follow-up at 2 years old. Fig 2 Female patient with IH on left chest. a. before treatment. b. stopping propranolol. c. follow-up at 2 years old. Fig 3 Height-for-age percentiles for the six girls with slow growth. All curves returned back. Fig 4 Height-for-age percentiles for the three boys with slow growth. All curves returned back. Fig 5 Weight-for-age percentiles for the three girls with slow growth. One patient's curve did not return back (red curve).
Fig 6 Weight-for-age percentiles for the three boys with slow growth. All curves returned back to normal.
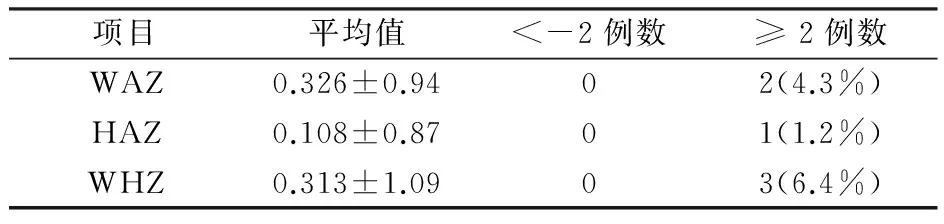
表1 Z评分结果
3 讨论
普萘洛尔作为一种非选择性β受体阻滞剂,在临床上使用已超过50年,广泛应用于高血压、心律失常、心绞痛等疾病(SC Srivastava, 1964年),不良反应主要包括低血压、心动过缓、反应迟钝、支气管痉挛、粒细胞缺乏、皮疹以及四肢冰冷等。自2008年普萘洛尔用于治疗IH,国内外相关文献报道已超过200篇。文献综述表明,98%的患者口服普萘洛尔均可获得良好的效果,除了疗效方面,其他临床研究方向各不相同,包括剂量、疗程和停药方式、评价疗效的方法以及安全性的监测[15]。其中文献报道的不良反应发生率低且较轻,包括血压降低、心率减慢、呼吸急促、低血糖、高血钾、睡眠障碍、腹泻以及粒细胞减少等[8,16-20], 大部分经过对症处理或自行缓解。1岁以内是婴幼儿生长发育的高峰期,由于普萘洛尔口服治疗IH疗程通常超过6个月,除上述不良反应外,在与家属沟通的过程中难以避免对患儿生长发育,尤其是身高、体质量是否会产生影响这一问题。因此,本研究首次从生长发育(主要从身高、体质量)角度,通过分析生长曲线的变化和Z评分结果来探讨长期口服普萘洛尔对IH患儿的影响,进一步评价治疗的安全性。
我国评价儿童生长发育常用的参考值可分为国内标准和国际标准,主要包括:⑴中国九市城、郊区儿童体格发育调查资料参考值,简称“全国九市标准”;⑵美国国家卫生统计中心(NCHS)建议参考值,简称“NCHS参考标准”;⑶2006年4月世界卫生组织(WHO)公布的新的《儿童生长标准》,简称“WHO参考标准”[21]。本研究根据全国九市标准绘制生长曲线,其中生长速度下降定义为疗程中生长曲线出现2次及以上百分位数较用药前下降10%[14];并根据WHO参考标准计算停药时年龄别体质量Z值(WAZ)、年龄别身高Z值(HAZ)和身高别体质量Z值(WHZ)来反映患儿近、远期的营养状况。
共有11例患儿在口服普萘洛尔数月后出现生长增长速度下降,大部分患儿在用药3~4个月、6~9个月龄时出现生长增长速度下降,分别表现为身高或体质量增长速度下降或同时出现;10例(90.9%)患儿在停药后平均8.7个月内均回归到正常曲线趋势,仅1例患儿在3周岁随访时体质量仍然未恢复到用药前百分位水平,该患儿4个月龄时开始用药,疗程持续14个月。体质量曲线显示,在用药8个月后即患儿1岁后体质量一直保持稳定水平,并无继续下降。根据WHO参考标准,47例患儿均未出现低体质量、生长发育迟缓和消瘦,2例(4.3%)患儿超重,3例(6.4%)患儿肥胖。这些结果提示,11例患儿增长速度下降的程度较轻,而且是暂时性的。
儿童生长发育是自身先天与后天及各种外界环境因素相互作用的结果,已有多篇文献报道我国儿童的身高、体质量在6个月龄内,与发达国家婴儿无明显差异,而6个月龄后逐渐落后,提示可能辅食添加不合理所致。本研究中,11例患儿出现生长的增长速度下降时间正值添加辅食阶段,所以,辅食添加不足可能也是造成其增长速度下降的因素之一。另外,考虑到开始用药年龄和疗程长短可能产生的影响,通过卡方检验结果发现这11例患儿中,4.3个月以内用药和疗程超过8个月与4.3个月之后用药、疗程短于8个月之间并无统计学差异,初步提示生长的增长速度下降与用药年龄和疗程无明显相关。
综上所述,本研究认为口服普萘洛尔治疗IH安全有效,对患儿身高、体质量增长的影响微小,且可恢复。但由于本研究病例数偏小,收集的资料还不够全面,因此更加科学、合理的结论需要长时间的随访以及多学科之间的共同合作。
[1] Bruckner AL, Frieden IJ. Hemangiomas of infancy[J]. J Am Acad Dermatol, 2003,48(4):477-93. quiz 94-96.
[2] Ho NT, Lansang P, Pope E. Topical imiquimod in the treatment of infantile hemangiomas: a retrospective study[J]. J Am Acad Dermatol, 2007,56(1):63-68.
[3] Drolet BA, Esterly NB, Frieden IJ. Hemangiomas in children[J]. N Engl J Med, 1999,341(3):173-181.
[4] Enjolras O, Gelbert F. Superficial hemangiomas: associations and management[J]. Pediatr Dermatol, 1997,14(3):173-179.
[5] Metry DW, Dowd CF, Barkovich AJ, et al. The many faces of PHACE syndrome[J]. J Pediatr, 2001,139(1):117-123.
[6] Bennett ML, Fleischer AB Jr., Chamlin SL, et al. Oral corticosteroid use is effective for cutaneous hemangiomas: an evidence-based evaluation[J]. Arch Dermatol, 2001,137(9):1208-1213.
[7] Léauté-Labréze C, Dumas de la Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy[J]. N Engl J Med, 2008,358(24):2649-2651.
[8] Hsu TC, Wang JD, Chen CH, et al. Treatment with propranolol for infantile hemangioma in 13 Taiwanese newborns and young infants[J]. Pediatr Neonatol, 2012,53(2):125-132.
[10] Spiteri Cornish K, Reddy AR. The use of propranolol in the management of periocular capillary haemangioma-a systematic review[J]. Eye (London, England), 2011,25(10):1277-1283.
[11] Bertrand J, McCuaig C, Dubois J, et al. Propranolol versus prednisone in the treatment of infantile hemangiomas: a retrospective comparative study[J]. Pediatr Dermatol, 2011,28(6):649-654.
[12] Price CJ, Lattouf C, Baum B, et al. Propranolol vs corticosteroids for infantile hemangiomas: a multicenter retrospective analysis[J]. Arch Dermatol, 2011,147(12):1371-1376.
[13] 金云波, 林晓曦, 叶肖肖. 普萘洛尔作为严重婴幼儿血管瘤一线治疗的前瞻性研究[J]. 中华整形外科杂志, 2011,27(3):170-173.
[14] Boon LM, MacDonald DM, Mulliken JB. Complications of systemic corticosteroid therapy for problematic hemangioma[J]. Plast Reconstr Surg, 1999,104(6):1616-1623.
[15] Marqueling AL, Oza V, Frieden IJ, et al. Propranolol and infantile hemangiomas four years later:a systematic review[J]. Pediatr Dermatol, 2013,30(2):182-191.
[16] Breur JM, de Graaf M, Breugem CC, et al. Hypoglycemia as a result of propranolol during treatment of infantile hemangioma: a case report[J]. Pediatr Dermatol, 2011,28(2):169-171.
[17] de Graaf M, Breur JM, Raphael MF, et al. Adverse effects of propranolol when used in the treatment of hemangiomas: a case series of 28 infants[J]. J Am Acad Dermatol, 2011,65(2):320-327.
[18] Phillips RJ, Penington AJ, Bekhor PS, et al. Use of propranolol for treatment of infantile haemangiomas in an outpatient setting[J]. J Paediatr Child Health, 2012,48(10):902-906.
[19] Jian D, Chen X, Babajee K, et al. Adverse effects of propranolol treatment for infantile hemangiomas in China[J]. J Dermatolog Treat, 2014,25(5):388-390.
[20] Park YW, Yeom KB, Choi JW, et al. Effect of propranolol on the treatment of infantile hemangiomas: a single tertiary center 3-year experience[J]. J Dermatolog Treat, 2014,25(5):391-395.
[21] 袁 平, 王晓莉, 王 燕. 我国常用的三种儿童生长发育评价标准的比较[J]. 中国儿童保健杂志, 2008,16(6):682-684.
Effect of systemic propranolol for infantile hemangiomas on infants′ height and weight
HULi,HUANGHui-zhen,QIUYa-jing,etal.
(DepartmentofPlasticandReconstructiveSurgery,ShanghaiNinthPeople'sHospital,ShanghaiJiaotongUniversity,SchoolofMedicine,Shanghai200011,China)
Objective To investigate the effect of systemic propranolol for infantile hemangiomas on infants′height and weight. Methods We collected growth records of patients who
systemic propranolol therapy for hemangiomas from 2009 to 2012. A questionnaire was offered for parents to document growth records including height and weight. The growth records were measured once a month during their first year of life, every three months within the second year and every six months during the next years. A growth curve for height and weight was drawn for each patient. A diminished rate of growth was defined as two or more measured points 10 percent below the pretreatment slope during therapy. Results 47 children with complete data were enrolled into the study. 11 patients suffered from growth retardation, among them, 9 patients dropping off height curves and 6 patients falling below weight curves. However, most of them (90.9%) went back to their pretreatment height and weight curve during several months after propranolol withdrawal. Results of Z-score demonstrated that there was none child suffered from underweight, stunning or wasting when stopping therapy. Conclusion Systemic propranolol was proven to be an effective and safe treatment for problematic IHs with a minor and transient effect on infants′height and weight.
Infantile hemangioma; Propranolol; Height and weight
国家自然科学基金资助项目(81071565) 作者单位:200011 上海,上海交通大学医学院附属第九人民医院 整复外科
胡 丽(1989-),女,安徽桐城人,硕士研究生. 通信作者:李 伟,200011,上海交通大学医学院附属第九人民医院 整复外科,电子信箱:liweiboshi@163.com
10.3969/j.issn.1673-7040.2015.08.008
R732.2
A
1673-7040(2015)08-0472-04
2015-04-06)

