营养动脉栓塞辅助手术治疗Klippel-Trenauney综合征:2例报告及文献回顾
袁斯明, 洪志坚, 姜会庆, 崔 磊, 汪 军, 胡心宝
论 著
营养动脉栓塞辅助手术治疗Klippel-Trenauney综合征:2例报告及文献回顾
袁斯明, 洪志坚, 姜会庆, 崔 磊, 汪 军, 胡心宝
目的 探讨营养动脉栓塞辅助手术治疗Klippel-Trenauney综合征(KTS)的方法及安全性。方法 本组2例KTS患者。1例患者的病变位于右侧臀部和大腿后侧;另1例患者的病变位于右大腿前侧。2例患者均行DSA检查,以明确瘤体的营养动脉并用明胶海绵颗粒栓塞动脉分支。栓塞治疗后3 d,行手术治疗,切除绝大部分病变组织,采用皮瓣和植皮术修复创面。结果 2例患者均成功栓塞营养动脉并进行手术切除和创面修复,术中出血可控,未发生出血过多及其引发的其他并发症。术后1例患者随访1年,患肢功能逐渐恢复。结论 对于肢体肥大非常严重的KTS患者,采用栓塞营养动脉能有效减少病理组织切除术中出血,保障手术安全。
Klippel-Trenauney综合征; 营养动脉; 栓塞; 手术
Klippel-Trenauney综合征(KTS),于1900年由Klippel和Trenauney报道,表现为毛细血管畸形、静脉畸形和骨软组织肥大三联征[1],淋巴管畸形也是KTS的常见特征[2]。KTS主要累及下肢,少数累及上肢,躯干少见(M Samuel, 1995年);也可累及内脏,如尿道、脑组织、纵膈、消化道、脾脏和肺等[3-8]。KTS的病因不清楚,有学者认为可能与AGGF1(VG5Q)基因变异而导致脉管发育异常有关[9-10]。KTS累及各系统,其病程进展不可逆。KTS的治疗以对症处理(压迫治疗、硬化剂注射、曲张浅静脉剥脱或射频治疗、解除深静脉压迫等)延缓病情发展和手术切除病理组织为主[11]。对于肢体肥大非常严重的患者,手术切除病理组织是减轻肢体负担,维持肢体功能的唯一选择。自2009年5~10月,我们成功治疗2例严重的KTS综合征患者,效果较好。现报道如下。
1 病例介绍及治疗过程
例1,患者男性,42岁。先天性左下肢肥大,伴有皮肤红斑和角皮瘤。随年龄增长,左下肢肥大逐渐加重,皮肤色泽加深、粗糙,角皮瘤增大且数量增多,严重影响行走。MRI检查提示:左侧臀部、大腿软组织肥大;臀部内侧皮下积聚大量液体;可见畸形脉管,肌肉无明显异常。DSA检查发现,左侧臀上动脉、臀下动脉、腰5动脉以及旋股外侧动脉为瘤体的主要营养动脉,造影显示上述动脉的多条分支呈扇形分布到病变组织中,未见动静脉瘘。用明胶海绵颗粒栓塞上述动脉的分支,栓塞后再次造影检查,证实上述动脉分支被栓塞,病变组织内无分支动脉显影。栓塞治疗后3 d行手术治疗。术中切除左侧腰臀部及大腿上段绝大部分瘤体,发现瘤体主要是增生的纤维脂肪组织,可见畸形淋巴管和静脉。大腿部瘤体与深筋膜的界限较清楚,臀部肿瘤与臀大肌的分界不清。在肌膜上切除肿瘤。臀部皮瓣原位缝合,皮瓣下放置负压引流管。大腿创面植皮封闭。术中输入红细胞悬液5 U,血浆600 ml。切除肿瘤组织7.5 kg。术中植皮修复创面,皮片成活好。出院后患者失访。
例2,患者女性,50岁。先天性左下肢肥大,以左大腿、膝关节和小腿上段为主,伴有皮肤红斑。随年龄增长左下肢肥大畸形逐渐加重,并伴有严重疼痛,严重影响行走。MRI检查提示,左侧大腿、膝关节和小腿上段软组织肥大,以脂肪组织增生为主,畸形血管丰富。DSA发现瘤体的主要营养动脉是股深动脉的分支旋股外侧动脉,造影显示多条小动脉呈扇形分布到病变组织中,未见动静脉瘘。用明胶海绵颗粒栓塞旋股外侧动脉分支,再次造影检查,证实上述营养动脉的分支全部栓塞,病变组织内无分支动脉显影。栓塞治疗后3 d行手术治疗。切除瘤体组织,取背部皮肤修复创面。术中未输血。术后移植皮肤成活。术后1年随访,未见病变复发,局部疼痛消失,左下肢功能完全正常。见图1。
2 讨论
自1900年被报道以来,KTS的临床病理特征和发病机制逐渐被了解[12]。KTS系低流量混合性脉管畸形,伴骨软组织肥大。在KTS患者中,毛细血管畸形的发生率是95%,静脉畸形的发生率是72%,肢体肥大的发生率是67%(AG Jacob, 1998年)。63%的患者为同时具有以上3种特征的患者,37%的患者出现其中两种特征(AG Jacob, 1998年)。淋巴管畸形也是KTS的常见表现。值得指出的是,KTS需要与Parkes Weber 综合征(PWS)鉴别(MM Jr Cohen, 2000年)。部分临床医师将这两种疾病混淆为Klippel-Trenauney-Weber综合征(KTWS),即具有动静脉瘘的KTS为KTS。实际上虽然都伴有骨或软组织肥大,但它们是两种不同性质的混合性脉管畸形。低流量脉管畸形,有毛细血管、静脉和淋巴管畸形,不伴有动静脉瘘(JB Mulliken, 1993年)。而PWS为高流量脉管畸形,有毛细血管和动静脉畸形,有丰富的动静脉瘘,不伴有淋巴管畸形(JB Mulliken, 1993年)。而且,KTS患者也不具有RASA1基因突变[13],而该基因突变被证实存在于PWS和多发性毛细血管畸形的患者[14]。本组2例患者,临床和病理观察证实,均具有毛细血管、静脉和淋巴管畸形,动脉造影未发现动静脉瘘,因此KTS诊断明确无误。
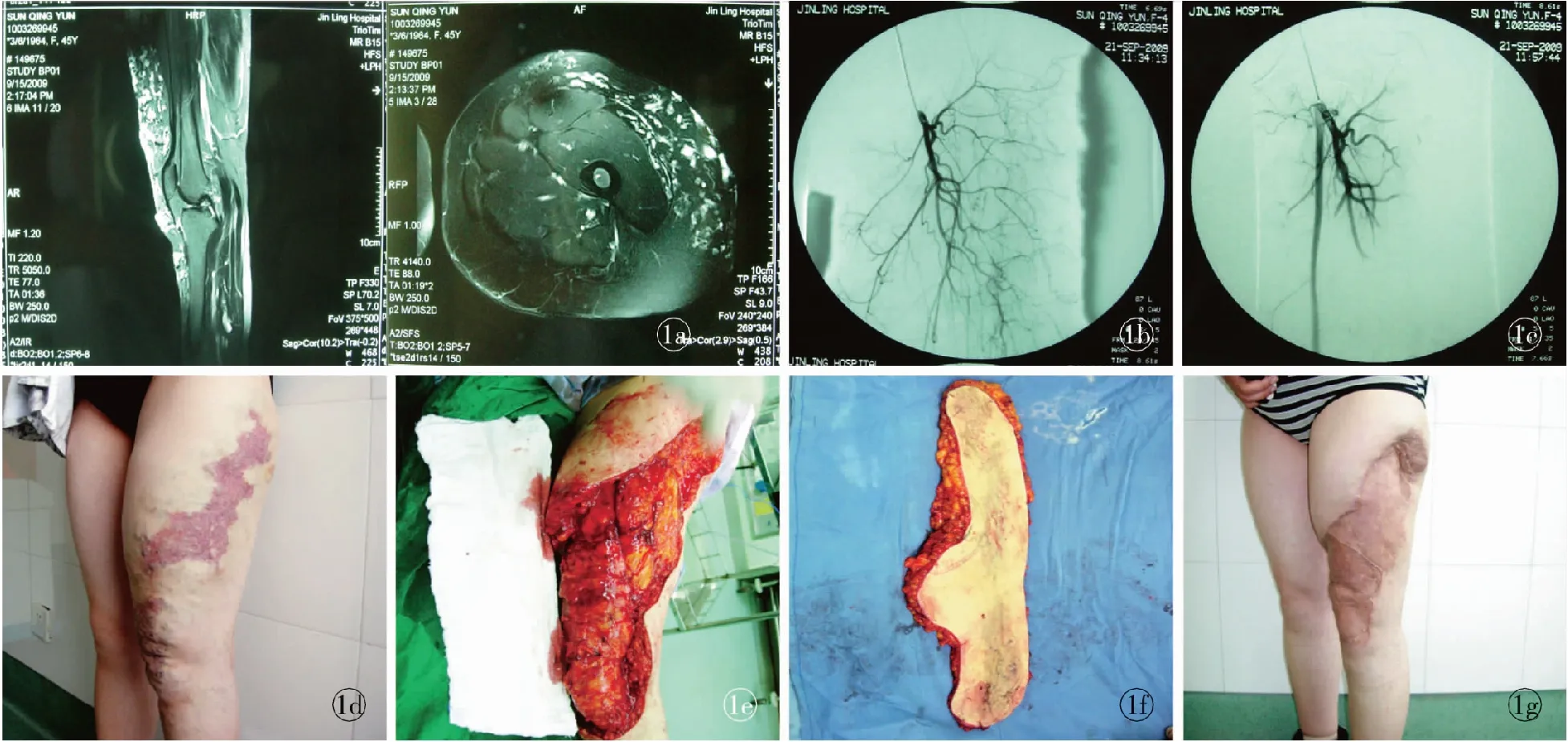
图1 先天性左下肢肥大 a. MRI检查 b. DSA检查栓塞前 c. DSA检查栓塞后术前 d. 术前 e. 栓塞后3 d手术切除瘤体,皮片修复创面 f. 切除的瘤体 g. 术后1年
Fig 1 Congenital hypertrophy on the left lower extremity. a. MRI. b. DSA before embolization. c. DSA after embolization. d. preview. e. postview of surgical removal of the lesion at 3 days after the embolization and repair of the wound by skin flap and graft. f. resection of tumor. g. postview at 1 year.
KTS的病因仍不清楚。1985年,M Servelle认为,主要病因为患肢一段主干静脉因狭窄、闭塞或发育不全而致血液回流障碍,使患肢静脉系统处于慢性高压状态。而主干静脉狭窄或闭塞的原因,主要是受到纤维束带、异常肌肉或静脉周围鞘膜组织的压迫。并认为切除松解这些压迫患肢主干静脉的异常组织,能有效缓解患肢慢性静脉高压状态,再加以弹力套压迫治疗,能有效防止患者KTS的进展。国内外已有大宗病例报道[15]。部分KTS患者的受累肢体存在未闭锁的胚胎静脉,如侧缘静脉和坐骨静脉,提示基因缺陷可导致静脉系统的发育异常[16]。
我们报道的2例患者,其左大腿均已明显增生肥大,病变组织面积很大,加之病变内有大量异常静脉,故如何减少术中出血,保障患者安全是棘手问题。因此,我们设想通过栓塞支配KTS病变的营养动脉,减少病变组织的血供,从而减少手术出血。DSA显示,KTS病变内无动静脉瘘,无特异的畸形营养动脉,而是由解剖位置和结构正常的动脉供血,但病变范围内血管网更密集。经明胶海绵颗粒栓塞后,病变组织内的血管网不显影,提示其血供已被阻断。栓塞后3~5 d内需要进行手术,否则栓塞血管可能发生再通。事实上,在术中我们观察到大部分瘤体组织呈缺血甚至坏死状态。当然,仍然有少量其他动脉的分支进入瘤体,可靠的止血仍然是术中需要特别注意的问题。但我们相信,栓塞营养动脉后确实能有效减少术中出血量,保障患者安全,使严重KTS的手术治疗变得可能。
但由于该动脉并不是KTS病变组织的特异供应动脉,在该动脉供应范围之内的其他组织也将由于栓塞而发生缺血。病例1手术中我们发现部分臀大肌有缺血、变性改变。由于侧枝循环的存在,大部分情况下这种缺血是暂时的,不会产生严重不良后果。病例2在术后均有短时期的左下肢功能减弱,1年后随访时左下肢功能已恢复正常。即使如此,提高栓塞准确性,避免非特异损伤,仍然是本治疗方法今后需要改进之处。
[1] Ricks CB, Grandhi R, Ducruet AF. Klippel-Trenaunay syndrome and cavernous malformations[J]. BMJ Case Rep, 2014, Oct 7.
[2] Liu NF, Lu Q, Yan ZX. Lymphatic malformation is a common component of Klippel-Trenaunay syndrome[J]. J Vasc Surg, 2010,52(6):1557-1563.
[3] Husmann DA, Rathburn SR, Driscoll DJ. Klippel-Trenaunay syndrome: incidence and treatment of genitourinary sequelae[J]. J Urol, 2007,177(4):1244-1249.
[4] Renard D, Campello C, Taieb G, et al. Neurologic and vascular abnormalities in Klippel-Trenaunay-Weber syndrome[J]. JAMA Neurol, 2013,70(1):127-128.
[5] Duman L, Karnak I, Akinci D, et al. Extensive cervical-mediastinal cystic lymphatic malformation treated with sclerotherapy in a child with Klippel-Trenaunay syndrome[J]. J Pediatr Surg, 2006,41(1):21-24.
[6] Herman R, Kunisaki S, Molitor M, et al. Rectal bleeding, deep venous thrombosis, and coagulopathy in a patient with Klippel-Trénaunay syndrome[J]. J Pediatr Surg, 2012,47(3):598-600.
[7] Misawa T, Shiba H, Fujiwara Y, et al. Massive splenomegaly caused by cavernous hemangiomas associated with Klippel-Trenaunay syndrome: report of a case[J]. Surg Today, 2014,44(1):197-200.
[8] Douma RA, Oduber CE, Gerdes VE, et al. Chronic pulmonary embolism in Klippel-Trenaunay syndrome[J]. J Am Acad Dermatol, 2012,66(1):71-77.
[9] Tian XL, Kadaba R, You SA, et al. Identification of an angiogenic factor that when mutated causes susceptibility to Klippel-Trenaunay syndrome[J]. Nature, 2004,427(6975):640-645.
[10] Chen D, Li L, Tu X, et al. Functional characterization of Klippel-Trenaunay syndrome gene AGGF1 identifies a novel angiogenic signaling pathway for specification of vein differentiation and angiogenesis during embryogenesis[J]. Hum Mol Genet, 2013,22(5):963-976.
[11] Gloviczki P, Driscoll DJ. Klippel-Trenaunay syndrome: current management[J]. Phlebology, 2007,22(6):291-298.
[12] 郭 遥, 袁斯明. Klippel-Trenaunay综合征: 回顾与进展[J]. 中国美容整形外科杂志, 2014,25(12):745-746.
[13] Revencu N, Boon LM, Dompmartin A, et al. Germline mutations in RASA1 are not found in patients with Klippel-Trenaunay Syndrome or capillary malformation with limb overgrowth[J]. Mol Syndromol, 2013,4(4):173-178.
[14] Revencu N, Boon LM, Mulliken JB, et al. Parkes Weber syndrome, vein of Galen aneurysmal malformation, and other fast-flow vascular anomalies are caused by RASA1 mutations[J]. Hum Mutat, 2008,29(7):959-965.
[15] 常光其, 王深明, 林勇杰, 等. 先天性静脉畸形骨肥大综合征的外科治疗[J]. 中山医科大学学报, 2000,21(2):148-150.
[16] Oduber CE, Young-Afat DA, van der Wal AC, et al. The persistent embryonic vein in Klippel-Trenaunay syndrome[J]. Vasc Med, 2013,18(4):185-191.
Treatment of Klippel-Trenauney syndrome by operation assisted with preoperative embolization of nutritional artery: 2 cases report and literature review
YUANSi-ming,HONGZhi-jian,JIANGHui-qing,etal.
(DepartmentofBurnandPlasticSurgery,NanjingGeneralHospitalofNanjingCommand,Nanjing210002,China)
Objective To explore the method and safety of operation assisted with preoperative embolization of nutritional artery on the treatment of Klippel-Trenauney sysdrome (KTS). Methods Two KTS patients were with giant hypertrophy on right buttock and posterior thigh(Case 1) and ventral thigh (Case 2). The nutrient arteries of tumors were identified by DSA, and then the branches of the arteries were embolized by the particles of gelatin sponge. The operations were performed to resect the hypertrophic tissue at 3 days after the embolization. The wounds were repaired by flap and skin graft. Results Both of the two patients underwent successful embolization of nutritional arteries and subsequent operation. The bleeding in operation was controllable without the complications related to excessive haemorrhage. The function of the limb recovered gradually after one year following up. Conclusion For KTS patients with very serious hypertrophy on the limbs, pre-operative embolization of nutritional artery can effectively reduce the haemorrhage in the resection of hypertrophic tissue.
Klippel Trenauney sysdrome; Nutritional artery; Embolization; Operation
210002 江苏 南京,南京军区南京总医院 整形外科
袁斯明(1976-),男,江西丰城人,副主任医师,博士.
10.3969/j.issn.1673-7040.2015.08.007
R732.2;R658.3
A
1673-7040(2015)08-0469-03
2015-03-27)

