光质对生姜试管苗生长及微型姜诱导的影响
王兴翠 曹逼力

摘要:采用裂区试验设计方法,研究了光质对不同品种生姜试管苗生长及其对试管微型姜形成的影响。结果表明,蓝光(B)处理的试管苗繁殖系数较白光(W)处理增加18.97%,绿光(G)处理则降低15.31%,红光(R)、黄光(Y)处理与W处理无显著差异,试管苗单株生物量除G处理与W处理无显著差异外,R、B、Y处理分别较W处理降低1416%、22.70%、34.61%,且G、R处理的试管苗株高较W处理显著增加,G、Y、R处理的茎粗则显著降低。G、B、R处理试管苗微型姜形成时间分别较W处理提早19.76%、17.44%、10.12%,而Y处理则延迟了11.86%;微型姜鲜质量以G处理较高,达2.23 g,较W处理增加34.34%,而R、B、Y处理则与W处理无显著差异。不同品种生姜试管苗生长量及微型姜形成也显著不同,其繁殖系数以莱芜小姜(LWXJ)处理较高,莱芜大姜(LWDJ)处理次之,山农大姜(SNDJ)处理较低,单株生物量则相反,分别为3.49、3.82、4.10 g;LWXJ、LWDJ、SNDJ处理微型姜形成所需时间分别为39.05、37.18、34.51 d,其微型姜鲜质量分别为1.35、1.52、2.60 g。
关键词:光质;生姜;组织培养;繁殖系数;微型姜诱导
中图分类号: S632.504+.3 文献标志码: A 文章编号:1002-1302(2015)07-0142-04
大量研究表明,植物可通过光受体感受不同光质[1],进而调控植物的生长、光合作用、形态建成、物质代谢[2-4]以及基因表达[4];同时光质可作为一种信号影响植物体内源激素水平[2]和乙烯产生[5],从而引发植物一系列的生理变化[6]。前人研究表明,白光有利于葡萄试管苗的增殖和生物量的积累[7],但白光对康乃馨试管苗的增殖作用不及蓝光、绿光[8]。绿光可促进拟南芥及绞股蓝的生长[9-10],但易造成番茄幼苗徒长,蓝光则可抑制番茄、马铃薯、黄瓜、结球甘蓝幼苗茎的伸长生长,促进加粗生长,红光则相反[11-13]。车生泉等研究表明,红光显著提高了小苍兰组培苗的生物量,并促进了不定芽的发生,而蓝光则相反[14];但蓝光、红光均有利于小苍兰球茎的发育,且以蓝光的效果较为显著[15];同时,蓝光虽可促进2品种马铃薯试管苗提早结薯,却不利于其生物量和单薯质量的增加,而红光对马铃薯品种Atlantic所起的作用与蓝光正好相反[12]。可见不同植物对光质的反应存在显著差异。
生姜(Zingiber oficinale Rosc.)起源于热带雨林地区,多进行遮光栽培[16]。张瑞华等研究表明,相同遮光率条件下,遮光光质可显著影响大田生姜生长及光能利用特性[17]。生产中生姜以其根状茎为繁殖材料,繁殖系数较低,而且长期无性繁殖很容易发生种性退化,因此前人在生姜组培脱毒快繁技术方面进行了较多研究,适合生姜试管苗生长的光强及光周期得以确定[18],但关于光质与生姜试管苗生长及微型姜诱导的关系尚未见报道。本研究探讨了不同光质对不同品种生姜试管苗生长及微型姜诱导的影响,研究不同光质对生姜试管苗形态建成的调控作用,旨在为提高生姜组培快繁效率及种质资源的试管保存提供参考。
1 材料与方法
1.1 试验设计
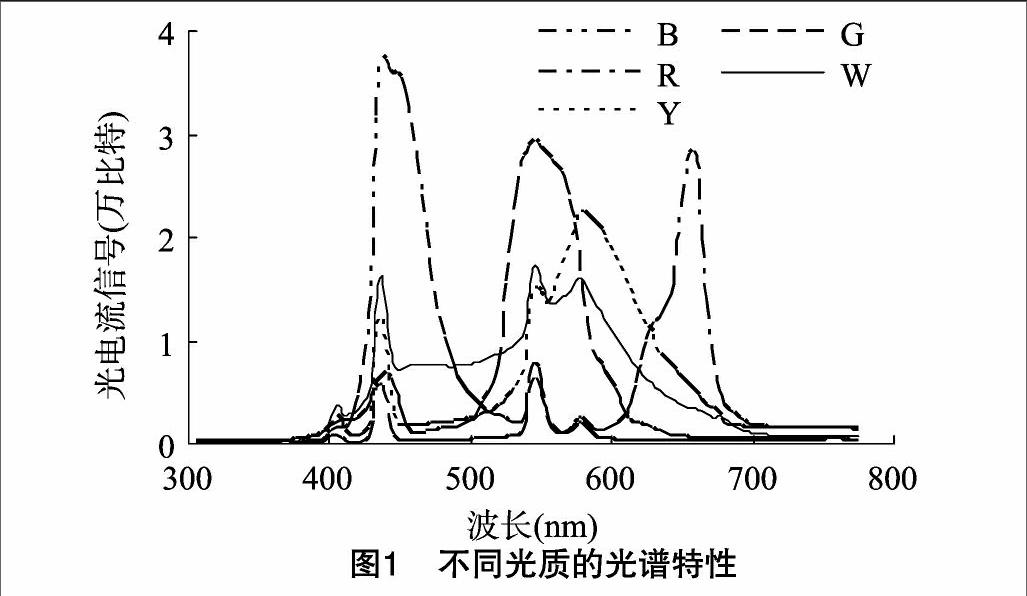
试验采用裂区设计,主区为生姜品种(A),分别为莱芜小姜(LWXJ)、莱芜大姜(LWDJ)、山农大姜1号(SNDJ);副区为光质(B),分别为红光(R)、绿光(G)、蓝光(B)、黄光(Y)、白光(W),其光谱特征见图1。通过调整组培层架日光灯高度,使不同处理组培苗受光强度均保持在50 μmol/(m2·s)左右,培养室环境温度(26±1) ℃,光周期16 h/d。
参照Zheng等的方法[19],取生姜茎尖接种于附加2 mg/L KT、0.5 mg/L NAA及2%蔗糖的MS培养基上,培养30 d后测定试管苗的株高、茎粗、繁殖系数及根、茎、叶鲜质量,以研究光质对生姜试管苗生长的影响。
取白光条件下培养的生姜丛生试管苗,分割成单株后,剪茎去根转接于含2.5 mg/L KT、0.5 mg/L NAA及8%蔗糖的MS微型姜诱导培养基中,培养45 d后测定微型姜鲜质量,期间调查微型姜形成的初始时间,以研究光质与微型姜诱导的关系。
调节培养基pH值为5.8,于121 ℃下灭菌,每瓶均接入2个外植体,每处理60瓶,每10瓶为1个重复。
1.2 数据处理
试验数据采用Excel软件及DPS数据处理系统进行分析,采用邓肯氏新复极差法进行显著性检验[20]。
2 结果与分析
2.1 不同光质对生姜试管苗生长的影响
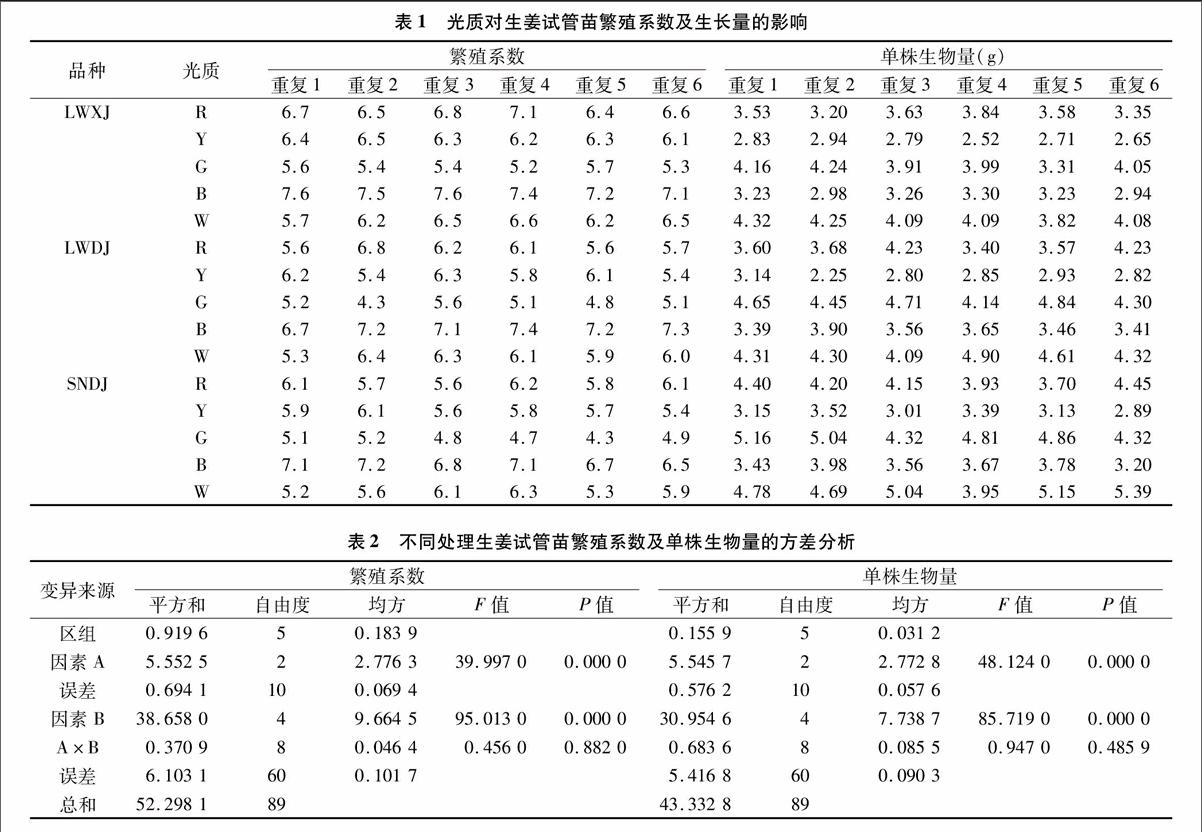
表1为光质对不同品种生姜试管苗繁殖系数及生物量的影响,方差分析结果(表2)表明,试管苗繁殖系数及生物量区组间差异未达到显著水平,说明该试验区组间差异较小,试验结果可靠。生姜品种(A)间、光质处理(B)间试管苗繁殖系数及生物量的差异均极显著(P<0.01),表明生姜品种及光质处理对生姜试管苗繁殖系数和生物量均有极显著影响,但A×B均不显著,说明生姜品种与光质处理的互作效应不显著。
2.2 不同处理生姜试管苗生长量的多重比较
从表3可以看出,不同生姜品种试管苗的繁殖系数及单株生物量存在极显著差异。繁殖系数以LWXJ处理较高,为6.42;LWDJ处理次之,为6.01;SNDJ处理较低,为5.83。单株生物量以LWXJ处理较低,为3.49 g;SNDJ处理较高,为410 g;LWDJ处理居中,为3.82 g。表3还显示,不同光质处理的试管苗繁殖系数也存在显著差异,其中B、G处理分别较W处理增加18.97%、降低15.31%,R、Y、W处理间无显著差异;光质处理也显著影响试管苗生物量,除G、W处理无显著差异外,R、B、Y处理分别较W处理降低14.16%、22.70%、34.61%。endprint
由表3可以看出,不同处理下生姜试管苗株高、茎粗及根、茎、叶鲜质量存在显著差异。除SNDJ处理株高较低外,茎粗及根、茎、叶鲜质量SNDJ处理均显著高于LWXJ、LWDJ处理,而LWDJ处理的茎粗及茎、叶鲜质量则显著高于LWXJ处理。不同光质处理试管苗的株高由高到低依次为G、R、W、Y、B处理;茎粗则以W、B处理较高,G处理次之,Y、R处理较低;G、B、R处理的根鲜质量分别比W处理高3333%、1819%、12.12%,Y与W处理无显著差异;茎鲜质量以W处理较高,G、R、B、Y分别较W处理降低10.34%、14.22%、2759%、37.07%;在叶鲜质量方面,G、W处理之间无显著差异,但R、B、Y处理分别较W处理降低18.89%、2389%、36.67%。
2.3 不同光质对微型姜的诱导效果
表4是不同处理对试管苗微型姜的诱导效果,由表5可见,微型姜诱导时间及微型姜鲜质量区组间差异未达到显著水平,但生姜品种(A)间、光质处理(B)间的差异均达到极显著水平(P<0.01),表明生姜品种及光质处理对生姜试管苗微型姜的诱导均有极显著影响,但A×B均未达显著水平(P>0.05),说明生姜品种与光质处理对微型姜诱导的互作效应不显著。
2.4 不同处理微型姜诱导效果的多重比较
表6显示,不同生姜品种试管苗微型姜的诱导时间存在
极显著差异,LWXJ、LWDJ、SNDJ处理的诱导时间分别为39.05、37.18、34.51 d;光质处理则以G、B、R处理的诱导时间较少,分别比W处理缩短了19.76%、17.44%、10.12%,Y处理则比W处理延长了11.86%。不同品种试管苗微型姜鲜质量以SNDJ处理较高,LWDJ处理次之,LWXJ处理较低,分别为2.60、1.52、1.35 g;光质处理对微型姜的影响极为显著,G处理显著高于W处理,而R、B、Y处理则与W处理无显著差异。
3 结论与讨论
3.1 光质对生姜试管苗生长发育的影响
前人研究表明,白光较单色光更有利于葡萄和洋桔梗试管苗的增殖,且不同品种葡萄试管苗的增殖倍数不尽相同[7,21],但菩提树不定芽的再生则以短波光的促进作用明显[22]。本研究发现,蓝光可促进LWXJ、LWDJ、SNDJ处理生姜试管苗不定芽的分化,显著提高其繁殖系数,这与短波光可促进烟草[23]及康乃馨[8]试管苗侧芽发生的结果基本一致。本研究中绿光处理的生姜试管苗繁殖系数较低,说明不定芽的分化对生理有效光有较强的依赖性[14]。蓝光促进作物茎秆加粗生长、抑制伸长生长,而绿光、红光则使植株徒长[3,7],本研究也得出相似结果,但红光、绿光在菊花[2]、葡萄[3]、烟草[23]上的效应也有相反的结论。苏小玲研究发现,绿光、红光处理的葡萄试管苗GA3的含量较高,试管苗徒长[25]。从内源GA3的生理作用可知,内源GA3和茎长有关,进而可以影响其株高;有研究证明涂抹GA3对马铃薯株高和植株鲜质量有明显的促进作用[26-27]。本研究中,红光、绿光促进试管苗的伸长生长,其原因可能是2种光质提高了植株体内的GA含量,从而使其节间伸长,株高增大;蓝光则抑制植物的纵向生长,其作用机理可能是蓝光提高了IAA氧化酶的活性,使IAA水平降低,进而抑制植物的伸长生长[28]。
3.2 光质对生姜试管苗微型姜诱导的影响
常宏等研究证实,蓝光可提早马铃薯试管苗结薯期,并增加结薯数量[12];但铁棍山药微型块茎的诱导则以红光作用较为显著[29]。本研究表明,不同光质不仅影响生姜试管苗的生长,还影响其形态建成,表现为绿光、蓝光、红光可以让试管微型姜提早形成,黄光则延迟微型姜的形成,该结论与车生泉等研究得出的红光、蓝光提前诱导小苍兰球茎的发生,黄光、绿光产生滞后作用的结论[15]不尽一致。
对于组培的试管苗来说,其能量的主要来源不是利用光合作用生产的糖类,而是培养基中的糖类[7]。增施GA3可以让马铃薯生育期延长,使植株有足够的物质积累以利于马铃薯块茎的膨大[30];但Simko 等研究认为,添加GA3使内源自由态GA3含量增大,不利于马铃薯试管薯的形成[26]。本研究表明,LWXJ、LWDJ、SNDJ处理微型姜鲜质量均以绿光诱导较大,除了与绿光处理的繁殖系数较低,利于前期养分的集中供应并通过异养作用进行生物量的积累有关外,可能还与绿光影响了植株体内的GA3激素水平有关。蓝光下生姜植株的繁殖系数最大,但对微型姜鲜质量促进作用次之,这可能与在蓝光下生长的作物蛋白质含量较高有关[31]。红光下生姜试管苗株高和微型姜的鲜质量也显著增加,其原因除了红光影响了体内激素水平外,还可能与在红光下生长的作物碳水化合物含量通常较高有关[3]。
光质对生姜试管苗及微型姜诱导的影响与已报道的光质对其他植物的影响不尽一致,说明不同植物、不同组织或器官在不同发育年龄或状态对同一种光质的反应不尽相同,表现出光质生物学反应的复杂性[29];生姜微型姜的形成与内源激素间平衡的改变有关,而不是单一内源激素变化引起的,有关光质对生姜试管苗生长发育的影响有待进一步研究。
参考文献:
[1]Ward J M,Cufr C A,Denzel M A,et al. The Dof transcription factor OBP3 modulates phytochrome and cryptochrome signaling in Arabidopsis[J]. The Plant Cell,2005,17(2):475-485.
[2]魏胜林,王家保,李春保. 蓝光和红光对菊花生长和开花的影响[J]. 园艺学报,1998,25(2):100-101.
[3]时向东,蔡 恒,焦 枫,等. 光质对作物生长发育影响研究进展[J]. 中国农学通报,2008,24(6):226-230.endprint
[4]郑 洁,胡美君,郭延平. 光质对植物光合作用的调控及其机理[J]. 应用生态学报,2008,19(7):1619-1624.
[5]Gorbineau F,Rudnicki R M,Goszczynska D M,et al. The effect of light quality on ethylene production in leaves of oat seedlings(Avena sativa L.)[J]. Environmental and Experimental Botany,1995,35(2):227-233.
[6]Smith H. Phytochromes and light signal perception by plants-an emerging synthesis[J]. Nature,2000,407(684):585-591.
[7]刘 媛,李 胜,马绍英,等. 不同光质对葡萄试管苗离体培养生长发育的影响[J]. 园艺学报,2009,36(8):1105-1112.
[8]倪德祥,张丕方,陈 刚,等. 光质对康乃馨试管苗生长发育的影响[J]. 园艺学报,1985,12(3):197-202.
[9]Folta K M. Green light stimulates early stem elongation,antagonizing light-mediated growth inhibition[J]. Plant Physiology,2004,135(3):1407-1416.
[10]李馨芸.光质对绞股蓝生长、光合作用及次生代谢产物积累的影响[D]. 吉首:吉首大学,2012.
[11]蒲高斌,刘世琦,刘 磊,等. 不同光质对番茄幼苗生长和生理特性的影响[J]. 园艺学报,2005,32(3):420-425.
[12]常 宏,王玉萍,王 蒂,等. 光质对马铃薯试管薯形成的影响[J]. 应用生态学报,2009,20(8):1891-1895.
[13]曹 刚. 不同LED光质对黄瓜和结球甘蓝苗期生长、光合特性及内源激素的影响[D]. 兰州:甘肃农业大学,2013.
[14]车生泉,盛月英,秦文英.光质对小苍兰茎尖试管培养的影响[J]. 园艺学报,1997,24(3):64-68.
[15]车生泉,秦文英. 光质对小苍兰茎尖试管成球的影响[J]. 上海农学院学报,1998,16(2):121-123.
[16]赵德婉. 生姜优质丰产栽培原理与技术[M]. 北京:中国农业出版社,2002.
[17]张瑞华,徐 坤,董灿兴,等. 光质对姜生长及光能利用特性的影响[J]. 园艺学报,2008,35(5):673-680.
[18]范国强,徐 坤. 生姜脱毒与高产栽培技术[M]. 北京:中国农业科学技术出版社,2000.
[19]Zheng Y Q,Liu Y M,Xu K.Increasing in vitro microrhizome production of ginger(Zingiber officinale Roscoe.)[J]. Acta Physilogiae Plantarum,2008,7(4):513-519.
[20]唐启义,冯明光.DPS数据处理系统[M]. 北京:科学出版社,2007:105-110.
[21]杨长娟,凌 青,任兴平,等. LED不同光质对洋桔梗组培苗增殖的影响[J]. 北方园艺,2011(18):154-156.
[22]姚立平. 不同光质对菩提树组培苗生长发育的影响[J]. 辽宁林业科技,2011(6):21-22,42.
[23]Seibert M,Wetherbee P J,Job D D. The effects of light intensity and spectral quality on growth and shoot initiation in tobacco callus[J]. Plant Physiology,1975,56(1):130-139.
[24]Sung I K,Kiyota M,Hirano T. The effects of time and intensity of supplemental blue lighting during morning twilight on growth and physiological performance of cucumber seedlings[J]. Life Support & Biosphere Science:International Journal of Earth Space,1998,5(2):137-142.
[25]苏小玲.不同光质对葡萄试管苗生长及内源激素含量变化的影响[D]. 兰州:甘肃农业大学,2009.
[26]Simko I. Sucrose application causes hormonal changes associated with potato tuber induction[J]. Plant Growth Regulation,1994, 13(2):73-77.
[27]秦忠群,王季春. 赤霉素(GA3)与茉莉酸甲酯(MeJA)对雾培马铃薯内源激素与生长发育的影响[J]. 中国马铃薯,2006,20(1):5-11.
[28]李韶山,潘瑞炽. 植物的蓝光效应[J]. 植物生理学通讯,1993,29(4):248-252.
[29]郭君丽,王俊甫,李明军,等. 光质对怀山药微型块茎诱导形成的影响[J]. 浙江万里学院学报,2006,19(2):91-93.
[30]肖关丽,郭华春. 马铃薯温光反应及其与内源激素关系的研究[J]. 中国农业科学,2010,43(7):1500-1507 .
[31]Kowallik W. Bule light affects on respiration[J]. Annu Rev Plant Physiol,1982,33:51-72.
[32]Drum-Herrel H,Mohr H. Relative importance of blue light and light absorbed by phytochrome in growth of mustard(Sinapis alba L.) seedlings[J]. Photochemistry and Photobiology,1985,42(6):735-739.endprint

