酶法提取葡萄酒废酵母胞壁多糖的工艺
李双石 张虎成 李浡 吴志明 冀振红

摘要:通过单因素和正交试验,对葡萄酒废酵母多糖的超声波提取工艺进行优化,确定最佳提取工艺条件为:中性蛋白酶加酶量0.3%、酶解温度50 ℃、酶解时间1.5 h、pH值6.0,在此工艺条件下酵母胞壁多糖提取率可达13.67%。
关键词:葡萄酒废酵母;多糖;酶法提取;工艺优化;正交试验
中图分类号: TS261.1+1 文献标志码: A 文章编号:1002-1302(2015)07-0311-03
葡萄酒废酵母是葡萄酒酿造的主要副产物之一,其排放量约占葡萄酒产量的4%~5%[1]。葡萄酒酵母泥富含营养,将其直接排放,不僅会造成排水的生物耗氧量负荷,而且也会造成很大的资源浪费和环境污染。因此,葡萄酒废酵母的高效再利用已引起国内外学者的关注。
酵母多糖是酵母细胞壁的主要组分,占酵母细胞壁干质量的40%左右[2]。已有研究表明,酵母胞壁多糖主要有葡聚糖、甘露聚糖和少量几丁质组成,它们具有良好的生物活性,如抗辐射、抗肿瘤、抗氧化、提高免疫力等。在食品工业中,酵母胞壁多糖还能充当乳化剂、增稠剂、低热食品原料等[3]。如葡萄酒酿造业中可选择在不同酿酒阶段添加酵母多糖制品,用于防止酒石酸盐结晶、增加香气复杂度、改善葡萄酒特定或整体品质的目的[2]。
由于酵母胞壁多糖在菌体细胞中多与蛋白质、脂类等物质以络合物的形式存在,因此需要对胞壁多糖进行分离提取后再加以利用。目前,关于啤酒废酵母多糖提取工艺研究较多[4-8],但利用葡萄酒废酵母提取多糖的研究还很少[9,10]。酵母多糖常用提取技术有自溶法[4]、碱溶法[4,7,9]、微波辅助提取法[5]、超声波辅助提取法[8,10]等,其中碱溶法操作简单、成本低,但提取时间过长、提取率低;超声波辅助提取法和微波辅助提取法提取时间短,但其设备成本和能耗较高;自溶法具有工艺过程复杂、提取率低等缺陷。与上述几种方法相比,酶法由于具有反应条件温和、选择性强、设备要求低等优点,近年来已被广泛用于酵母多糖的提取[4,6],但采用生物酶法提取葡萄酒废酵母多糖的研究尚未见报道。
本研究以葡萄酒废酵母为原料,以多糖提取率为衡量指标,通过正交试验法[11-13]优化酵母胞壁多糖提取工艺参数,以期为葡萄酒废酵母资源的开发提供理论依据和技术参考。
1 材料与方法
1.1 材料
葡萄酒废酵母泥:北京电子科技职业学院葡萄酒中试生产自产,采自2013年11月。
中性蛋白酶和碱性蛋白酶购自成都格雷西亚化学技术有限公司,胃蛋白酶购自北京芳草医药工业研制公司,木瓜蛋白酶购自北京奥博星生物技术有限责任公司,β-葡聚糖酶购自上海源叶生物科技有限公司。
1.2 试验仪器
电热恒温鼓风干燥箱(上海一恒科技有限公司),可见分光光度计(北京普析通用仪器有限责任公司)。
1.3 方法
1.3.1 葡萄酒废弃酵母预处理 将葡萄酒泥与蒸馏水以 1 ∶1 混合,用60目筛筛分,4 000 r/min离心20 min。重复上述步骤,直至所得沉淀为白色,上清液无色透明为止,收集沉淀,60 ℃鼓风干燥处理,磨粉。
1.3.2 葡萄酒废酵母多糖的提取 精确称取0.200 g酵母泥粉加至20 mL活化后的酶液中,对菌悬液进行不同生物酶(胃蛋白酶、木瓜蛋白酶、蜗牛酶、中性蛋白酶、碱性蛋白酶)、不同酶量(0.1%~0.4%)、不同温度(40~60 ℃)、不同时间(0.5~3.0 h)和不同pH值(4.0~7.0)的酶解处理,离心,取上清,量取提取液的总体积v,将提取液稀释至适当倍数n,检测提取液中多糖含量c,计算酵母多糖提取率。
酵母多糖提取率=CVn/m×100%,C为粗提液中多糖浓度,V为粗提液体积,n为粗提液稀释倍数,m为废酵母粉质量。
1.3.3 多糖含量的测定 多糖含量测定采用苯酚-硫酸比色法。
标准曲线的制作:分别吸取标准葡萄糖溶液(40 μg/mL)0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL置于比色管中,补蒸馏水至2.0 mL,再加入1.0 mL 6%苯酚后,置冷水中迅速加入5.0 mL浓硫酸,摇匀后于冷水中放置5 min,然后置沸水浴中加热15 min,再置冷水中放置5 min,最后于490 nm波长下测吸光度。以2.0 mL蒸馏水按同样显色操作为空白样。以吸光度D为纵坐标,以多糖浓度C(μg/mL,以葡萄糖计)为横坐标,绘制标准曲线。
粗提液中多糖含量的测定:用2.0 mL多糖粗提液代替葡萄糖标准液和水的混和物,用同样的显色方法测定粗提液中多糖含量。
1.3.4 多糖提取条件优化
1.3.4.1 单因素试验条件优化 分别对生物酶种类、加酶量、酶解温度、酶解时间和酶解液pH值进行单因素试验,考察各因素对葡萄酒废酵母多糖提取率的影响。
1.3.4.2 正交试验条件优化 根据单因素试验结果确定葡萄酒废酵母多糖提取正交试验的因素和水平(表1)。采用4因素3水平的正交试验设计,对葡萄酒废酵母多糖提取工艺进行优化。
2 结果与分析
2.1 多糖含量测定的标准曲线
通过检测不同葡萄糖标准液的吸光度,求得多糖浓度C与吸光度D的回归方程:D=0.021 5C+0.000 6(r2=0.999 7),标准曲线见图1所示。
2.2 单因素试验
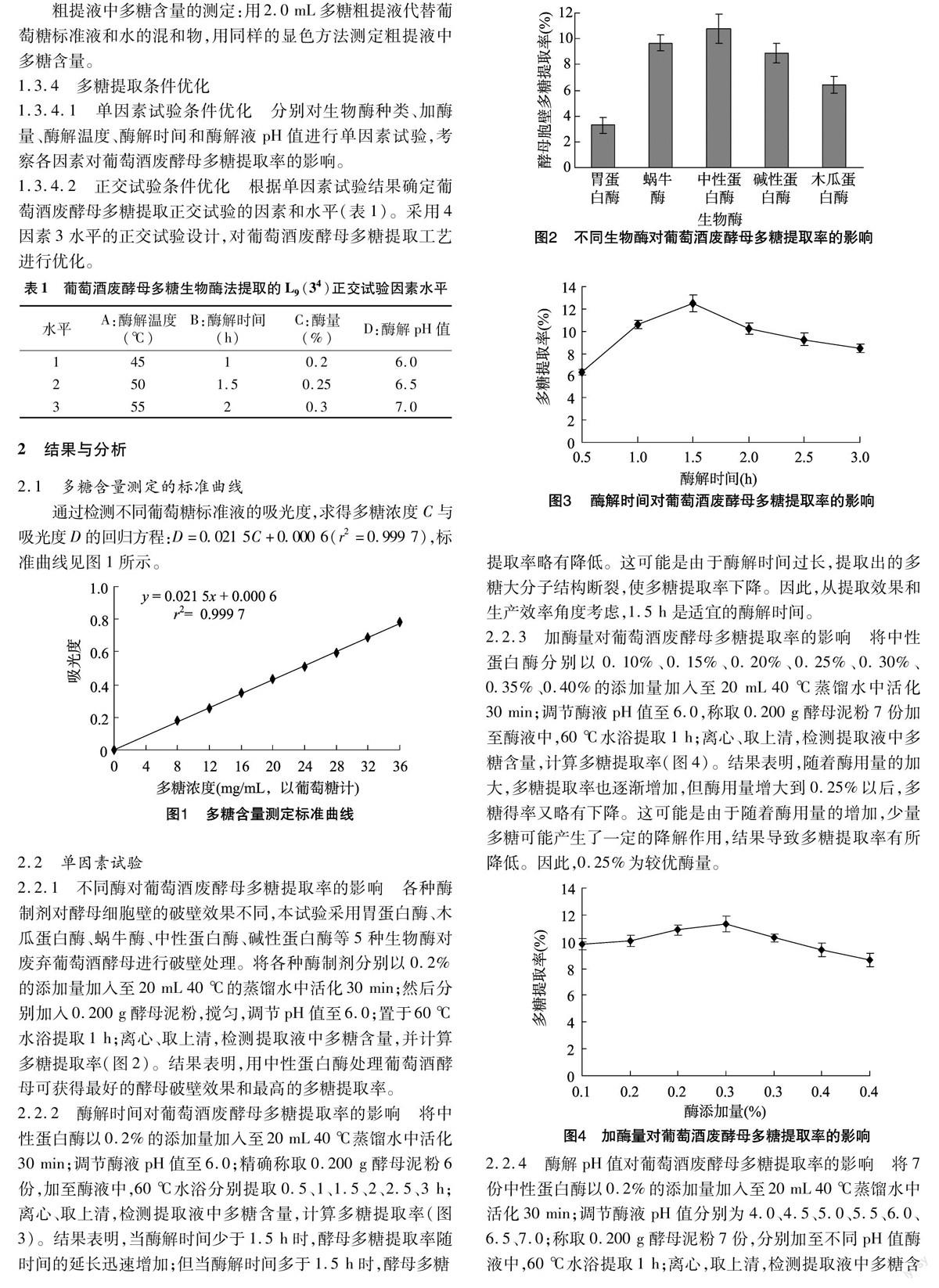
2.2.1 不同酶对葡萄酒废酵母多糖提取率的影响 各种酶制剂对酵母细胞壁的破壁效果不同,本试验采用胃蛋白酶、木瓜蛋白酶、蜗牛酶、中性蛋白酶、碱性蛋白酶等5种生物酶对废弃葡萄酒酵母进行破壁处理。将各种酶制剂分别以0.2%的添加量加入至20 mL 40 ℃的蒸馏水中活化30 min;然后分别加入0.200 g酵母泥粉,搅匀,调节pH值至6.0;置于60 ℃水浴提取1 h;离心、取上清,检测提取液中多糖含量,并计算多糖提取率(图2)。结果表明,用中性蛋白酶处理葡萄酒酵母可获得最好的酵母破壁效果和最高的多糖提取率。
2.2.2 酶解时间对葡萄酒废酵母多糖提取率的影响 将中性蛋白酶以0.2%的添加量加入至20 mL 40 ℃蒸馏水中活化30 min;调节酶液pH值至6.0;精确称取0.200 g酵母泥粉6份,加至酶液中,60 ℃水浴分别提取0.5、1、1.5、2、2.5、3 h;离心、取上清,检测提取液中多糖含量,计算多糖提取率(图3)。结果表明,当酶解时间少于1.5 h时,酵母多糖提取率随时间的延长迅速增加;但当酶解时间多于1.5 h时,酵母多糖
提取率略有降低。这可能是由于酶解时间过长,提取出的多糖大分子结构断裂,使多糖提取率下降。因此,从提取效果和生产效率角度考虑,1.5 h是适宜的酶解时间。
2.2.3 加酶量对葡萄酒废酵母多糖提取率的影响 将中性蛋白酶分别以0.10%、0.15%、0.20%、0.25%、0.30%、035%、0.40%的添加量加入至20 mL 40 ℃蒸馏水中活化 30 min;调节酶液pH值至6.0,称取0.200 g酵母泥粉7份加至酶液中,60 ℃水浴提取1 h;离心、取上清,检测提取液中多糖含量,计算多糖提取率(图4)。结果表明,随着酶用量的加大,多糖提取率也逐渐增加,但酶用量增大到0.25%以后,多糖得率又略有下降。这可能是由于随着酶用量的增加,少量多糖可能产生了一定的降解作用,结果导致多糖提取率有所降低。因此,0.25%为较优酶量。
2.2.4 酶解pH值对葡萄酒废酵母多糖提取率的影响 将7份中性蛋白酶以0.2%的添加量加入至20 mL 40 ℃蒸馏水中活化30 min;调节酶液pH值分别为4.0、4.5、5.0、5.5、60、6.5、7.0;称取0.200 g酵母泥粉7份,分别加至不同pH值酶液中,60 ℃水浴提取1 h;离心,取上清,检测提取液中多糖含量,计算多糖提取率(图5)。结果表明,酶液pH值对多糖提取效果影响很大,在pH值从4.0升高到6.5时,多糖提取率达到最高(11.58%),随后随着pH值的升高,多糖提取率开始下降。因此,中性蛋白酶液pH值为6.5时,多糖提取效果最好,此时可能中性蛋白酶活性最高。
2.2.5 酶解温度对葡萄酒废酵母多糖提取率的影响 将中性蛋白酶以0.2%的添加量,加入至20 mL 40 ℃蒸馏水中活化30 min;调节酶液pH值至6.0;精确称取0.200 g酵母泥粉5份,加至酶液中,分别于40、45、50、55、60 ℃水浴提取1 h;离心、取上清,检测提取液中多糖含量,计算多糖提取率(图6)。结果表明,酶解温度对葡萄酒废酵母的多糖提取率影响较大。随着温度从40 ℃逐渐升高到50 ℃,多糖的提取率逐渐增加,其中在50 ℃时多糖提取率最高,为12.89%。这可能是因为在一定范围内温度的升高有助于提高中性蛋白酶的活性,进而促进酵母细胞壁的酶解和多糖的释放。但当温度继续升高时,过高的温度降低了酶的活性,导致多糖提取率下降。因此,50 ℃是适宜的酶解温度。
2.3 正交试验优化
在单因素试验结果基础上,采用L9(34)正交试验设计对葡萄酒废酵母多糖提取工艺条件进行优化。结果(表2)发现,以葡萄酒废酵母多糖提取率为指标,确定多糖最佳生物酶解提取工艺条件为中性蛋白酶加酶量0.3%、酶解温度 50 ℃、pH值6.0、酶解时间1.5 h,此条件下葡萄酒酵母泥多糖得率为 13.67%。此外极差分析发现,各因素对葡萄酒废酵母多糖提取率的影响程度依次为酶解温度>酶解时间>pH值>酶量,即酶解温度对多糖提取率的影响最大,其次为酶解时间,而加酶量和酶液pH值的影响较小。
3 结论
葡萄酒废酵母细胞壁中含有丰富的多糖组分,本研究采用单因素和正交试验设计对葡萄酒废酵母胞壁多糖的生物酶法提取工艺进行优化,最终确定最佳提取工艺条件为中性蛋白酶加酶量0.3%、酶解温度50 ℃、pH值6.0、酶解时间 1.5 h,此工艺条件下葡萄酒废酵母多糖提取率可达13.67%。该提取方法操作简便、多糖提取率高,具有实际应用价值。本研究结果为葡萄酒生产中废弃物的资源化再利用提供重要参考。
参考文献:
[1]杜 娜,杨学山,韩舜愈,等. 葡萄酒泥酵母超氧化物歧化酶分离提取工艺条件优化[J]. 食品工业科技,2013,34(15):242-245.
[2]郭永亮,樊 玺. 酵母多糖在葡萄酒酿造中的应用探索[J]. 中外葡萄与葡萄酒,2012(2):48-52.
[3]赵 季,任俊琦,卢彩霞,等. 酵母细胞壁多糖的研究进展[J]. 中国食品添加剂,2009(1):82-85.
[4]田春华,竹 磊,朱海华,等. 啤酒酵母泥中酵母多糖提取工艺研究[J]. 江西农业学报,2010,22(7):103-104,110.
[5]張丽霞,于文革,张丽萍. 微波辅助法提取啤酒废酵母多糖的工艺研究[J]. 大庆师范学院学报,2011,31(3):121-124.
[6]游庆红,尹秀莲. 响应面法优化酶辅助提取啤酒酵母多糖工艺[J]. 食品科技,2012,37(7):191-195.
[7]边洪荣,张庆波,史相国,等. 啤酒酵母多糖提取方法的研究[J]. 中国煤炭工业医学杂志,2009,12(5):795-797.
[8]马 森,卢家炯,初兰娜,等. 超声波辅助提取啤酒废酵母中活性成分的研究[J]. 四川食品与发酵,2008,44(6):10-13.
[9]屈慧鸽,于小飞,张玉香,等. 白葡萄酒废酵母蛋白及多糖的提取工艺研究[J]. 食品科学,2007,28(9):315-318.
[10]胡云峰,陈君然,胡晗艳,等. 超声波破壁提取葡萄酒酵母泥中多糖的研究[J]. 食品安全质量检测学报,2013,4(6):1715-1720.
[11]周桃英,陈年友,陈中建,等. 超声波-微波协同法提取黄精多糖工艺研究[J]. 江苏农业科学,2013,41(6):231-233.
[12]彭支莲,张 丹,李业洪,等. 正交法优选续断中绿原酸的提取工艺[J]. 江苏农业科学,2013,41(7):269-270.
[13]李 聪,朱晓吉. 超声破碎酵母细胞提取蔗糖酶条件优化[J]. 江苏农业科学,2014,42(4):237-239.

