低温甲醇合成研究进展
石磊,张婉莹,王玉鑫, Tsubaki Noritatsu
(1 沈阳化工大学应用化学学院,辽宁 沈阳 110142;2Department of Applied Chemistry, School of Engineering, University of Toyama, Gofuku 3190, Toyama, 930-8555, Japan)
引 言
甲醇作为大宗的化工原料,广泛应用于化学和能源工业中[1]。同时,它也是一种重要的燃料,应用于改进后的甲醇内燃机[2]或者甲醇燃料电池[3]。近些年,使用分子筛催化剂,甲醇制烯烃(乙烯和丙烯)和芳烃等技术引起了广泛的关注。目前,世界上甲醇每年的产量约为5000 万吨,主要采用ICI公司开发的工艺路线[4],使用Cu/ZnO/Al2O3催化剂,由合成气(CO/CO2/H2)在高温和高压(523~573 K, 5~10 MPa)条件下合成。
文献[5]系统地综述了常规甲醇合成反应的热力学、动力学影响,合成机理,反应活性中心以及催化剂研究进展等。2012年,Behrens 等[4]通过实验以及原位表征结果,结合密度泛函理论计算,系统地阐述了甲醇合成反应过程中工业Cu/ZnO/Al2O3催化剂的催化原理,明确了反应活性中心,并描述了活性中心Cu 和Zn 原子之间的掺杂构型。
通过热力学计算得出甲醇合成反应效率明显受反应温度影响,因为该反应为强放热反应,低温对反应有利,可以显著提高原料CO 的转化率。工业上,合成气中CO 一步转化率仅为14%,而且当温度低于473 K 时,CO 转化率接近为0。因此,开发低温甲醇合成反应路径具有重大的现实意义。
本文介绍了一种全新的低温甲醇合成反应路径。该路径以含有CO2的合成气为反应原料,采用单一低碳醇同时作为催化剂和溶剂,实现了CO 在低温(443 K)条件下,一步转化率达到70%~100%。在甲醇合成反应过程中,醇溶剂起到传热、取热和催化的三重协同效应。并考察了溶剂种类、溶剂量、反应时间、反应原料种类对反应活性及甲醇选择性的影响。应用原位红外光谱表征手段,通过观测催化剂表面吸附的反应中间产物,证明了所提出的反应路径的正确性。同时,还介绍了最新的金属Cu/ZnO 催化剂制备方法的研究进展。全新的溶胶-凝胶-燃烧法、固相研磨-燃烧法以及甲酸辅助燃烧法直接制备高活性、纳米尺度、高分散的金属Cu/ZnO 催化剂,而不需要额外的还原流程。
1 全新的低温甲醇合成路径
由日本学者Tsubaki 等[6-7]开创的以低碳醇作为溶剂和催化剂的全新的低温甲醇合成反应路径主要包含如下几个步骤

此反应中,所使用的铜基催化剂的活性中心是金属铜和一价铜离子。ROH 代表所使用的溶剂醇,可以是乙醇、正丙醇、2-丙醇、丁醇等,在反应过程中循环消耗并不断生成。HCOOR 代表不同醇溶剂生成的相对应的酯。CO2和H2O 既是反应副产物,又是反应原料,在反应过程中循环使用。在上述反应的主要步骤中,由于醇溶剂中含有少量的H2O,在铜基催化剂的作用下,极易发生水煤气(WGS)变换反应。同时,在铜基催化剂的表面生成了HCOOCu。生成的HCOOCu 可以和多种醇在弱酸或者弱碱存在温和条件下,发生酯化反应,生成相对应的酯和CuOH。工业生产中,上述步骤(4)(酯加氢反应)在低温、铜基催化剂作用下极易发生,反应温度仅为453 K,生成甲醇和相对应的溶剂醇。所以,理论上发生上述低温甲醇合成路径的几个关键反应步骤,在动力学和热力学上均十分容易进行。在整个反应过程中,醇溶剂主要起到两个作用:作为溶剂,起到传热和取热的作用;作为催化剂,和反应的中间产物HCOOCu 发生酯化反应,降低了HCOOCu 直接一步加氢反应的活化能。如果加入的低碳醇溶剂是甲醇,那么该反应将没有任何需分离的溶剂存在。
2 溶剂乙醇量、反应时间、不同原料气组成和醇溶剂种类的影响
为了验证提出的全新低温甲醇合成路径的正确性,采用浆态床反应器,ICI 公司的Cu/ZnO 和自制的Cu/Al2O3混合催化剂0.2 g,并以乙醇和正己烷的混合溶液5 ml 为反应溶剂,在423 K,3.0 MPa条件下反应2 h。产物经气相色谱检测,仅有甲醇和甲酸乙酯生成[6-9]。CO 转化率和产物收率随溶剂中乙醇的比例变化如图1 所示。当溶剂仅使用正己烷时,合成气并不发生反应,完全没有甲醇和甲酸乙酯生成。可见,在423 K,没有乙醇参与的前提下(仅有正己烷溶剂),该反应无法进行。说明当反应温度低于423 K 时,催化剂表面生成的甲酸盐不能直接发生加氢反应。但是随着溶剂中不同含量的乙醇加入,合成气的转化率以及甲醇和甲酸乙酯的收率逐步增加。如果仅用乙醇作为反应溶剂,产物中甲醇的选择性达到最高。以上实验结果充分表明了乙醇存在的必要性,它使得反应路线从商业化的ICI过程[图2(a)]变为设计的新路线[图2(b)],使含有CO2的合成气在低温条件下能够发生反应,高选择性地生成甲醇。这里,乙醇即作为溶剂又作为催化剂参与反应,因为实验结果证明全部反应完成后乙醇的量没有减少。
文献[7]研究了在443 K 以及其他反应条件不变的前提下,反应时间对总碳转化率和甲醇收率的影响。随着反应时间的增加,转化率(从2 h 时2.1%上升至20 h 时19.0%)和甲醇收率都直线上升。然而,在反应过程中,甲酸乙酯的收率(稳定在1.1%)几乎是不变的。这表明实际发生的低温甲醇合成过程是按照设计的步骤进行的。首先,甲酸乙酯是在步骤(3)发生酯化反应时生成的中间产物,然后 在步骤(4)发生加氢反应时被消耗。同时,文献[6-7]报道的423 K 时,CO 转化率和产物选择性之间关系的数据进一步证明了上述的观点。在低转化率时,甲酸乙酯是主要产物,然而,当合成气转化率提高时,过剩的甲酸乙酯加氢生成甲醇,这就完成了一个典型的循环反应流程。

图1 醇溶剂量对低温甲醇合成反应的影响Fig.1 Effect of coexisting alcohols

图2 醇溶剂的加入改变甲醇合成从高温ICI 过程(a)到 全新的低温甲醇合成流程(b)Fig.2 Changing reaction course from high-temperature ICI process (a) to new low-temperature route (b) by addition of alcohol
同时,系统地研究了当使用乙醇作为溶剂时,不同组成的反应气[6]对反应结果的影响。随着合成气中CO2含量的增加(从0 增加至7.5%),总碳转化效率逐渐提升,纯CO2加氢表现出了最高的反应速率。当仅使用CO 和H2作反应气时,产物中只检测到了甲酸乙酯,并没有甲醇形成。如果反应物中有少量的水参与,那么CO2可以通过水气变换生成,则有甲醇生成。如果只使用纯CO作为反应原料,在423 K 时反应不能进行,产物中只检测到溶剂乙醇,说明在这个条件下将乙醇直接羰基化为酯是不可能的。如上反应结果充分地证明了以CO2与H2合成甲醇比以CO 与H2合成甲醇反应速率更快。同时,证明了反应步骤(1)发生的合理性。
除了乙醇溶剂,多种醇[8-9]都被作为低温甲醇合成的溶剂和催化剂。系统的研究结果如表1 所示,考察了5 个1-醇和3 个2-醇对低温甲醇合成反应效率的影响,发现总碳转化率随着碳数的增加而减少。相同碳原子数的2-醇比1-醇具有更高的反应活性。但是,当异丁醇、叔丁醇或者环戊醇等具有较大空间位阻的醇作为反应溶剂时,甲醇合成效率明显降低;当使用乙二醇和苯甲醇作为反应溶剂时,检测不到任何产物生成。在所有醇溶剂中,2-丙醇表现出最佳的反应活性。使用醇溶剂,气相色谱检测到的液相产物仅有甲醇和所使用的溶剂与甲醇生成的相对应的酯。1-醇溶剂表现出较高的甲醇选择性和收率,而2-醇溶剂表现出较高的酯选择性和收率。当1-醇的碳数超过3 时,产物中仅有甲醇,没有酯生成。

表1 多种醇溶剂对甲醇合成反应的影响Table 1 Effects of alcohols on synthesis of methanol

图3 低温甲醇合成连续反应中CO、CO2 和 总碳转换率随时间的变化Fig.3 Variations of CO, CO2 and total carbon conversions with time on stream for continuous low-temperature methanol synthesis (temperature,443 K; pressure, 5.0 MPa, catalysts mass, 3.0 g; 2-butand, 20 ml; flow rate, 20 ml·min-1)
随后,Tsubaki 等[10-12]考察了Cu/ZnO 催化剂在不同醇溶剂中对连续低温甲醇合成反应的影响。对于所有类型的醇溶剂,Cu/ZnO 催化剂均表现出较好的甲醇选择性,高达98%~100%。其中,使用2-丁醇作溶剂时,表现出最佳的催化效果,总碳转化率为47.0%,甲醇的选择性为98.9%。图3 为连续 反应过程中,采用2-丁醇溶剂,反应活性随时间的变化。在反应的初始阶段,由于大量的反应原料气充满高压反应釜和冷井,所以图中所显示的总碳转化率远低于实际反应转化率。随着反应的进行,12 h后,总碳转化率趋于稳定,CO 的转化率最高可以达到60%,但是CO2转化率为-8%,CO 与CO2总的碳转化率大约为47%。在反应的初始阶段,CO2的转化率为负值,说明了反应原料中部分CO 通过发生水煤气变换反应,生成了CO2。在最初的5 h内,CO2的转化率由-29%上升到-8%。考虑到反应初始阶段,高压反应釜和冷井中反应原料气的稀释作用,即使原料气中绝对CO2浓度是有限的,但反应初始阶段实际CO2的生成速率也远大于消耗速率。
3 低温甲醇合成反应机理和动力学研究
通过傅里叶变换红外光谱(FT-IR)观测低温甲醇合成反应过程中,催化剂表面吸附的中间产物官能团的变化,进而推断出反应机理。由于需要观测多个特征官能团随着反应时间及反应条件的变化过程。很难以单一或者几个红外谱图描述清楚这一过程。在本文中将不添加任何红外谱图,之前的研究[13-14]中有详细的红外谱图报道。采用乙醇作为反应溶剂和催化剂。首先,在443 K、0.1 MPa 条件下,Cu/ZnO 催化剂暴露在流动的CO/CO2/H2合成气气氛中3 h,然后经过He 吹扫20 min(He 气吹扫的目的是最大限度地排除气相产物的官能团对红外观测的影响),记录红外谱图。为了鉴别气相官能团对催化剂表面吸附的FI-TR 的影响,采用石英砂代替催化剂,此时得到的FT-IR 为参照谱图。通过已知有机物官能团的FT-IR 和文献中已报道的FT-IR 来鉴别Cu/ZnO 催化剂表面的吸附的官能团种类。随后,使吸附合成气的Cu/ZnO 催化剂暴露在常压下氢气氛围中,并逐步升高反应温度从443 K 至573 K。当反应温度低于493 K 时,HCOO—Zn 和HCOO—Cu 键的红外吸收峰强度没有明显改变,但是,当温度从523K 上升至573 K 时,红外谱图中基本观测不到甲酸盐的峰。这些实验结果充分证明了当反应温度低于493 K,且没有乙醇溶剂存在的条件下,甲酸盐不能发生加氢反应。如果在443 K、0.1 MPa 条件下,向原位红外池中通入饱和的乙醇蒸气(298 K),Cu/ZnO 催化剂表面生成的甲酸盐(HCOO—Zn 和HCOO—Cu)的峰完全消失。该现象说明气相的乙醇能够在低温(443 K)条件下与甲酸盐发生反应。同时,红外谱图观测到乙氧基、乙酰基和属于碳酸盐物种的官能团。为了排除气相和催化剂表面吸附的甲酸乙酯对观测结果的影响。在相同的实验条件下,与吸附在催化剂表面纯的甲酸乙酯参比。随着反应压力的逐步提高从0.1 MPa 经0.3 MPa 到1.0 MPa,归属于乙酰基和碳酸盐物种的红外官能团逐渐消失。在高压条件下,生成大量的乙氧基吸附物种。该实验现象表明甲酸盐物种可以和气相乙醇快速发生反应,但是却不能和吸附的乙氧基物种发生反应。
采用相同的FI-IR 观测手段观察以2-丙醇[15]作为反应溶剂或Cu/MgO[16]作为催化剂时,催化剂表面红外谱图的变化,进而给出低温甲醇合成反应机理,如图4 所示。

图4 所提出的低温甲醇合成反应机理(M 代表Cu/ZnO)Fig.4 Proposed mechanism for low-temperature methanol synthesis
首先,合成气吸附在催化剂表面,生成甲酸盐物种。随后,吸附的甲酸盐物种与气相乙醇发生酯化反应,生成反应的中间产物甲酸乙酯。该反应是一个典型的亲核加成-消去反应,其中含有孤对电子氧的乙醇溶剂作为反应的亲核试剂。其发生亲核反应的过程如图5 所示。气相中以及催化剂表面物理吸附的甲酸乙酯,在零价铜原子表面,与氢气发生酯加氢反应,生成产物甲醇和溶剂乙醇。通过已推断出的低温甲醇合成反应机理,不同醇溶剂与甲酸盐物种发生的酯化反应为该反应的关键。不同醇溶剂中氧孤对电子云的密度和醇分子本身的空间位阻将明显影响亲核加成的效率。由于甲基的供电子效应,含有支链的醇溶剂中的氧具有较高的电子云密度,更易攻击甲酸盐中的碳原子。同时,具有线形,低空间位阻的溶剂醇更容易与甲酸盐物种发生酯化 反应。而低碳仲醇兼具较低的空间位阻和较高的氧电子云密度,因此,在低温甲醇合成过程中,表现出较高的亲核加成效率。
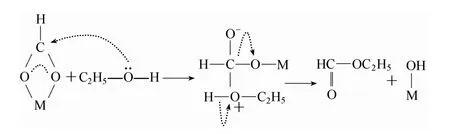
图5 亲核反应过程Fig.5 Nucleophilic reaction process
以傅里叶变换红外光谱表征手段为基础,通过观测特征官能团峰面积变化率,来研究不同醇溶剂和催化剂对低温甲醇合成反应过程中动力学因素的影响[17-19]。该反应由两个主要速率控制步骤:一个是生成甲酸乙酯,另一个是甲酸乙酯发生加氢反应。分别以甲酸盐物种(HCOOCu 和HCOOZn)和醇溶剂的反应来研究甲酸乙酯生成的动力学特征。由于反应过程中,使用的醇溶剂量远大于反应原料甲酸盐物种的量,所以对于整个反应过程,甲酸盐物种在动力学上符合一级反应速率公式。因此,甲酸盐物种与醇类反应速率表达式如下

式中,k1、k2代表的是反应速率常量,C(HCOOCu)和C(HCOOZn)是HCOOCu 和HCOOZn 在催化剂表面的浓度,完全正比于FT-IR 中特征官能团的峰面积。以反应接触时间t 为横坐标,ln(C0/C)的变化为纵坐标。C0/C 的值与A0/A 值相关,其中A0代表HCOOCu或HCOOZn 初始红外峰面积,A 代表接触t 时间后官能团的红外峰面积,然后,可以很容易地计算出反应速率常数k。HCOOCu 与乙醇反应的速率常数是0.44 min-1,与2-丙醇反应的速率常数是0.95 min-1;HCOOZn 与乙醇反应的速率常数是0.38 min-1,与2-丙醇反应的速率常数是0.94 min-1。动力学计算结果表明2-丙醇与甲酸盐发生反应的数率常数远大于乙醇与甲酸盐反应的速率常数。因此,当2-丙醇作为溶剂时,催化剂表面生成甲酸盐物种与之反应速率更快,反应活性更高。
对于甲酸乙酯的加氢反应过程,由于原位池中有大量的高压氢气,所以对于反应原料甲酸乙酯,动力学上也符合一级反应模型。因此,甲酸乙酯的加氢反应速率表达式如下

式中,k3是反应速率常量,P(HCOOR)表示气相组分中甲酸乙酯的分压,它与气相产物中甲酸乙酯的红外峰面积呈正比关系。根据气相甲酸乙酯的傅里叶变换红外光谱的峰面积,可以用与求k1、k2相似的方法计算出k3。甲酸乙酯加氢反应速率常数是0.18 min-1,甲酸2-丙酯的反应速率常数是0.21 min-1。显然,无论是甲酸2-丙酯的生成速率还是加氢速率均比甲酸乙酯快。因此,在443 K,Cu/ZnO催化剂,使用2-丙醇作为催化剂和溶剂的低温甲醇合成反应比乙醇更容易进行,这与实验反应得到的结果完全一致。
4 适用于低温甲醇合成反应的催化剂研究进展
以醋酸铜和醋酸锌为前驱体,采用溶胶-凝胶法制备介孔的Cu/ZnO 催化剂[20]。采用共沉淀方法[21]制备Cu/Zn/Al2O3催化剂,考察了沉淀剂的种类、催化剂前驱体焙烧和还原条件[21]以及铜基催化剂钝化现象[22],对低温甲醇合成反应活性和甲醇选择性的影响。
结合低温甲醇合成反应机理,采用均相HCOOK 和非均相Cu/MgO 固体二元催化剂[23-24]在423~443 K,3.0~5.0 MPa 条件下,考察二元催化体系对合成气总碳转化率和甲醇选择性的影响。在5.0 MPa,423 K,合成气与催化剂接触时间为100 g·h·mol-1时,总碳转化率可以达到91%,甲醇选择性为99%。反应过程中,加入的HCOOK 能够显著地提高酯化反应速率,同时,CO2与KOH 反应得到KHCO3,KHCO3又可以通过加氢反应,生成HCOOK。
最近,报道了一种全新的溶胶-凝胶-燃烧法[25-27]和固相研磨法[28-29]直接制备一系列纳米尺度、免还原、高分散的金属Cu/ZnO 催化剂。整个催化剂的制备流程非常简单,可直接得到金属Cu/ZnO 催化剂,而不需要额外的还原,因此节省了还原装置的花费以及能源的消耗。
采用热重-差热分析仪器结合质谱分析催化剂前驱体在惰性气氛中的还原过程,如图6 所示。

图6 催化剂前驱体在惰性气氛中分解的热重-差热图Fig.6 TG-DTA analysis of the catalyst precursor burnt in argon
在493 K 时,差热图有一个尖锐的放热峰,同时热重图有明显的失重,这表明催化剂前驱体发生剧烈的氧化-还原反应,在此过程中,含有羧基的柠檬酸作为螯合剂和还原剂,硝酸盐中的硝基和二价的铜离子作为氧化剂。质谱检测到该过程有大量的气体放出,如H2、CH4、NO、CO2、NH3和NO2。其中,CH4和H2作为原位的还原剂能够还原螯合物 中二价的铜离子,生成金属铜单质。整个还原过程主要分为3 步:(1)在483 K 时,柠檬酸开始逐步分解,释放出CH4和H2;(2)在493 K 时,CH4,H2和NO-3发生剧烈的氧化-还原反应;(3)剩余的CH4、H2和配合物中的Cu2+发生还原反应,生成金属Cu 单质。图6 中从650 到800 K 宽的放热峰为配合物中剩余有机物的高温热解峰。采用氢气程序升温还原法(TPR)来表征惰性气氛中焙烧后的催化剂,发现没有氢气消耗峰出现,说明所制备的催化剂中的二价或者一价铜离子在焙烧的过程中被完全还原为金属铜单质。
采用X 射线衍射的方法(XRD)分析惰性气氛中焙烧后的催化剂,比较未经氢气还原和经氢气还原后晶型的区别以及采用固相研磨和溶胶-凝胶-燃烧法制备的催化剂Cu 晶粒大小的区别。如图7 所示,所有催化剂的特征峰均为金属铜和氧化锌。曲线a 为固相研磨法[27]制备的催化剂前驱体在523 K,氩气气氛中焙烧1 h 后XRD 图;曲线b 为固相研磨法[27]制备的催化剂前驱体在673 K,氩气气氛中焙烧3 h 后XRD 图;曲线c 为催化剂b 经过额外的5%氢气,523 K 还原10 h 后的XRD 图;曲线d 为采用溶胶-凝胶-燃烧法制备的催化剂前驱体在673 K 氩气气氛中焙烧3 h 后XRD 图。从图7 中,可以清楚地观察到样品b 和c 的XRD 图基本没有区别,进一步说明催化剂前驱体在惰性气氛中焙烧的过程中,二价的铜离子全部还原为金属铜单质。

图7 前驱体惰性气氛中焙烧后的XRD 图Fig.7 XRD patterns of burnt catalysts
但是,采用溶胶-凝胶-燃烧法所制备的金属Cu/ZnO 催化剂中有部分无定形碳和有机物剩余,显著地影响甲醇的选择性;而且在焙烧的过程中,由于有大量的硝酸根离子作为强氧化剂参与,导致燃烧过程非常剧烈,不可避免地使得还原后的金属铜单质发生团聚,分散度降低,降低了反应活性。为了消除硝酸根离子的影响,提出了全新的固相研磨法[28],该方法不但没有水的参与,并且完全没有废水产生,因此是环境友好的。在研磨的过程中,部分硝酸根离子与含有羧基的柠檬酸发生氧化-还原反应,释放出少量氮氧化合物,这就使螯合后的前驱体中硝酸根离子的含量明显降低,焙烧过程相对温和。与溶胶-凝胶-燃烧法制备的Cu/ZnO 催化剂相比,甲醇的收率明显提高(从6.4%提高至19.2%)。
但是,该方法仍然不能完全消除催化剂中剩余有机物对甲醇选择性的影响。之后的研究提出了甲酸辅助固相研磨法[29]一步制备金属Cu/ZnO 催化剂和纯金属(Co、Ni 和Ag)。由于甲酸是最简单的有机物,高温极易分解,所以制备的金属催化剂中无任何含碳有机物及无定形碳剩余。当研磨后生成的金属-甲酸螯合物前驱体在氩气条件下焙烧过程中,逐步释放出氢气和一氧化碳。在523 K 条件下,氢气和一氧化碳就能作为还原剂把二价铜离子从螯合物中还原为金属铜单质。XRD、EDS、TPR、XPS等多种表征手段充分证明了所制备的催化剂为金 属Cu 和ZnO,无任何杂质存在。所制备的Cu/ZnO催化剂直接用于低温甲醇合成反应,而不经过额外的还原。相比较常规固相研磨法制备的还原后的催化剂,这种新方法制备的催化剂表现出较高的活性以及甲醇选择性。图8 为所制备Cu/ZnO 催化剂的高清TEM 图。该图充分说明甲酸辅助固相研磨法所制备的Cu/ZnO 催化剂与工业还原后的Cu/ZnO催化剂一致,具有典型的金属Cu 与ZnO 相互作用的微结构。
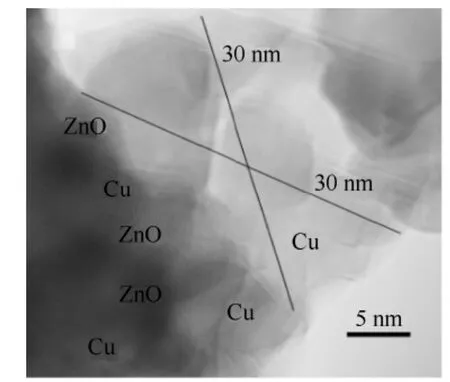
图8 甲酸辅助研磨法制备的Cu/ZnO 催化剂高清TEM 图Fig.8 HRTEM analysis of catalyst prepared by formic acid assisted solid-state synthesis method
5 结 论
本文介绍了一种全新的低温甲醇合成方法,该方法以含有二氧化碳的不同组分的合成气为反应原料,各种单一低碳醇(包括甲醇)同时作为催化剂和溶剂,实现了一氧化碳在低温(443 K)条件下,高转化率、高选择性生成甲醇。并采用原位FTIR 表征手段系统地研究了低温甲醇合成反应机理以及不同醇溶剂的动力学影响因素。该反应能够在低温条件下进行,是由于催化剂上吸附的甲酸盐物种可以与多种醇溶剂在低温条件发生酯化反应,生成相对应的甲酸酯。生成的甲酸酯又可以在低温条件下发生加氢反应,生成甲醇和额外加入的溶剂醇,克服了常规甲醇合成过程中,甲酸盐必须在高温条件下才能发生加氢反应的关键步骤。同时,还介绍了适用于该低温甲醇合成反应的铜基催化剂制备方法。并重点介绍了全新的纳米尺度、免还原、高分散的金属Cu/ZnO 催化剂的制备方法和改进方法,当金属前驱体在惰性气氛下分解过程中,逐步释放出还原性气体作为原位还原剂,能够把二价铜离子从螯合物中还原为高分散的金属铜单质。
符 号 说 明
A ——时间 t 时吸附在催化剂表面的HCOOCu 或HCOOZn 特征峰面积
A0——初始吸附在催化剂表面的HCOOCu或HCOOZn 特征峰面积
C(HCOOCu),C(HCOOZn)——分别为吸附在催化剂表面的HCOOCu 和HCOOZn 浓度
k1,k2,k3——反应速率常数
P(HCOOR)——气相中甲酸乙酯的分压
[1]Olah G A, Goeppert A, Surya Prakash G K.Beyond Oil and Gas: The Methanol Economy [M].Weinheim:Wiley-VCH, 2006.
[2]Breen J P, Ross J R H.Methanol reforming for fuel-cell applications:development of zirconia-containing Cu-Zn-Al catalysts [J].Catal.Today, 1999, 51: 521-533.
[3]Liu H S, Song C J, Zhang L, Zhang J J, Wang H J, Wilkinson D P.A review of anode catalysis in the direct methanol fuel cell [J].J.Power Sources, 2006, 155: 95-110.
[4]Behrens M, Studt F, Kasatkin I, Kühl S, Hävecker M, Pedersen F A, Zander S, Girgsdies F, Kurr P, Kniep B L, Tovar M, Fischer R W, Nørskov J K, Schlögl R.The active site of methanol synthesis over Cu/ZnO/Al2O3industrial catalysts [J].Science, 2012, 336: 893-897.
[5]Ertl G, Knözinger H, Schüth F, Weitkamp J.Handbook of Heterogeneous Catalysis[M].Weinheim: Wiley-VCH, 2008: 2920-2949.
[6]Tsubaki N, Ito M, Fujimoto K.A new method of low-temperature methanol synthesis [J].J.Catal., 2001, 197: 224-227.
[7]Fan L, Sakaiya Y, Fujimoto K.Low-temperature methanol synthesis from carbon dioxide and hydrogen via formic ester [J].Appl.Catal., A: Gen., 1999, 180: L11-L13.
[8]Zeng J Q, Fujimoto K, Tsubaki N.A new low-temperature synthesis route of methanol: catalytic effect of the alcoholic solvent [J].Energy Fuels, 2002, 16: 83-86.
[9]Zeng J Q, Tsubaki N, Fujimoto K.The promoting effect of alcohols in a new process of low-temperature synthesis of methanol from CO/CO2/H2[J].Fuel, 2002, 81: 125-127.
[10]Reubroycharoen P, Vitidsant T, Yoneyama Y, Tsubaki N.Development of a new low-temperature methanol synthesis process [J].Catal.Today, 2004, 89: 447-454.
[11]Tsubaki N, Zeng J Q, Yoneyama Y, Fujimoto K.Continuous synthesis process of methanol at low temperature from syngas using alcohol promoters [J].Catal.Commun., 2001, 2: 213-217.
[12]Reubroycharoen P, Yamagami T, Vitidsant T, Yoneyama Y, Ito M, Tsubaki N.Continuous low-temperature methanol synthesis from syngas using alcohol promoters [J].Energy Fuels, 2003, 17: 817-821.
[13]Yang R Q, Fu Y L, Zhang Y, Tsubaki N.In situ DRIFT study of low-temperature methanol synthesis mechanism on Cu/ZnO catalysts from CO2-containing syngas using ethanol promoter [J].J.Catal., 2004, 228: 23-35.
[14]Yang R Q, Fu Y L, Zhang Y, Xu B L, Tsubaki N.In-situ DRIFT study of a new low-temperature methanol synthesis mechanism [J].Bull.Chem.Soc.Jpn., 2005, 78: 135-137.
[15]Yang R Q, Zhang Y, Tsubaki N.Dual catalysis mechanism of alcohol solvent and Cu catalyst for a new methanol synthesis method [J].Catal.Commun., 2005, 6: 275-279.
[16]Yang R Q, Zhang Y, Iwama Y, Tsubaki N.Mechanistic study of a new low-temperature methanol synthesis on Cu/MgO catalysts [J].Appl.Catal.A: Gen., 2005, 288: 126-133.
[17]Yang R Q, Zhang Y, Tsubaki N.Spectroscopic and kinetic analysis of a new low-temperature methanol synthesis reaction [J].Catal.Lett., 2006, 106: 153-159
[18]Yang R Q, Zhang Y, Tsubaki N.Rideal-type reaction of formate species with alcohol: a key step in new low-temperature methanol synthesis method [J].Catal.Commun., 2007, 8: 1829-1833.
[19]Zhang Y, Yang R Q, Tsubaki N.A new low-temperature methanol synthesis method: mechanistic and kinetics study of catalytic process [J].Catal.Today, 2008, 132: 93-100.
[20]Bao J, Liu Z L, Zhang Y, Tsubaki N.Preparation of mesoporous Cu/ZnO catalyst and its application in low-temperature methanol synthesis [J].Catal.Commun., 2008, 9: 913-918.
[21]Yang R Q, Yu X C, Zhang Y, Li W Z, Tsubaki N.A new method of low-temperature methanol synthesis on Cu/ZnO/Al2O3catalysts from CO/CO2/H2[J].Fuel, 2008, 87: 443-450.
[22]Zhai X F, Shamoto J, Xie H J, Tan Y S, Han Y Z, Tsubaki N.Study on the deactivation phenomena of Cu-based catalyst for methanol synthesis in slurry phase [J].Fuel, 2008, 87: 430-434.
[23]Zhao T S, Yoneyama Y, Fujimoto K, Yamane N, Fujimoto K, Tsubaki N.Promotional effect of potassium salt in low-temperature formate and methanol synthesis from CO/CO2/H2on copper catalyst [J].Chem.Lett., 2007, 36: 734-735.
[24]Zhao T S, Zhang K, Chen X R, Ma Q X, Tsubaki N.A novel low-temperature methanol synthesis method from CO/H2/CO2based on the synergistic effect between solid catalyst and homogeneous catalyst [J].Catal.Today, 2010, 149: 98-140.
[25]Shi L, Tao K, Yang R Q, Meng F Z, Xing C, Tsubaki N.Study on the preparation of Cu/ZnO catalyst by sol-gel auto-combustion method and its application for low-temperature methanol synthesis [J].Appl.Catal.A: Gen., 2011, 401: 46-55.
[26]Shi L, Yang R Q, Tao K, Yoshiharu Yoneyama, Tan Y S, Tsubaki Noritatsu.Surface impregnation combustion method to prepare nanostructured metallic catalysts without further reduction: as-burnt Cu-ZnO/SiO2catalyst for low-temperature methanol synthesis [J].Catalysis Today, 2012, 185: 54-60.
[27]Zeng C Y, Shi L, Sun J, Yoshiharu Yoneyama, Wang T J, Tsubaki Noritatsu.Nitrate combustion methods to prepare highly active Cu/ZnO catalysts for low-temperature methanol synthesis: comparative behaviors of citric acid in air or argon atmosphere [J].Bull.Chem.Soc.Jpn., 2013, 84: 1202-1209.
[28]Shi L, Tan Y S, Tsubaki N.A solid-state combustion method towards metallic Cu-ZnO catalyst without further reduction and its application to low-temperature methanol synthesis [J].Chem.Cat.Chem., 2012, 4: 863-871.
[29]Shi L, Shen W Z, Yang G H, Fan X J, Jin Y Z, Zeng C Y, Kenji Matsuda, Tsubaki Noritatsu.Formic acid directly assisted solid-state synthesis of metallic catalysts without further reduction: as-prepared Cu/ZnO catalysts for low-temperature methanol synthesis [J].Journal of Catalysis, 2013, 302: 83-90.

