新型芳香吡咯类农药溴虫腈的合成工艺探究*1
谢建武, 王梦雪, 鲍家馨, 黄 晓, 王丹丹
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
新型芳香吡咯类农药溴虫腈的合成工艺探究*1
谢建武, 王梦雪, 鲍家馨, 黄 晓, 王丹丹
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
研究了以对氯苯甘氨酸、2-氯丙烯腈和二乙氧基甲烷等为主要底物,以[3+2]环加成反应为关键步骤,合成溴虫腈的新工艺.值得注意的是,在最后一步反应中,以三氯化磷代替三氯氧磷取得了更好的结果.
溴虫腈;合成;工业化;吡咯衍生物
二恶吡咯霉素是美国的氰胺公司在1987年从微生物链霉菌Streptomyces中分离得到的,其后发现该化合物具有良好的杀虫杀螨性[1],继而开发出新型芳基吡咯腈类杀虫杀螨剂——溴虫腈,用于防治各类害虫,应用非常广泛.溴虫腈是天然产物,本身对昆虫无毒杀作用,它是利用昆虫摄食或碰触后,在其体内把氧化酶转变为具有杀虫活性的化合物,把昆虫体细胞内线粒体的氧化磷酸化二磷酸腺苷(ADP)转变成三磷酸腺苷(ATP)[2]而发挥作用的.
溴虫腈又名虫螨腈,商品名为除尽悬浮剂[3],具有低毒性,被世界各国推荐为替代高毒农药的无公害农药之一.作为三大农药支柱之一,有关溴虫腈合成路线的报道有许多[4-14].对溴虫腈的经典合成路线归纳如图1所示.
如何构造溴虫腈中的吡咯环是研究的关键.文献报道较多的是肌氨酸合成路线,该方法以对氯苯甲醛为起始原料,但遗憾的是,该路线涉及到剧毒品氰化钠的使用及存在原料成本高等问题,制约着该合成路线的工业开发和市场推广.近年来,化学家们发展了以对氯苯基胺基丙烯腈、三氟甲基对氯苄基甲酮、α-对氯苯基三氟乙酰氨基腈、对氯苯甲酰胺衍生物、对氯苯甲酰三氟乙胺等为原料的合成路线.然而,这些合成路线也存在着一些不足,如反应的选择性较差、反应收率较低等问题[15-19].因此,笔者对比文献,对溴虫腈的合成路线进行了优化,并且利用三氯化磷代替成本较高、毒性较大的三氯氧磷,发展了一条符合工业化生产的溴虫腈合成工艺.
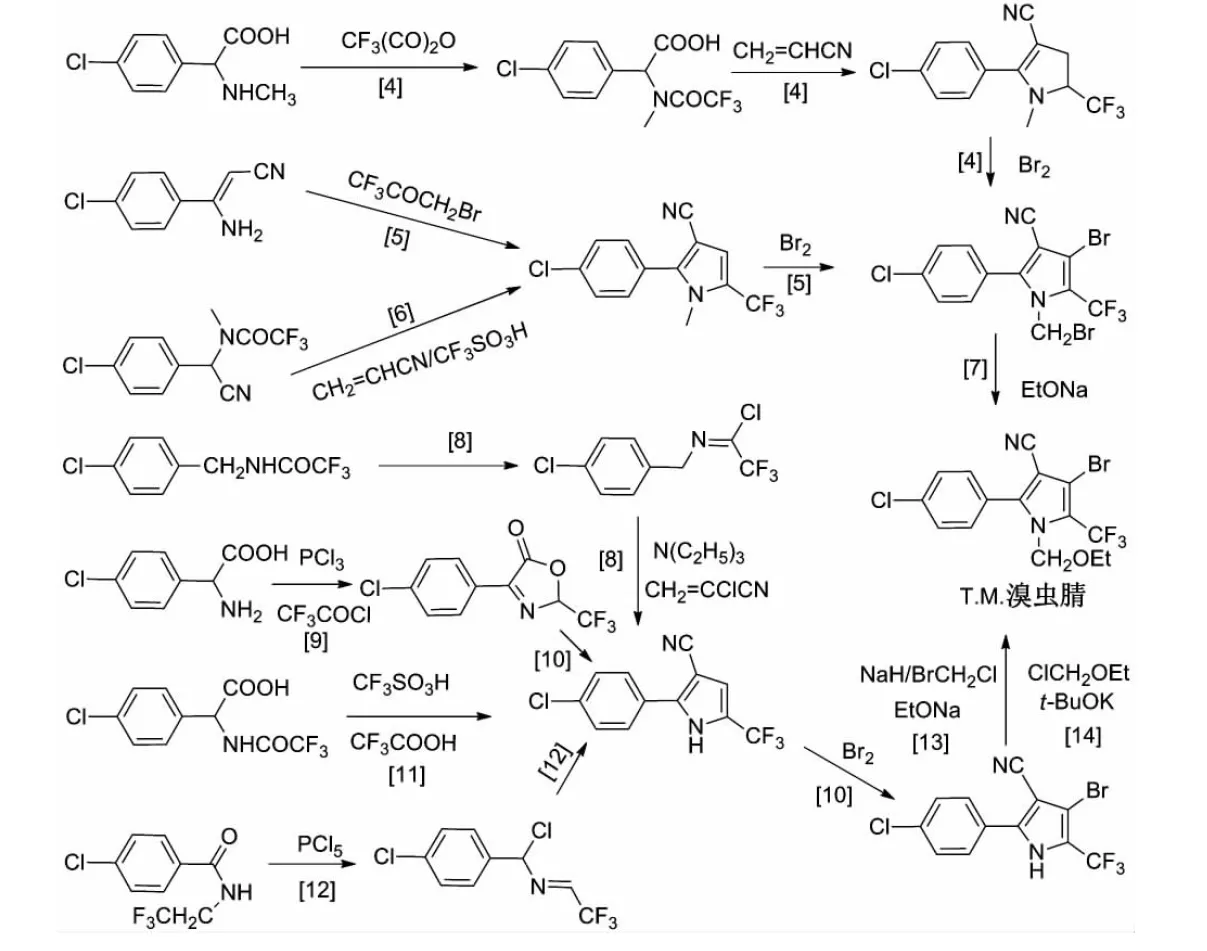
图1 溴虫腈的经典合成路线
1 实验部分
1.1试剂与仪器
WRS-1B数字熔点仪(温度计未经校正);WZZ-2B自动旋光仪;Bruker Avance 400型或600型核磁共振波谱仪(DMSO或CDCl3为溶剂,四甲基硅烷为基准物质);美国waters 1525高效液相色谱仪.所用的试剂均为市售化学纯(CP)或分析纯(AR),直接使用.有机反应用薄层色谱(TLC,硅胶板)跟踪监测.
1.2实验的一般步骤
1.2.1 中间体恶唑啉-5-酮的构造
参照文献[20]进行了优化,反应方程式如下:
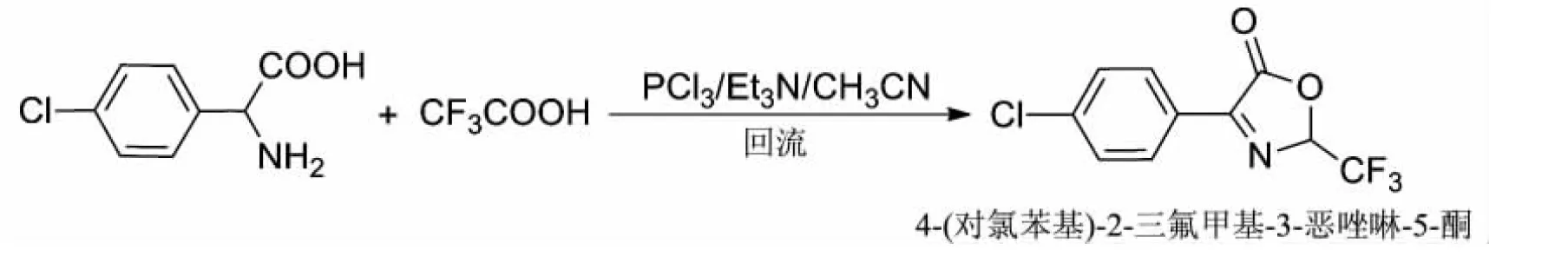
在250 mL圆底烧瓶中,加入乙腈50 mL、对氯苯甘氨酸5.0 g(0.025 mol),磁力搅拌均匀,滴加三氟乙酸2.9 mL(0.037 5 mol),约5 min;混合均匀后,慢慢滴加催化剂三乙胺3.5 mL(0.025 mol),再缓慢滴加三氯化磷2.4 mL(0.027 5 mol),0.5 h内滴加完即可;最后,升温到65 ℃并维持反应4 h.反应完全后,冷却至室温,旋转蒸发浓缩,并加入适量的甲苯旋干,得到黄色粘稠油状产物,即中间体4-(对氯苯基)-2-三氟甲基-3-恶唑啉-5-酮.
1.2.2 中间体2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈的合成
参照文献[21]进行了优化,反应方程式如下:

第一步反应使用后的250 mL圆底烧瓶直接用于下一步反应,加入乙腈50 mL,其中中间体4-(对氯苯基)-2-三氟甲基-3-恶唑啉-5-酮的量约为5.3 g(0.02 mol),室温下搅拌后加入2-氯代丙烯腈3.5 g(0.04 mol),滴加定量的催化剂三乙胺7.2 mL(0.05 mol),控制滴加速度为6~7 min/mL;滴加完毕,78 ℃左右回流1 h.反应完全后,冷却至室温,在反应液中加入适量冷水,有淡黄色固体析出,减压抽滤得到产物,即中间体2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈,用乙醇进行重结晶,真空干燥箱中50 ℃左右烘干,用于下一步反应.第一步和第二步反应的总收率高达93.5%.
1.2.3 中间体4-溴-2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈的合成
参照文献[22]进行了优化,反应方程式如下:
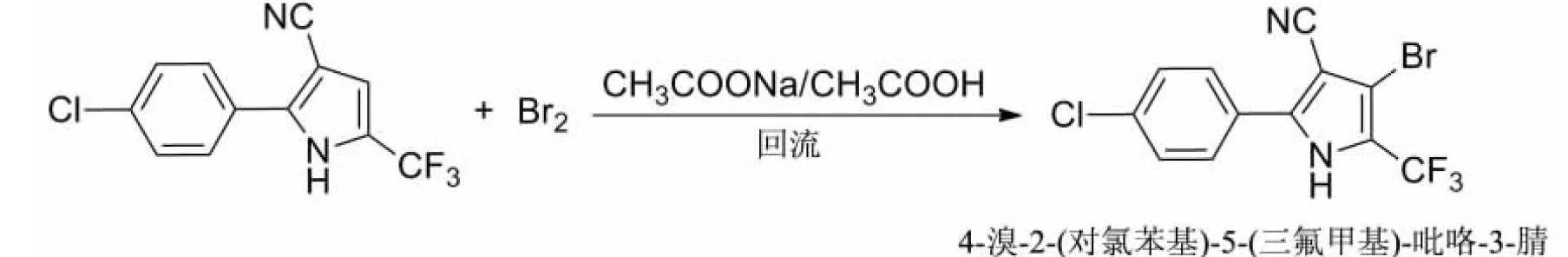
在250 mL两颈烧瓶中加入乙酸75.0 mL,加入中间体2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈5.4 g(0.020 mol),磁力搅拌均匀,加入无水乙酸钠1.97 g(0.024 mol),完全溶解后缓慢加热至90.0 ℃,搅拌10 min;在90.0 ℃恒温下滴加溴单质(6.4 g,0.040 mol)的乙酸溶液20.0 mL,滴加速度根据冷凝管中有无橙红色的溴蒸气来调节,滴加完毕后继续搅拌30 min,然后升温到110.0 ℃,维持反应3.0 h.反应完全后,体系冷却至室温,加入等量的冰水,有大量的白色固体析出,减压抽滤后可得到产物,即中间体4-溴-2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈.经干燥处理后,产率高达92.7%
1.2.4 目标产物溴虫腈的合成
反应方程式如下:

在250 mL圆底烧瓶中加入甲苯50 mL,加入中间体4-溴-2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈5.2 g(0.015 mol),磁力搅拌溶解后再加入二乙氧基甲烷3.12 g(0.030 mol),混合均匀,缓慢加热至97.0 ℃;恒温下慢慢滴加三氯化磷0.8 mL(0.015 mol),搅拌下回流反应超过0.5 h;慢慢滴加三乙胺1.05 mL(0.030 mol),继续在97.0 ℃恒温下反应5 h.反应完全后,体系冷却至室温,加入冰水,剧烈搅拌之后用甲苯萃取,有机相旋干可得黄色固体,即目标产物溴虫腈(4-溴-2-(对氯苯基)-1-乙氧基甲基-5-(三氟甲基)-吡咯-3-腈),干燥后产率约为92.3%.
2 结果与讨论
在酰化反应中,本文采用价格低廉的三氟乙酸代替昂贵的三氟乙酸酐(后者售价是前者的4倍多),大大降低了原料的成本.该步反应中的溶剂乙腈可以通过蒸馏、干燥,回收再利用,从而可降低成本,减少污染.
环化过程中,难题是中间体4-(对氯苯基)-2-三氟甲基-3-恶唑啉-5-酮的黏度大,易粘壁,难以将其取出进行下一步反应.本文采用直接往第一步反应后的体系中加入第二步反应的原料,操作简便,有效地提高了生产效率.另外,加入过量的2-氯丙烯腈能够大大提高反应的产率.同样,从降低成本和保护环境角度出发,在此处考虑乙腈的回收.
溴化反应中乙酸作为一种缚酸剂,可显著改善该溴代过程,大大缩短反应时间[23],并在弱碱乙酸钠存在下进行芳基吡咯的环上溴化.该步反应要控制溴单质的滴加速度,不可过快,以防止大量的溴单质变成气体溢出,导致原料损失、产率降低,其中溴单质可进行回收.为了提高产率,该步采用了阶段性升温的方法.
本实验最大的进步是最后一步目标产物溴虫腈的合成中,乙氧基甲基化使用了廉价的二乙氧基甲烷代替高价的二溴甲烷,也避免了使用常规路线所采用的强致癌物氯甲基乙基醚,大大降低了原料的成本和安全风险.最关键的一点是,突破了大多数文献报道的使用剧毒化学药品三氯氧磷作为催化剂的固有方法,本文采用三乙胺和三氯化磷代替三氯氧磷.并且,单步产率大于90%,操作简便,对工艺要求不高,适宜于工业上的推广.
产物的表征如下:
1)中间体2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈:熔点234~238 ℃;1H NMR(400 MHz,DMSO)δ:13.43(s,1H),7.83(d,J=8.6 Hz,2H),7.67(d,J=8.7 Hz,2H),7.32(d,J=0.9 Hz,1H);13C NMR(100 MHz,DMSO)δ:140.5,134.4,129.3,128.7,127.4,120.9,116.1,114.9,90.0.数据与文献[21]的一致.
2)中间体4-溴-2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈:1H NMR(400 MHz,DMSO)δ:13.76(s,1H),7.81(d,J=8.6 Hz,2H),7.67(d,J=8.6 Hz,2H);13C NMR(100 MHz,DMSO)δ:140.4,134.9,129.2,129.0,126.6,121.3,119.3,118.9,114.4,101.5,94.8.数据与文献[22]的一致.
3)溴虫腈:熔点91~93 ℃;1H NMR(600 MHz,DMSO)δ:7.85(d,J=8.6 Hz,2H),7.60(d,J=8.6 Hz,2H),4.58(s,2H),3.50(d,J=7.1 Hz,2H),1.12(t,J=7.1 Hz,3H);13C NMR(150 MHz,DMSO)δ:141.2,133.7,129.8,129.0,128.9,128.4,94.0,62.3,61.5,15.2,15.1,8.4.
3 结 论
以对氯苯甘氨酸为起始原料,与三氟醋酸进行同步酰化和环合,构造得到3-恶唑啉-5-酮中间体;进一步与2-氯代丙烯腈进行[3+2]环加成反应,构造出重要的中间体2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈;接着进行芳香吡咯环上的溴化,得到溴化中间体4-溴-2-(对氯苯基)-5-(三氟甲基)-吡咯-3-腈.特别是,在最后一步反应中,本文以价廉且毒性较低的三氯化磷代替文献报道的价格及毒性均较高的三氯氧磷作为催化剂,溴化物与二乙氧基甲烷反应进行N-乙氧基甲基化,以较高的收率获得了目标产物溴虫腈.该合成工艺反应条件温和,适宜于工业化生产.以初始原料对氯苯甘氨酸计算,4步反应的总收率高达80.0%,纯度大于99%,具有潜在的应用开发价值.
[1]Carter G T,Nietsche J A,Goodman J J,et al.LL-F42248 alpha,a novel chlorinated pyrrole antibiotic[J].J Antibiot(Tokyo),1987,40(2):233-236.
[2]孙国强,陆贻通.溴虫腈农药的作用机理、应用及开发前景[J].安徽农学通报,2007,13(7):69-71.
[3]张芝平.吡咯类杀虫剂的构效关系和作用机理研究[J].世界农药,1999,21(6):12-16.
[4]Kameswaran V.2-Aryl-(5-trifluoromethyl)-2-pyrroline compounds and process for the manufacture of insecticidal,2-aryl-1-(alkoxymethyl)-4-halo-5-(trofluoromethyl) pyrroles:EP,492171[P].1992-07-01.
[5]Kameswaran V,Barton J M.Prosess for the manufacture of pesticide 1-(alkoxymethyl) pyrrole compounds:US,5151536[P].1992-09-29.
[6]Kameswaran V.Process for the manufacture of 2-aryl-5-perfluoroalkylpyrrole:US,5777132[P].1998-07-07.
[7]陶贤签,谭本祝.含氟杀虫剂的制备[J].湖南化工,2000,30(5):29-31.
[8]Kameswaran V,Kuhn D G.Process for the manufacture of insecticidal,nematicidal and acaricidal 2-aryl-3-subsitituted-5-(trifluoromethyl) pyrrole compounds fromN-(substitutedbenzyl)-2,2,2-trifluoro-acetimidoyl compounds:US,5145986[P].1992-09-08.
[9]Inger S,Schroeders M.Transport device for packages and/or tubes thereof:US,5020735[P].1991-06-04.
[10]Addor R W,Furch J A,Kuhn D G.Process for the preparation of insecticidal,acaricidal and nematicidal 2-aryl-5-(trifluoromethyl) pyrrole compounds:EP,0469262[P].1991-05-25.
[11]Kameswaran V.Ammonium oxazole and amino oxazolium intermediates,methods for the preparation thereof and use therefor in manufacture of insecticidal arypyrroles:CN,1170721[P].1998-01-21.
[12]Kameswaran V.Ammonium oxazole and amino oxazolium intermediates,methods for the preparation thereof and use therefor in manufacture of insecticidal arypyrroles:US,5945538[P].1999-08-31.
[13]Kameswaran V.Method for the preparation of 2-arly-5-trifluoromethyl pyrpole compounds:US,5256796[P].1992-12-11.
[14]Doehner R F,Barton J M.Alkoxymethylation of pyrroles:US,5359090[P].1994-10-25.
[15]Brown D G,Siddens J K,Diehl R E,et al.Arylpyrrole insecticidal,acaricidal and nematicidal agents and methods for the preparation thereof:US,5010098[P].1988-06-23.
[16]Addor R W,Furch J A,Kuhn D G.Process for the preparation of insecticidal,acaricidal and nematicidal 2-aryl-5-(trifluoromethyl) pyrrole compounds:US,5030735[P].1991-07-09.
[17]Kameswaran V.Process for the preparation of insecticidal,acaricidal and nematicidal 2-aryl-3-substituted-5-(trifluoromethyl) pyrrole compounds:US,5225568[P].1993-07-06.
[18]徐尚成,万琴,蒋木庚.芳基吡咯类化合物的合成化学[J].世界农药,2003,25(2):1-4.
[19]程绎南,谢桂英,孙淑君,等.溴虫腈合成新方法[J].农药,2010,49(8):560-562.
[20]付庆,张晓铭,姚巍,等.溴虫腈的合成[J].农药,2006,45(6):386-387.
[21]Noemi S,Andrea C,Francesca P,et al.Domino process as a tool for recovering substandard reactions.synthesis and use of nitroacetic acid esters and amides[J].Organic Letters,2002,4(6):965-968.
[22]来虎钦,穆金霞,曾庆斌,等.2-(对-氯苯基)-5-三氟甲基吡咯-3-腈的合成工艺研究[J].浙江工业大学学报,2003,31(6):692-694.
[23]徐尚成,蒋木庚.杀虫剂溴虫腈的合成[J].南京农业大学学报,2004,27(2):105-108.
(责任编辑 薛 荣)
Studiesonanewsynthesisofanovelinsecticidalandacaricidalarylpyrrolechorlfenapyr
XIE Jianwu, WANG Mengxue, BAO Jiaxin, HUANG Xiao, WANG Dandan
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,JinhuaZhejiang321004,China)
A new method for the synthesis of chlorfenapyr via [3+2] cycloaddition as the key step by using chlorophenylglycine, trifluoroacetic acid and diethoxymethane as main substrates was explored. Notably, the POCl3which often used for the last step was here replaced with PCl3.
chlorfenapyr; synthesis; industrialization; pyrrole derivatives
10.16218/j.issn.1001-5051.2015.02.011
2014-11-18
谢建武(1978-),男,广西博白人,教授,博士.研究方向:有机合成.
TQ453.2
A
1001-5051(2015)02-0185-05

