DCE-MRI评价Endostar对兔VX2骨肿瘤模型抗血管生成的疗效
龚威, 查云飞, 闫力永, 邢栋, 王克军, 胡磊, 王娇, 刘昌盛
DCE-MRI评价Endostar对兔VX2骨肿瘤模型抗血管生成的疗效
龚威, 查云飞, 闫力永, 邢栋, 王克军, 胡磊, 王娇, 刘昌盛
目的:探讨基于Reference-Region模型的DCE-MRI评价恩度对兔VX2骨肿瘤抗血管生成疗效的可行性。方法:将成功建立胫骨VX2肿瘤模型(软组织肿块直径>1.0 cm)的20只兔子随机分成对照组(n=10)和实验组(n=10),分别于给药前、连续给药14天后(对照组药物为生理盐水;实验组药物为恩度,药物浓度为1.5 mg/8 mL)行DCE-MRI扫描 ,使用Referrence Region模型获得肿瘤组织的对比剂容积转移常量Ktrans和反流速率常数Kep。于第14天扫描结束后处死动物,取肿瘤外周及中心区域的组织进行免疫组化染色检测,得到肿瘤不同区域的微血管密度(MVD)及血管内皮生长因子(VEGF)的表达情况,将DCE-MRI各参数与免疫组化结果进行相关分析。结果:对照组中肿瘤外周区域和中心区域的Ktrans值在治疗前分别为(32.58±3.10)和(28.50±3.54)min-1,治疗后分别为(37.66±2.78)和(34.20±3.39)min-1;实验组中肿瘤组织的外周区域和中心区域的Ktrans值在治疗前分别为(27.70±4.75)和(23.90±4.40)min-1,在治疗后分别为(22.20±4.29)和(18.30±4.23)min-1。实验组VX2骨肿瘤外周区域与中心区域的Ktrans值、MVD值及VEGF表达情况间的差异均有统计学意义(P<0.05),Kep值的差异无统计学意义(P>0.05)。实验组治疗后肿瘤外周和中心区域的VEGF表达、MVD值与Ktrans值间均呈正相关关系(r值分别为 0.924、0.945、0.848和0.909,P<0.01);与Kep值间均无显著相关性(r值分别为0.022、0.162、0.219和0.042,P>0.01)。结论:兔VX2骨肿瘤模型的血流灌注空间分布具有异质性;基于Reference模型的DCE-MRI定量参数Ktrans可以评价恩度对兔VX2骨肿瘤抗血管生成的疗效。
磁共振成像; 动态对比增强扫描; 骨肿瘤; 恩度; 抗肿瘤血管生成
抑制肿瘤血管生成疗法近些年来已成为抗肿瘤治疗的热点之一。干扰血管生成过程的治疗方法称为抗血管形成治疗,主要是通过抑制内皮细胞迁移、吸附、活化和增殖或直接针对肿瘤血管的靶分子机制等,以达到抗血管生成的目的。血管内皮生长因子(vascular endothelial growth factor,VEGF)在肿瘤血管生成中发挥关键作用,是目前认为最直接参与诱导肿瘤血管形成的因子之一[1,2]。临床观察资料已证实在各种实体瘤中VEGF促进新血管形成的程度与肿瘤预后间有明显的相关性[3]。
骨肉瘤、尤文肉瘤等恶性骨肿瘤的生长、复发、转移均依赖于肿瘤新生血管的形成[4,5]。有研究表明,抗血管生成治疗对于尤文肉瘤患者的治疗是有意义的[6]。目前,恶性骨肿瘤抗血管生成治疗已越来越受到关注。重组人血管内皮抑制素注射液(商品名恩度,Endostar)是一种新型的血管生成抑制类药品,通过抑制血管内皮细胞的迁移来抑制肿瘤新生血管生成,阻断肿瘤细胞的营养供给,从而达到抑制肿瘤增殖或转移的目的。
动态对比增强MR灌注成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)可以定量评价微循环灌注及血管通透性[7]。DCE-MRI的定量模型常见有Perfusion、Tofts单室模型及Extended Tofts双室模型等。定量DCE-MRI的Refe-rence模型不需要测量动脉输入函数(arterial input function,AIF)值,操作简便,但利用定量此模型来评价抗血管生成药物治疗骨肿瘤的疗效尚未见文献报道。本研究旨在探讨基于Reference Region模型的DCE-MRI定量参数在评价抗血管生成治疗药物恩度对兔VX2骨肿瘤模型的治疗疗效中的可行性。
材料与方法
1.VX2骨肿瘤模型制备
实验动物为新西兰大白兔50只,体重2~3 kg,雌雄不限。VX2肿瘤细胞由活体种兔后肢肌内注射传代获得。种兔由华中科技大学附属协和医院动物中心提供。
实验动物的麻醉采用戊巴比妥钠,剂量1.5 mL/kg,经耳缘静脉注射。手术剥离荷瘤兔肿瘤,用双面刀片切取肿块边缘生长旺盛的粉红色鱼肉样组织,制成1 mm3大小的肿瘤组织块,置于RPMI1640培养液中备用。切开实验动物胫骨内侧上段皮肤,瘤兔膝关节屈曲位,在胫骨干骺端胫骨平台上方用12号针头垂直钻洞直至干骺端松质骨内,进针1 cm左右,将肿瘤组织置入洞的底部,用骨蜡封闭洞口,缝合皮肤切口。7 d后对所有实验动物行MDCT检查,VX2骨肿瘤模型制备成功的标准为胫骨骨质破坏且邻近软组织肿块直径>1.0 cm。
2.实验分组及抗血管生成治疗实验
筛选动物模型(肿块直径>1.0 cm)20只,随机分为两组:①对照组(n=10),造模成功后给予生理盐水治疗;②实验组(n=10),造模成功后给予恩度治疗。将恩度(山东先声麦得津生物制药有限公司,15 mg/2.4 ×105U/3 mL/支)加入500 mL 0.9%生理盐水稀释。实验组经耳缘静脉滴注恩度溶液(50 mL),对照组则采用0.9%生理盐水50 mL静脉滴注,两组均连续每日给药,共持续14 d。
3.检查方法
使用GE Discovery750 Plus 3.0T超导磁共振仪、膝关节线圈。瘤兔模型均于未给药前行首次MRI平扫及DCE-MRI扫描(图1、2),连续给药14 d后进行第二次扫描,两次扫描的参数及测量区域保持一致。MRI平扫的扫描序列及参数:矢状面FSE-T2WI,TR 2140 ms,TE 120 ms,回波连长度25;FSE-T1WI,层厚3 mm,层间距2 mm,视野13 cm×13 cm。DCE-MRI扫描采用快速扰相梯度回波序列(又称为2D-Flex),层厚3 mm,层间距2 mm,TR 9.0 ms,TE 1.28 ms,视野13 cm×13 cm,矩阵256×192,注射对比剂之前行5个同层连续动态时相作为基础扫描,翻转角分别为3°、6°、9°、12°和15°,注射对比剂的同时启动2D-LAVA Flex扫描。使用磁共振压力注射器经经兔耳缘静脉留置针(20G)注射Gd-BOPTA(上海博莱科信谊药业有限责任公司)3 mL,用12 mL生理盐水以相同流率进行冲洗,流率0.2 mL/s,采集次数1,同层连续扫描50个动态图像,8秒/层,总扫描时间约400 s。
4.MRI图像后处理
使用Omni Kinetics软件对DCE-MRI原始数据进行后处理。在瘤兔腓肠肌内选取感兴趣区(region of interest,ROI),建立Reference Region模型,绘制时间-信号强度曲线(图3)。在横轴面图像上肿瘤强化最明显的区域选取2个ROI,输出参数选用对比剂容积转移常量 (Ktrans)和反流速率常数(Kep),图像以伪彩图显示(图2b、c)。ROI的选择需同时满足3个条件[8]:①必须覆盖肿瘤强化的外周、中央两个区域,并尽量避开坏死区域;②ROI面积必须大于12个像素;③MRI平扫与DCE-MRI图像上ROI的位置和大小必须一致。选取ROI的方法[9]:取肿瘤最大内切圆圆心(O),并在病灶边缘区选取任意几点(A-G),自O点向各点作放射状连线,然后将每条连线的中点连接起来,画出类似肿瘤外形的小同心圆,其将病灶分为内外2部分,内侧即为肿瘤中心区域,外侧为边缘区域。
4.病理形态学观察及免疫组化分析

图3 时间-信号强度曲线,示增强早期肿瘤外周区域的强化曲线(红色)斜率值较中央区域(绿色)大, 一定时间后二个曲线均进入平台期。
于第二次MRI扫描结束后分别处死对照组和实验组中的瘤兔各10只,将肿瘤组织浸泡在4%的多聚甲醛中脱钙1个月,然后进行石蜡包埋,4~5 μm 切片(切片层面与成像层面一致),血清封闭30 min,敷一抗(CD31、VEGF)4℃过夜,PBS冲洗,敷二抗,保持室温30 min,然后进行DAB显色。使用VEGF单克隆抗体染色(图)。采用VEGF阳性染色的强度及阳性细胞百分比作为判断标准。首先将染色强度进行评级,分为无色(0分)、淡黄色(1分)、黄色(2分)和棕褐色(3分)共4级,再将对阳性细胞所占百分比进行计算和评分:0分为阴性,1分为阳性细胞<10%,2分为11%~50%,3分为51%~75%,4分为>75%;以染色强度与阳性百分比的乘积作为评价标准。
微血管密度(micro-vessel density,MVD)计数:在低倍镜下(×40)选择微血管密集区(hot spots),然后在高倍镜下(×200)选择5个视野计数微血管数目,取5个视野的平均值作为MVD值。微血管的评价标准:任何与其他微血管、肿瘤细胞或肿瘤内结缔组织分离的单个棕黄色内皮细胞或细胞团可作为一根血管:肌层较厚的血管不被计数:管腔超过8个红细胞直径的血管不被计数;排除出血、纤维化及边缘反应区。
同时,每张组织芯片进行免疫组化染色时均对应有HE染色,免疫组化阴性对照一抗为PBS所代替 ,以保证对免疫组化结果进行准确判断。
5.统计学分析
使用SPSS 17.0软件,将各组标本VEGF表达情况转化为数值评分,VX2骨肿瘤模型不同区域的VEGF、MVD及DCE-MRI参数的比较采用独立样本t检验,使用恩度治疗前后VX2骨肿瘤不同区域VEGF、MVD和DCE-MRI参数的比较采用独立样本t检验,MVD值与DCE-MRI参数的相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。

图4 治疗后HE染色图像(×40),示对照组中肿瘤细胞较实验组密集。a) 对照组;b) 实验组。 图5 治疗后MVD免疫组化染色图像(×40),示对照组中肿瘤内MVD高于实验组。a) 对照组; b) 实验组。 图6 治疗后VEGF免疫组化染色图像(×40),示实验组中肿瘤的VEGF表达程度明显低于对照组。a) 对照组; b)实验组。
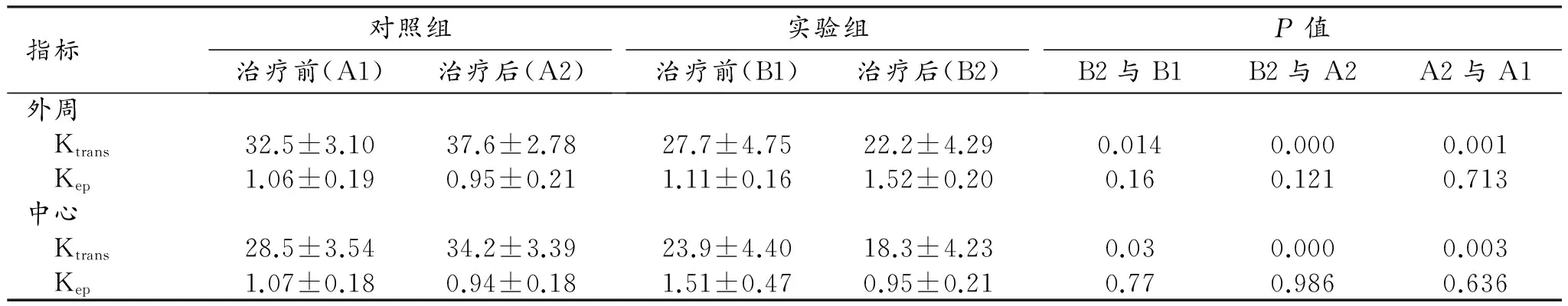
指标对照组治疗前(A1)治疗后(A2)实验组治疗前(B1)治疗后(B2)P值B2与B1B2与A2A2与A1外周 Ktrans32.5±3.1037.6±2.7827.7±4.7522.2±4.290.0140.0000.001 Kep1.06±0.190.95±0.211.11±0.161.52±0.200.160.1210.713中心 Ktrans28.5±3.5434.2±3.3923.9±4.4018.3±4.230.030.0000.003 Kep1.07±0.180.94±0.181.51±0.470.95±0.210.770.9860.636
结 果
1.实验动物情况
50只新西兰兔,7只右侧胫骨未见成瘤,6只肿瘤生长过大,2只在行MRI扫描前因麻醉意外死亡,3只于饲养过程中不明原因死亡,最终32只符合条件。随机筛选20只分为两组(对照组、实验组),每组各10只。
2.HE染色情况
组织芯片在HE染色及免疫组化染色后在显微镜下观察,见各点排列整齐,组织结构清晰;每张芯片有少量缺失点,掉片少,实验效果满意。芯片上每一点均能与肿瘤立体空间位置对应(图4)。
3.各组兔VX2骨肿瘤不同区域DCE-MRI参数的比较
对照组和实验组中瘤体外周和中心区域在治疗前后的Ktrans和Kep值及统计分析结果见表1、2。两组中肿瘤外周与中心区域的Ktrans差异有统计学意义(P<0.05),Kep值差异无统计学意义(P>0.05);对照组及实验组中瘤体外周和中心区域在治疗前后Ktrans值的差异均有统计学意义(P<0.05),Kep值的差异均无统计学意义(P>0.05);在治疗后,实验组和对照组中肿瘤不同区域的Ktrans值比较,差异有统计学意义(P<0.05)。

表2 两组中肿瘤外周与中心区各指标的比较(P值)
注:n=动物数(10只);VEGF:血管内皮生长因子;MVD:微血管密度,P值小于0.05有意义。
4.兔VX2骨肿瘤不同区域VEGF表达和MVD的比较
两组在治疗后肿瘤外周和中央区的VEGF表达及MVD分布情况见表3。两组肿瘤在治疗后瘤体外周VEGF表达及MVD值均高于中心区域(图4),差异有统计学意义(P<0.05)。对照组与实验组之间肿瘤的VEGF表达情况及MVD值的差异亦有统计学意义(P<0.05)。

表3 各组治疗后肿瘤不同区域VEGF与MVD

图7 相关分析散点图显示,实验组中经恩度治疗后肿瘤外周和中心区域VEGF和MVD值与Ktrans值均呈正相关关系。a) 肿瘤外周MVD; b) 肿瘤中心MVD; c) 肿瘤外周VEGF; d) 肿瘤中心VEGF。
5.肿瘤VEGF和MVD值与Ktrans和Kep值的关系
恩度治疗组在治疗前后肿瘤外周和中心区域的VEGF、MVD值与Ktrans均呈正相关关系(图5),r值分别为 0.924、0.945和0.848、0.909(P<0.01);而VEGF和MVD值与Kep值间均无显著相关性(图6),r值分别为0.022、0.162和0.219、0.042(P>0.01)。
讨 论
本实验结果显示兔VX2骨肿瘤外周区域的VEGF表达和MVD值均显著高于中央区域,在经恩度治疗后,肿瘤不同区域的VEGF表达和MVD值均降低。同时,采用基于Reference模型DCE-MRI参数中,Ktrans值与VEGF表达和MVD分布变化呈正相关, Ktrans值可用于评价抗肿瘤血管生成的疗效。
血管生成是肿瘤生长过程中必不可少的环节。MVD是评价肿瘤血管生成的重要方法,VEGF在肿瘤血管生成中发挥重要作用,它能促进形成血管的内皮细胞迁移,使MVD增加[10]。由于恶性骨肌肿瘤的血管生长类型以边缘快速发展为主,同时恶性骨肿瘤快速增殖侵犯周围正常组织,在血管刺激因子的作用下,宿主毛细血管扩张且通透性增高,最终宿主的血管也参与肿瘤血管的形成[11]。肿瘤中央区域由于肿瘤的生长时新生血管结构异常,间质内液体的有效引流增加,导致间质压力增高,同时恶性肿瘤内部比良性肿瘤含有更多的基质,基质分布在癌细胞周围,使它们与血管结构隔离,进而间质内压力进一步增加,而间质内压力的增加容易导致血管壁的塌陷,因此,肿瘤中央区域由于缺血、缺氧而易于发生坏死。因此,肿瘤血管的分布呈非均匀,外周区域微血管密度大,中央为相对的乏血管区。本实验结果证实,兔VX2骨肿瘤外周区域的VEGF表达、MVD分布均高于中央区域。
临床良恶性骨肿瘤的病理性质对患者的治疗、预后等具有很重要的指导意义,然而在某些情况下,取出的标本组织并不能真实的反映肿瘤的恶性程度。目前对于恶性骨肿瘤的大部分实验研究中并没有统一的病理取材的金标准,本实验结果显示,恶性骨肿瘤瘤体VEGF和MVD的分布具有空间差异性,切取瘤体不同部位进行病理分析可能得到不同的结果,因此,如何准确地在能够反映肿瘤微血管生成的部位进行取材和病理学检查,对临床医师能获得关于肿瘤病理性质的准确信息具有重要意义。
MVD是目前反映肿瘤血管生成的“金标准”,是评价肿瘤恶性程度的一个独立指标,但其具有的有创性、可重复性差以及无法进行动态观察等缺点使其无法在临床得到广泛应用。DCE-MRI模型具有无创、快捷及可重复性好等优点[12],在评价肿瘤新生血管及抗血管生成治疗的研究中应用较广泛。其数据的分析通常需要得到血管的AIF,AIF是通过动脉血样直接采集获得[13],然而这个采集过程是很困难的,因为血液的特性使得直接测量对比剂的浓度不够准确,同时本实验兔下肢血管的选择具有一定困难。本实验应用的Reference Region模型既具有常规DCE-MRI模型的优点,同时这种定量模型可选用例如肌肉等作为参照,不需要通过AIF的测量来获取血流动力学参数的相关信息,减少了因AIF测量所导致的二次误差,具有简单易行、误差小的优点,同时得到的信息与传统的DCE-MRI模型所得到的信息相似。如Yankeelov等[14]提出了一种不需要AIF的DCE-MRI模型的数学框架,然后建立小鼠肺癌肿瘤模型,通过选用Reference Region模型,在参考区域测量R-R浓度曲线来替代AIF曲线,即可定量估计肿瘤的药代动力学参数,经过测试后得到的参数与传统的AIF模型所得到的结果相符。
与传统的DCE-MRI定量模型相比,Reference Region模型只能得到参数容积转移常数(Ktrans)和反流速率常数Kep,以Ktrans最能反映肿瘤血管的灌注及渗透特性[15]。Ktrans取决于组织内血流量、内皮细胞表面积大小和血管内皮细胞通透性。当肿瘤内为高血流灌注和高渗透性时,Ktrans值增高;当肿瘤内为低血流灌注和低渗透性时,Ktrans值降低。肿瘤生长时,肿瘤内血流灌注增加,微血管通透性增高,肿瘤新生血管数目增多,即MVD计数增高,为肿瘤细胞的生长提供了更充足的营养物质;反之,使用抗肿瘤血管生成药物治疗后,干扰了内皮细胞的增殖和迁移,降低了微血管的渗透性,使Ktrans值降低,肿瘤新生血管数目减少,即MVD计数降低。
本研究结果显示,实验组和对照组中肿瘤不同区域的MVD值与定量参数Kep值间无显著相关关系。Kep值受血管通透性的影响较显著,与血流灌注和血容量呈正相关,与间质容积呈负相关,实验中Kep值在实验组与对照组中治疗前后的差异均无统计学意义,可能与瘤兔个体差异、肿瘤血管的异构及对比剂残留于组织间隙不能及时排出等因素有关。
本实验中通过建立兔VX2骨肿瘤模型并进行抗血管生成治疗,初步研究结果显示抗血管生成治疗后,兔VX2骨肿瘤外周和中心区域的VEGF表达和MVD值均降低,Ktrans值与VEGF表达和MVD分布变化呈明显正相关,证实基于R-R模型的DCE-MRI定量参数可以评估恶性骨肿瘤抗血管生成疗效。
本实验也存在一定的局限性:①实验兔VX2骨肿瘤模型与临床恶性骨肿瘤的生长方式并不完全一致,动物模型采用恩度治疗时的给药时间、给药剂量等与临床病例间存在一定的差异;②未将Reference模型的定量参数与其它MRI定量技术如动脉自旋标记技术和多b值DWI等进行对照研究。
[1]Jensen RL,Ragel BT,Whang K,et al.Inhibition of hypoxia inducible factor-1alpha (HIF-1alpha) decreases vascular endothelial growth factor (VEGF) secretion and tumor growth in malignant gliomas[J].J Neurooncol,2006,78(3):233-247.
[2]Park MJ,Kim HS,Jahng GH,et al.Semiquantitative assessment of intratumoral susceptibility signals using non-contrast-enhanced high-field high-resolution susceptibility-weighted imaging in patients with gliomas:comparison with MR perfusion imaging[J].AJNR,2009,30(7):1402-1408.
[3]Oostendorp M,Post MJ,Backes WH.Vessel growth and function:depiction with contrast-enhanced MR imaging[J].Radiology,2009,251(2):317-335.
[4]Quan GM,Choong PF.Anti-angiogenic therapy for osteosarcoma[J].Cancer Metastasis Rev,2006,25(4):707-713.
[5]Kim HS,Lim SJ,Park YK.Anti-angiogenic factor endostatin in osteosarcoma[J].APMIS,2009,117(10):716-723.
[6]Dubois SG,Marina N,Glade-Bender J.Angiogenesis and vascular targeting in Ewing sarcoma:a review of preclinical and clinical data[J].Cancer,2010,116(3):749-757.
[7]Montemurro F,Russo F,Martincich L,et al.Dynamic contrast enhanced magnetic resonance imaging in monitoring bone metastases in breast cancer patients receiving bisphosphonates and endocrine therapy[J].Acta Radiol,2004,45(1):71-74.
[8]Cho JH,Cho G,Song Y,et al.Feasibility of FAIR imaging for evaluating tumor perfusion[J].J Magn Reson Imaging,2010,32(3):738-744.
[9]孟悛非,吕衍春,吕凤华,等.增强MR灌注成像在骨骼-软组织肿瘤良恶性鉴别诊断中的价值[J].中华放射学杂志,2001,35(8):578-583.
[10]Yerushalmi R,Woods R,Ravdin PM,et al.Ki67 in breast cancer:prognostic and predictive potential[J].Lancet Oncol,2010,11(2):174-183.
[11]Sun S,Schiller JH.Angiogenesis inhibitors in the treatment of lung cancer[J].Crit Rev Oncol Hematol,2007,62(2):93-104.
[12]Thukral A,Thomasson DM,Chow CK,et al.Inflammatory breast cancer:dynamic contrast-enhanced MR in patients receiving bevacizumab——initial experience[J].Radiology,2007,244(3):727-735.
[13]Benjaminsen IC,Brurberg KG,Ruud EB,et al.Assessment of extravascular extracellular space fraction in human melanoma xenografts by DCE-MRI and kinetic modeling[J].Magn Reson Imaging,2008,26(2):160-170.
[14]Yankeelov TE,Luci JJ,Lepage M,et al.Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function:a reference region model[J].Magn Reson Imaging,2005,23(4):519-529.
[15]Schnell CR,Stauffer F,Allegrini PR,et al.Effects of the dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 on the tumor vasculature:implications for clinical imaging[J].Cancer Res,2008,68(16):6598-6607.
Feasibility of DCE-MRI for evaluation of anti-angiogenesis effect of Endostar in the model of rabbit VX2 bone tumorGONG Wei,ZHA Yun-fei,YAN Li-yong,et al.Department of Radiology,People's Hospital of Wuhan University,Wuhan 430060,P.R.China
Objective:To explore the feasibility of dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI) based on the Reference-Region model for evaluating anti-tumor angiogenesis effect of endostar in rabbit VX2 bone tumor.Methods:20 rabbits with VX2 bone tumor (tumor size in soft tissue>1cm) were randomly divided into the control group (n=10) and the experimental group (n=10),and were accepted DCE-MRI examination before and 14 days after treatment (using saline in control group;using endostar with concentration of 1.5mg/8mL in experimental group).DCE-MRI parameters including microvascular permeability transfer constant (Ktrans) and microvascular permeability reflux constant (Kep) were acquired based on the Reference-Region model.All the rabbits were sacrificed after DCE-MRI scanning at the 14th day.MVD and VEGF expression were analyzed by immunohistochemical staining.Correlation analysis was performed between DCE-MRI parameters and immunohistochemistry results.Results:In the experimental group,the Ktrans,MVD and VEGF expression had statistical difference (P<0.05) between peripheral region and central region of tumors,but the Kepvalue had no statistical difference (P>0.05) between the two regions.Before treatment,the Ktransvalue of peripheral region and central region of rabbit VX2 bone tumors in the control group were (32.58±3.10) and (28.5±3.54) min-1respectively;and were (27.7±4.75) and (23.9±4.40)min-1in the experimental group; after treatment,they were (37.66±2.78) and (34.2±3.39)min-1in control group,and were (22.2±4.29) and (18.3±4.23)min-1in the experimental group,respectively.In the experimental group,the Ktransvalues of the peripheral region and central region of rabbit VX2 bone tumors were correlated with the MVD and VEGF expression (r=0.924,0.945,0.848 and 0.909,respectively;P<0.01).The Kepvalues were not correlated with the MVD and the VEGF expression (r=0.022,0.162,0.219 and 0.042,respectively;P>0.01).Conclusion:The spatial distribution of blood perfusion in rabbit VX2 bone tumors has heterogeneity.The Ktransvalue in DCE-MRI based on the Reference-Region model can be applied to estimate the anti-tumor angiogenesis effect of endostar.
Magnetic resonance imaging; Dynamic contrast-enhanced scan; Bone tumors; Endostar; Anti-tumor angiogenesis
2014-12-22修回日期:2015-01-23)
430060武汉,武汉大学人民医院放射科
龚威(1986-),男, 湖北十堰人,硕士研究生,主要从事血管及肌骨病变影像学研究工作。
查云飞,E-mail:zhayunfei999@126.com
湖北省自然科学基金资助项目(2013CFB242);湖北省卫生厅科研资助项目(JX6B68)
·实验研究·
R445.2; R738.1; R738.6
A
1000-0313(2015)04-0313-06
10.13609/j.cnki.1000-0313.2015.04.004

