一株猪链球菌的分离鉴定
刘平平 (山东滨州沃华生物工程有限公司 滨州 256606)许瑞利 (山东省枣庄市市中区畜牧兽医局)
试验研究
一株猪链球菌的分离鉴定
刘平平(山东滨州沃华生物工程有限公司滨州256606)
许瑞利(山东省枣庄市市中区畜牧兽医局)
摘要从河北某猪场送检的一份病猪病料中分离出1株链球菌,革兰氏染色表现为G+球菌,该菌在普通琼脂绵羊血平板上形成圆形、乳白色、表面光滑整齐、具有溶血环的小菌落,通过对该菌进行细菌16SRNA、PCR扩增,测序结果表明分离菌是一链球菌,对该分离菌株的毒力因子检测中发现,其荚膜多糖CPS2J+、gdh+、sly+、epf+、mrp+均为阳性、该菌一定剂量对小白鼠有致死性,对阿莫西林、青霉素、复方新诺明比较敏感,对四环素耐药。该结果对今后该猪场猪链球菌病的临床防治具有一定的指导意义。
关键词链球菌分离鉴定
猪链球菌(Streptococcus suis,SS)可以导致猪的急性败血症、关节炎、脑膜炎、心内膜炎及急性死亡[1-2],该病主要通过伤口、消化道导致人的发病甚至死亡,该病原菌对外界环境抵抗力相对较强,在4℃到8℃冷藏猪肉中可以存活一个多月,常温下在粪便中1周仍可存活,在众多亚型猪链球菌中,2型猪链球菌其致病性较强,对人畜危害巨大[3, 4],一旦感染发病,若治疗不及时对人畜的致死率很高,典型案例是于2005年发生于四川省资阳市的猪链球菌疫病不仅在短时间内使大量育肥猪死亡,经济上蒙受极大的损失,而且造成了多例人感染链球菌并致人死亡事件,因此此菌是危害我国生猪养殖业及人类公共卫生的一种重要的人畜共患病病原菌[5, 6],本试验从河北省某猪场一病猪病料中分离到一株2型猪链球菌,并对该分离菌进行了相关毒力基因的PCR检测、药敏试验、小鼠的致病性试验等初步研究。
1 材料与方法
1.1材料
1.1.1病料河北省某猪场的疑似链球菌病病死猪剖检病料。
1.1.2试剂改良马丁肉汤、营养琼脂;细菌DNA提取试剂盒购自TianGen公司,PCR相关试剂均购自宝生物(大连)有限公司;抗生素药敏纸片购自北京天坛生物技术有限公司,细菌生化反应管购自杭州天和微生物试剂有限公司;普通营养琼脂绵羊血平板、按常规方法制备。
1.1.3试验动物昆明白小鼠20只,体重18g左右,购自山东省实验动物中心。
1.2方法
1.2.1细菌的常规分离及生化特点生物安全柜内将病料样品用划线接种于普通琼脂绵羊血平板,于37℃培养36h后观察其菌落特点,挑取疑似链球菌菌落染色、镜检观察细菌形态。将分离菌株分别接种于各个细菌生化微量反应管, 37℃培养条件下观察生化反应特点。
1.2.2玻片凝集试验将疑似菌落接种改良马丁肉汤,于37℃培养12h,取0.5ml培养物,经5000r/min离心2min,弃上清,用70μl的无菌pbs悬浮沉淀,取20μl菌体悬浮液分别与等体积的无菌pbs、猪链球菌2型阳性血清做玻片凝集试验,其中无菌pbs作为阴性对照并观察阴性对照是否成立。
1.2.3猪链球菌的PCR鉴定及毒力因子检测取细菌培养物1 ml离心取沉淀,使用DNA提取试剂盒提取基因组DNA备用,细菌16S RNA通用引物为本实验室保存、链球菌毒力因子鉴定参照文献[7-10]及NCBI上部分基因序列,相关引物由生工生物工程上海有限公司合成见表1,细菌16S RNA扩增PCR产物送生工测序。(1)细菌16S RNA扩增条件为:Taq酶0.5μl、10×PCR Buffer 5μl、dNTP Mixture 4μl、16S rDNA上下游引物各1μl、提取模板1μl,加无菌水至50μl,分型扩增参数为:95℃预变性5min,94℃变性45s,55℃退火50s,72℃延伸80s,30个循环,最后72℃延伸8min。(2)猪链球菌毒力因子2型荚膜多糖CPS2J加样体系为:Taq酶0.5μl、10×PCR Buffer 5μl、dNTP Mixture 4μl、cps2J-F、cps2J-R各1μl、提取模板1μl,加无菌水至50μl,分型扩增参数为:95℃预变性5min,94℃变性45s,55℃退火45s,72℃延伸45s,32个循环,最后72℃延伸8min。(3)猪源链球菌毒力因子溶血素基因sly PCR鉴定反应体系为:Taq酶0.5μl、10×PCR Buffer5μl、2.5mmol/L的dNTP Mixture 5μl、sly基因上下游引物各0.5μl、模板DNA1μl、加无菌水至50μl,扩增参数为:95℃预变性5min,94℃变性45s,51℃退火45s,72℃延伸45s,32个循环,最后72℃延伸8min;gdh、epf、mrp各个反应体系同sly。
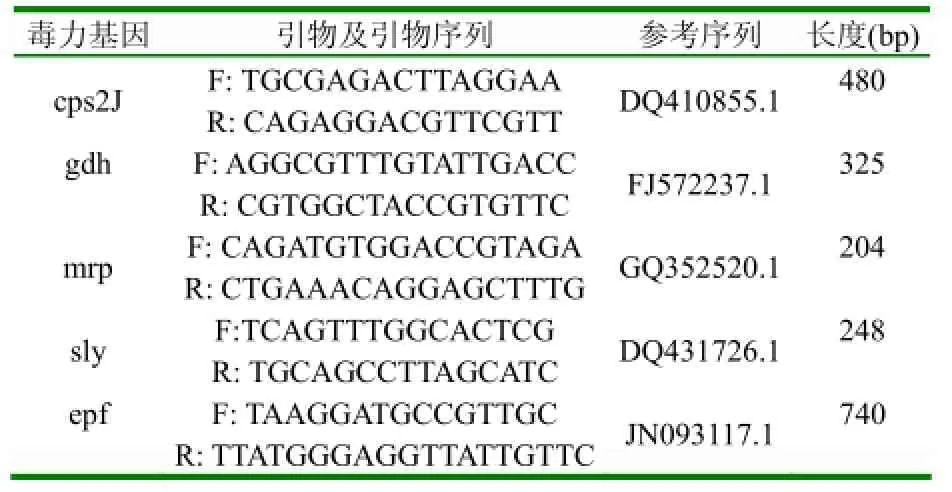
表1 引物序列及长度
1.2.4对小鼠致死性试验将该分离菌接种到改良马丁肉汤培养基中,37℃恒温培养36h(含菌量约为2.0×108CFU/ml)。20只昆明白小鼠分成4组,每组5只,分别腹腔接种1.0×106、1.0×107及1.0×108细菌培养物,同时取1组小鼠作对照,腹腔接种0.5ml无菌培养基。腹腔注射该分离菌后小鼠隔离饲养,观察其发病、死亡情况。
1.2.5药敏试验将分离株细菌马丁肉汤培养物用灭菌PBS稀释后均匀涂布150μl于普通琼脂平板,摇匀后用灭菌枪头吸出多余菌液,选取相应抗生素阿莫西林、青霉素、红霉素、等常用抗菌药物,药敏纸片轻轻放在固体平板上,37℃培养24h后观察并判定结果。
2 结果
2.1细菌的常规分离及生化特点
经37℃培养24h候后在普通琼脂绵羊血平板上形成小圆形、乳白色、菌落表面光滑整齐、边缘相对整齐的菌落、菌落周围出现明显的溶血环如图1和图2。染色为典型革兰氏阳性球菌,生化试验表明该链球菌菌可以发酵乳糖、蔗糖、葡萄糖、七叶苷,不发酵山梨糖、山梨醇、甘露醇、等,VP阴性,MR检测阳性。
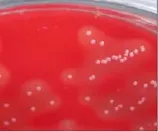
图1 分离菌划线血平板1
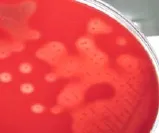
图2 分离菌划线血平板2
2.2玻片凝集试验
分离株与猪链球菌2型阳性血清玻片凝集试验为阳性,阴性对照成立。
2.3猪链球菌PCR分型鉴定及毒力因子检测
分离菌16SRNA扩增见图3,目的片段大小为1500bp,PCR产物测序表明该分离菌是一猪链球菌;毒力因子PCR检测结果如图4,荚膜多糖CPS2J片段大约480bp、胞外因子epf片段大约740bp、溶血素sly基因片段大约248bp、谷氨酸脱氢酶gdh片段大约为325bp、溶菌酶释放蛋白mrp片段大约为204bp。将扩增阳性的PCR产物分别回收后送生工测序,测的序列与NCBI上公布的序列比较后进一步确定为2型猪链球菌。
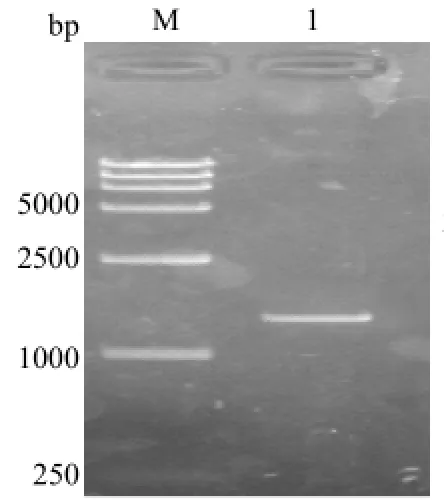
图3 分离菌16S RNA鉴定M1: DL15000; 2:16S RNA PCR产物
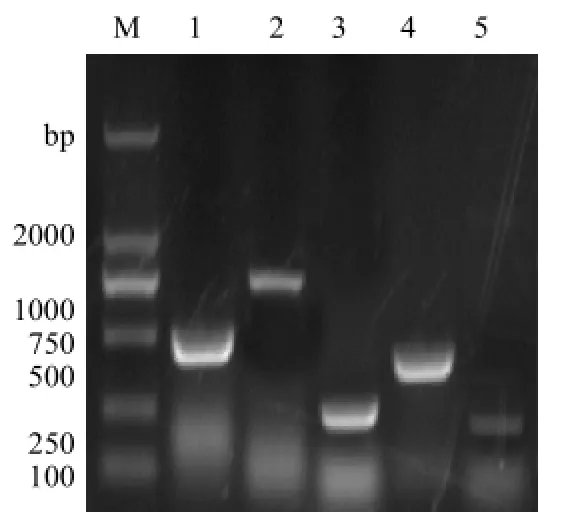
图4 猪链球菌毒力基因PCR扩增结果
2.4对小鼠致死性试验
攻毒16h后,河北分离株1.0×106剂量死亡1只、1.0× 107攻毒组死亡4只,1.0×108全部死亡,空白对照组5只小白鼠全部健在,由此可见此分离菌在1.0×107剂量对小鼠有致死性。
2.5药敏试验
分离菌株对阿莫西林、青霉素、复方新诺明、红霉素、卡那霉素等抗菌药中度敏感,对四环素耐药。
3 讨论
本试验分离到的猪链球菌是从脾脏中分离到的,病猪死前呈典型的猪链球菌病症状,在毒力因子的PCR检测中发现该链球菌分离株的溶血素基因sly、胞外因子ef及溶菌酶释放蛋白mrp三个毒力因子均为阳性,且小白鼠致病性试验表明此分离菌具有一定的毒力,药敏试验表明该分离株对青霉素、复方新诺明、红霉素等抗菌药敏感,在治疗时选择这些抗生素取得的治疗效果较好,此菌的分离鉴定为自家灭活菌苗的制备提供了候选菌株,为今后该猪场猪链球菌病的防治提供了一定的参考价值。
参考文献
[1] 张连范, 金玉江, 刘东东等. 一例猪链球菌病的诊治[J]. 吉林畜牧兽医, 2013, 34(7): 31~32.
[2] 刘俊伟, 司红英, 韩天河等. 猪链球菌病的诊断与治疗[J]. 贵州农业科学, 2009, 37(1): 120~122.
[3] 李美霞, 杨智聪, 汤国球等. 广州市2例人感染猪链球菌病的流行病学调查[J]. 热带医学杂志, 2009, 9(12): 1438~1439.
[4] Muckle A, López A, Gottschalk M, et al. Isolation of Streptococcus suis from 2 lambs with a history of lameness[J]. Can Vet J, 2014, 55(10): 946~949.
[5] Sánchez Del Rey V, Fernández-Garayzábal JF, Bárcena C, et al. Molecular typing of Streptococcus suis isolates from Iberian pigs:A comparison with isolates from common intensively-reared commercial pigbreeds[J]. Vet J, 2014, 202(3): 597~602.
[6] Huong VT, Hoa NT, Horby P, et al. Raw pig blood consumption and potential risk for Streptococcus suis infection, Vietnam[J]. Emerg Infect Dis, 2014, 20(11): 1895~1898.
[7] 宦海霞, 黄莉莉, 张科等. 猪链球菌多样性及其致病因子研究进展[J]. 中国畜牧兽医,2014, 41(2): 218~223.
[8] 马建华, 魏建忠. 猪链球菌毒力因子研究进展[J]. 动物医学进展,2014, 35(8): 95~99.
[9] Nutravong T, Angkititrakul S, Jiwakanon N, et al. Identification of major Streptococcus suis serotypes 2, 7, 8 and 9 isolated from pigs and humans in upper northeastern Thailand[J]. Trop Med Public Health, 2014,45(5): 1173~1181.
[10] Boyle B, Vaillancourt K, Bonifait L, et al. Genome sequence of the swine pathogen Streptococcus suis serotype 2 strain S735[J]. J Bacteriol,2012, 194(22): 6343~6344.
中图分类号:S852.61+1
文献标识码:A
文章编号:1007-1733(2015)04-0001-03
收稿日期:(2015-01-19)

