卵母细胞玻璃化冷冻对早期胚胎发育潜能和卵母细胞特异性基因表达的影响
郎婧雯,孙贻娟,谷瑞环,冯云*
(1.上海交通大学医学院附属瑞金医院生殖医学中心,上海 200025;2.上海集爱遗传与不育诊疗中心,上海 200011)
配子和胚胎冷冻技术是生育力保存和辅助生殖领域的重要组成部分,其中卵母细胞玻璃化冷冻技术的成功应用不仅对人类辅助生育技术的完善和发展有重要意义,对核移植工程[1]和珍稀物种生殖资源[2]的保存亦有重要推进作用。卵母细胞因其体积大、含水量多、核无核膜包绕保护、膜的渗透性低等特点,使其成为最难成功冷冻的细胞类型,冻融过程和玻璃化冷冻保护剂本身均会对卵母细胞内部超微结构及附属结构(如透明带、纺锤体、细胞骨架等)带来一定损伤,进而影响复苏率、体外受精后的受精率及早期胚胎发育潜能[3]。国内外在卵母细胞冷冻技术领域的研究多集中于比较两种冷冻方法(程序化慢速冷冻及玻璃化冷冻)或不同冷冻载体的冷冻效率、冷冻复苏体系的建立和改进等方面[4],针对冷冻技术对卵母细胞产生影响的具体机制如基因表达、表观遗传修饰等方面则研究较少。卵母细胞特异性发育相关基因是一类卵母细胞内特有的、参与卵泡生成与成熟、受精与早期胚胎发育过程的关键基因[5]。而目前国内外将这类基因表达结合玻璃化冷冻技术的研究很少。本实验将成熟期(MII)卵母细胞分别行冷冻-复苏液处理和玻璃化冷冻-复苏,与新鲜MII卵母细胞比较体外受精后早期胚胎发育情况及卵母细胞特异性发育相关基因H1foo、Bmp15、Gdf9、Sohlh2、Nobox表达水平,探索玻璃化冷冻-复苏液毒性及冷冻-复苏技术对小鼠成熟期卵母细胞体外受精后早期胚胎发育潜能及卵母细胞特异性发育相关基因表达的影响。
材料和方法
一、材料
1.实验动物:清洁级性成熟期健康C57BL/6小鼠,雌性5~6周龄,体重16~18g;雄性3~4月龄,体重大于29g。由上海交通大学医学院附属瑞金医院动物房提供并饲养,自由摄食饮水,光照12h/d,饲养条件符合国家实验动物标准。
2.主要试剂:蔗糖、二甲亚砜(DMSO)、乙二醇(EG)购自Sigma公司,HTF、mHTF、CSC、SSS胚胎培养液购自美国Irvine.Sci公司,孕马血清促性腺激素(PMSG)购自宁波第二激素厂,人绒毛膜促性腺激素(HCG)购自杭州动物药品厂,FastQuant RT Kit(with gDNase)购自天根生化科技有限公司,Sybr green(SYBR Select Master Mix)购自美国Applied biosystems Inc公司。
二、方法
1.小鼠超排卵与取卵:雌性5~6 周龄小鼠腹腔注射PMSG 10IU,48h 后腹腔注射HCG 10IU,13~14h后颈椎脱臼处死,剖腹取出膨大的输卵管壶腹部至预热37 ℃的mHTF(10%SSS)滴中,迅速用5 号针头捡出卵母细胞黏液团,透明质酸酶脱去颗粒细胞后,挑选已释放第一极体的成熟期卵母细胞,并随机分为三组:新鲜-复苏液处理组,玻璃化冷冻复苏组及新鲜-对照组。新鲜-对照组卵母细胞于37 ℃恒温培养箱培养1h,备用。
2.玻璃化冷冻:(1)玻璃化冷冻-复苏液的配制:以mHTF(10%SSS)为基础液配制冷冻液(V)及复 苏 液(T)。平 衡 液(ES):7.5%EG+7.5%DMSO;冷 冻 液(VS):15%EG +15%DMSO +0.5mol/L蔗糖;复苏液WS1:1mol/L 蔗糖;WS2:0.5mol/L 蔗糖;WS3:0.25 mol/L 蔗糖;WS4:单纯基础液。(2)新鲜-复苏液处理组:每一次将5~7枚卵母细胞移入ES微滴(室温)中,平衡6~8min待细胞形态恢复后移入VS微滴,并在60s内两次置换VS微滴以快速渗透平衡,后直接将卵母细胞置入预热37 ℃的WS1 微滴平衡1 min,按WS2、WS3、WS4顺序分别平衡3min。将冷冻-复苏液处理后的卵母细胞移回HTF 微滴,弃去未能存活的卵母细胞,余置于37 ℃培养箱培养2h,备用。(3)玻璃化冷冻-复苏组:按上述方法将本组卵母细胞通过ES、VS后迅速将含有卵母细胞的液滴吹至冷冻载体cryotop顶端薄膜上,迅速投入液氮。从卵母细胞置入VS液至投入液氮的时间控制在60s内。复苏时,将载体迅速从液氮中拿出,即刻将薄膜顶端浸入预热37 ℃的WS1 中1 min,此后步骤如前所述。
3.体外受精-胚胎培养:(1)精子采集和体外获能:雄鼠颈椎脱臼处死,取附睾末端组织放入已平衡HTF(10%SSS)微滴中,挤压附睾尾以释放精子团,取适量精子团移入另一平衡后油封HTF(10%SSS)微滴中,37 ℃、5%CO2获能1~1.5h。(2)体外受精和胚胎培养:吸取获能液外层移入卵母细胞培养滴中进行体外受精,浓度调整至(3~4)×106/ml,8h后将受精后卵母细胞移出,HTF 液置换两次洗脱颗粒细胞及外周精子,将受精卵移至平衡后的HTF(10%SSS)微滴中培养。受精后24h观察2-细胞出现情况,统计发育至2-细胞胚胎占进行受精的卵母细胞比例。并将胚胎移入平衡后的CSC(10%SSS)微滴中。受精96h 后观察囊胚出现情况,计算各组发育至囊胚阶段胚胎占已卵裂胚胎的百分比作为囊胚率。
4.卵母细胞特异性基因的mRNA 表达测定:RNA 抽提及逆转录反应均在专用PCR 实验室完成,冰上操作,并尽量缩短操作时间。(1)总RNA的提取:MII期卵母细胞以5枚为一组进行一次反应,采用Zymo公司生产的Quick-RNA Microprep试剂盒,参照试剂盒说明书步骤进行总RNA 提取。RNA 沉 淀 物 在 室 温 下 干 燥6 min 后 用0.01%DEPC水溶解,取部分样品经紫外分光光度仪检测RNA 含量和纯度,OD260/OD280应大于1.80。(2)cDNA 的 制 备:按 照FastQuant RT Kit 试 剂 盒(TIANGEN 公司)说明书步骤将抽提RNA 进行逆转录获得cDNA。(3)PCR 引物设计及合成:引物设计参照文献报道的方法[6],以β-actin为内参,引物由上海生工生物工程股份有限公司设计合成。引物序列见表1。(4)实时荧光定量聚合酶链反应(Real—time RT-PCR):以全转录扩增cDNA 2μl、稀释至2.5 mmol/L 的引物1.5μl、SYBR®Green PCR Master Mix(ABI公司)5μl、H2O 1.5μl构建10μl反应体系,每个样本的每个基因PCR 反应均设置副孔,将上样后的384 孔板置于PCR 仪(7900HT Fast Real Time PCR system,ABI)内,反应条件为95℃10min,95℃15s,60℃60s40个循环。循环结束后,完成溶解曲线图。(5)实时荧光定量分析:采用相对定量法进行分析。以每样本内参β-Actin Ct值为参照,每待测基因计算相对Ct值:△Ct待测=Ct待测—Ctactin,以2-△Ct待测为统计量比较组间差异。Western-blot测定蛋白表达:将每组50枚MII期卵母细胞快速移入30μlRIPA 中裂解,每管样品加入10μl 4×SDS裂解液,100 ℃水浴煮沸4-5min,-20 ℃保存。蛋白采用SDS-聚丙烯酰胺凝胶电泳分离,在80V、5%积层胶中电泳30 min,进入12%分离胶后,120V 电泳90min,100V 恒压电转移1.5h至硝酸纤维膜(NC)上,电转后将NC 膜置于含5%脱脂奶粉的TBST 中,室温封闭2h。将膜在TBST 中洗涤3 遍,每遍5 min。将兔抗鼠多克 隆 抗 体Anti-H1foo antibody(sc-99918,Santa Cruz,INC)以1∶500 比 例 稀 释 于 含5%BSA 的TBST 中,与NC 膜在4 ℃共孵育过夜。将过夜后的NC 膜与1∶2000 稀释后的山羊抗兔荧光二抗(LI-COR,美国)室温下共孵育1h。TBST 洗涤3遍后,应用Odyssey蛋白电泳扫膜仪(LI-COR,美国)进行扫膜。
三、统计学分析
采用SPSS 19.0软件进行统计学处理,计数资料行χ2检验,计量资料行方差分析,P<0.05具有统计学意义。
结 果
一、三组MII卵母细胞体外受精后2-细胞率及囊胚率的比较
应用冷冻-复苏液处理后的卵母细胞体外受精后,其2-细胞率(卵裂率)与囊胚率分别为77.42%及56.25%,与新鲜-对照组2-细胞率(81.25%)及囊胚率(57.7%)相比无统计学差异。而玻璃化冷冻复苏组的卵母细胞体外受精后,其2-细胞率(63.93%)较新鲜-对照组及新鲜-复苏液处理组均显著下降(P<0.05),而囊胚率(53.84%)较新鲜-对照组及新鲜-复苏液处理组有下降趋势,差异无统计学意义(表2)。

表1 基因名称、引物序列、Genebank收录号
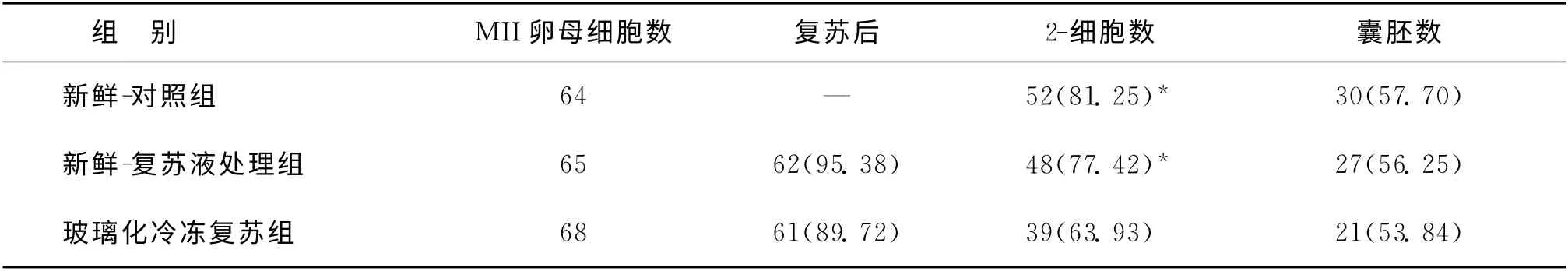
表2 三组MII卵母细胞体外受精后2-细胞率及囊胚率[n,(%)]
二、各卵母细胞特异性基因mRNA 相对表达量的比较
以5枚MⅡ卵母细胞为一个样本,每实验组取8个样本,对组间相对表达量行独立样本t检验,发现H1foo亚型H1foo-α在玻璃化冷冻复苏组的表达显著低于新鲜-复苏液处理组及新鲜-对照组(P<0.05),而另一亚型H1foo-β及其他四个卵母细胞特异性基因Bmp15、Gdf9、Sohlh2和Nobox的mRNA 表达在组间无显著差异。应用GraphPad Prism 软件做图结果如下(图1~5)。
三、H1foo两个亚型在新鲜-对照组和玻璃化冷冻复苏组MⅡ卵母细胞中蛋白表达的比较
每组以50 枚MⅡ卵母细胞作为一个样本,对H1foo两个亚型进行Western blot检测,并以β-actin作为内参。扫膜后每组均在42kD和37kD处有两条显影带(α、β亚型),其中玻璃化冷冻复苏组卵母细胞的H1foo-α蛋白表达显著低于新鲜-对照组卵母细胞,而另一亚型H1foo-β在两组间的表达则无显著差异(图6)。

图1 H1foo(卵母细胞特异性组蛋白)两亚型mRNA 在新鲜-对照组、新鲜-复苏液处理组、玻璃化冷冻复苏组卵母细胞中的表达
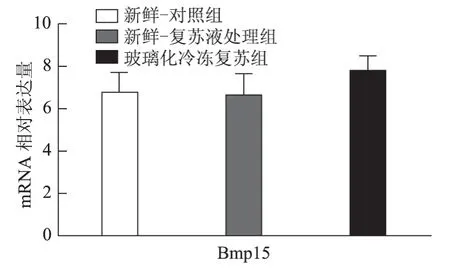
图2 Bmp15(骨形态发生蛋白15)mRNA 在新鲜-对照组、新鲜-复苏液处理组、玻璃化冷冻复苏组卵母细胞中的表达

图3 Gdf9(生长分化因子9)mRNA 在新鲜-对照组、新鲜-复苏液处理组、玻璃化冷冻复苏组卵母细胞中的表达
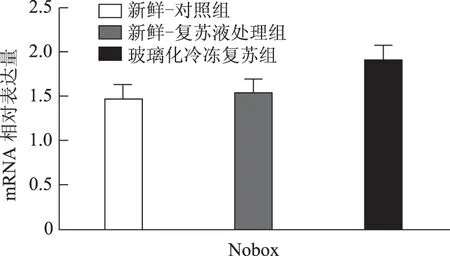
图4 Nobox(新生卵巢同源基因)mRNA 在新鲜-对照组、新鲜-复苏液处理组、玻璃化冷冻复苏组卵母细胞中的表达
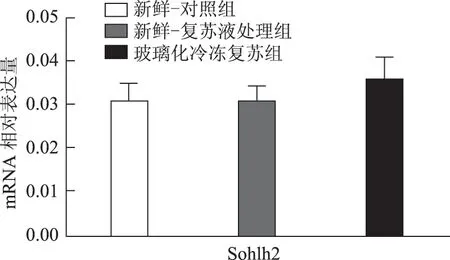
图5 Sohlh2(精卵结合生成碱性螺旋蛋白2)mRNA在新鲜-对照组、新鲜-复苏液处理组、玻璃化冷冻复苏组卵母细胞中的表达

图6 新鲜-对照组和玻璃化冷冻复苏组MⅡ卵母细胞中H1foo两亚型蛋白的表达
讨 论
近年来,人类辅助生育技术在我国迅速发展,其中胚胎及卵母细胞的冷冻保存是该领域的一项重要成就。目前,胚胎冷冻保存的技术已较为成熟并常规应用于临床工作,而卵母细胞冷冻技术的成熟与冻卵所获子代安全性问题仍是该领域发展的重点和难点[7]。卵母细胞因其体积大、所含水分多、膜渗透性低等特点及冷冻过程中的冰晶形成,使其冻融复苏率较低、复苏后体外受精所获胚胎发育潜能受到影响[8]。孙贻娟等[9]对10例患者86枚卵母细胞冻存后ICSI受精率及获胚率等进行统计,发现卵母细胞玻璃化冷冻后受精率和卵裂率未显著下降,但是优质胚胎比率低,临床妊娠率也较新鲜卵母细胞低。Liang等[10]在玻璃化冷冻对卵母细胞及早期胚胎甲基化模式改变的研究中发现,小鼠卵母细胞玻璃化冷冻复苏后2-细胞胚胎率(62.28%)及囊胚率(43.68%)较 新 鲜 卵 母 细 胞 显 著 下 降(81.47%,61.99%)。因此,找到冷冻技术对卵母细胞产生影响的具体环节和机制是完善该技术的重要前提和依据。本实验除新鲜-对照组及玻璃化冷冻复苏组外,加入了单纯新鲜-复苏液处理组,将玻璃化冷冻技术分两个阶段进行研究,发现复苏液处理后其卵裂率及囊胚率较新鲜-对照组未见显著下降,而玻璃化冷冻复苏组卵母细胞复苏后2-细胞率较新鲜-对照组及新鲜-复苏液处理组显著下降,囊胚形成率与其他两组比较则无显著差异。本实验的结果显示玻璃化冷冻技术对卵母细胞及其早期胚胎发育造成不良影响(卵裂率下降),这一影响发生在投入液氮至复苏这一阶段,而非由复苏液毒性所造成。而卵裂胚向囊胚发育这一过程则未因卵母细胞冷冻而被抑制,考虑原因为:小鼠胚胎自2-细胞起进入中囊胚转化期(MBT),胚胎的发育由母型基因控制向合子基因控制过渡[11],即2-细胞前胚胎的发育受卵母细胞基因调控,玻璃化冷冻技术如若对卵母细胞基因表达或发育潜能产生影响,则这种影响主要发生在卵母基因控制发育期间,后期胚胎发育则主要由合子基因调控。
卵母细胞特异性基因是一类在卵母细胞或卵丘细胞中特异表达、与卵母细胞及早期胚胎发育密切相关的关键基因,其功能涉及转录控制、DNA 空间构象、表观遗传修饰等,贯穿卵母细胞从GV 向MII发育成熟及受精后早期胚胎发育的全过程[5]。转化生长因子β(TGFβ)超家族成员骨形态发生蛋白15(Bmp15)和生长分化因子9(Gdf9)对早期卵泡发育、颗粒细胞和膜细胞功能起重要调控作用,是卵巢内重要的旁分泌因子[12],魏莉娜等[13]对ICSI助孕者卵丘细胞内Gdf9 及Bmp15mRNA 表达进行检测,发现二者表达水平与卵母细胞成熟率、正常受精率、卵裂率均呈显著正相关;新生卵巢同源基因(Nobox)及精卵结合生成碱性螺旋蛋白2(Sohlh2)则通过调控转录影响卵母细胞质量[14,15]。H1foo是哺乳动物各期卵母细胞及早期胚胎中持续表达的连接组蛋白,存在α、β两亚型,在卵母细胞减数分裂的完成、受精时精子染色质重构、早期胚胎发育及体细胞核移植过程中基因表达、染色质表观遗传修饰等方面具有不可替代的作用。目前越来越多的研究开始以H1foo的表达情况作为衡量卵母细胞质量和早期胚胎发育潜能的标准之一[16]。本实验选取上述五个卵母细胞特异性发育相关基因对三组卵母细胞进行mRNA表达量的检测发现,复苏液处理后及玻璃化冷冻复苏后卵母细胞中Bmp15、Gdf9、Sohlh2、Nobox及H1foo-β亚型的mRNA 表达水平较新鲜卵母细胞并无显著改变,H1foo-α亚型则在冷冻复苏后显著下降,这一变化在蛋白水平也通过Western-blot得到了印证。本实验显示玻璃化冷冻-复苏这一过程使卵母细胞内H1foo-α的mRNA及蛋白表达量显著下降,而H1foo恰是自2-细胞起逐渐被体细胞型H1替代[17],其功能主要在卵母细胞及2-细胞前胚胎发挥。与上一实验结果结合分析可发现,卵母细胞玻璃化冷冻可能通过降低卵母细胞特异性组蛋白H1foo-α表达水平,进而影响其在受精至2-细胞胚胎这一发育过程中的作用发挥,最终使2-细胞胚胎率下降。
本实验从基因表达层面对玻璃化冷冻技术安全性进行了研究,但其中具体机制及通路尚需通过干预实验进一步探索。2012年9月ARSM(美国生殖医学协会)颁布了成熟卵母细胞冷冻保存指南,摘下了卵母细胞冻存“试验性技术”的标签[18],该技术成为辅助生殖及女性生育力保存的常规技术已指日可待。而玻璃化冷冻对卵母细胞、胚胎甚至子代的影响仍需更多基础研究和机制探索,以期为该技术的完善和成熟提供科学依据和指导。
[1] Pukazhenthi BS,Wildt DE.Which reproductive technologies are most relevant to studying,managing and conserving wildlife[J].Reprod Fertil Dev,2004,16:33-46.
[2] Ana C,Garcia-V,Javier D,et al.Is vitrification of oocytes useful for fertility preservation for age-related fertility decline and in cancer patients[J].Fertil Steril,2013,99:1485-1495.
[3] Meng Y,Liu XH,Ma X,et al.The protein profile of mouse mature cumulus-oocyte complex[J].Biochim Biophys Acta,2007,1774:1477-1490.
[4] 袁水桥,杨瑞峰,周生来,等.冷冻平衡液及保护剂的不同组合对小鼠未成熟卵母细胞OPS法冷冻效果的影响[J].生殖医学杂志,2009,18:548-550.
[5] Ping Z, Jurrien D.Oocyte-Specific Genes Affect Folliculogenesis,Fertilization,and Early Development[J].Semin Reprod Med,2007,25:243-251.
[6] Nadkarni MA,Martin FE,Jacques NA.Determination of bacterial load by real-time PCR using a broad-range(universal)probe and primers set[J].Microbiology,2002,148:257-266.
[7] Potdar N,Gelbaya TA,Nardo LG.Oocyte vitrification in the 21st century and post-warming fertility outcomes:a systematic review and meta-analysis[J/OL].Reprod Biomed Online,2014,29:159-176.
[8] Arav A.Cryopreservation of oocytes and embryos[J].Theriogenology,2014,81:96-102.
[9] 孙贻娟,冯云,陆小溦,等.人成熟卵母细胞玻璃化冷冻技术的临床应用[J].中国优生与遗传杂志,2012,20:110-113.
[10] Liang Y,Fu XW,Li JJ,et al.DNA methylation pattern in mouse oocytes and their in vitro fertilized early embryos:effect of oocyte vitrification[J].Zygote,2014,22:138-145.
[11] Maeda C,Sato S,Hattori N,et al.DNA hypomethylation circuit of the mouse oocyte-specific histone H1foo gene in female germ cell lineage[J].Biol Reprod,2008,78:816-821.
[12] Lves AM,Chaves RN,Rocha RM,et a1.Dynamic medium containing growth differentiation factor9and FSH maintains survival and promotes in vitro growth of caprine preantral follicles after long-term in vitro culture[J].Reprod Fertil Dev,2013,25:955-965.
[13] 魏莉娜,李俐琳,方丛,等.卵丘细胞生长分化因子9mRNA和骨形态蛋白15mRNA 水平非侵入性评估卵子发育潜能[J].实用妇产科杂志,2014,30:609-613.
[14] Rajkovic A,Pangas SA,Ballow D,et al.NOBOX deficiency disrupts early folliculogenesis and oocyte-specific gene expression[J].Science,2004,305:1157-1159.
[15] Choi Y,Yuan D,Rajkovic A.Germ cell-specific transcriptional regulator Sohlh2is essential for early mouse folliculogenesis and oocyte-specific gene expression[J].Biol Reprod,2008,79:1176-1182.
[16] 郎婧雯,孙贻娟,冯云.卵子特异性连接组蛋白H1foo在卵子与早期胚胎发育中表达及功能的研究进展[J].生殖与避孕,2014,34:1009-1014.
[17] Teranishi T,Tanaka M,Kimoto S,et al.Rapid replacement of somatic linker histones with the oocyte-specific linker histone H1FOO in nuclear transfer[J].Dev Biol,2004,266:76-86.
[18] Practice Committees of American Society for Reproductive Medicine; Society for Assisted Reproductive Technology.Mature oocyte cryopreservation:aguideline[J].Fertil Steril,2013,99:37-43.

