D3非优质胚胎的冷冻价值及其临床结局分析
丁锦丽,杨菁*,张艳,张怡,徐望明,龙文
(1.武汉大学人民医院生殖医学中心,武汉 430060;2.华中科技大学同济医学院计划生育研究所,武汉 430030)
许多因素影响到体外受精-胚胎移植(IVF-ET)的结局,如妇女年龄、子宫内膜容受性及内膜与胚胎发育的同步性、移植胚胎的数量等[1-3],而胚胎质量是一个重要因素[4]。有研究报道约70%的患者在IVF-ET 过程中获得非优质胚胎[5],由于非优质胚胎的发育潜能较低,再利用的可能性不大,所以有的生殖中心选择将其丢弃。关于非优质胚胎的临床利用价值尚存在较大争议,有研究证实非优质胚胎经体外培养后可能发育成囊胚[6]。本研究分析了在我中心行非优质胚胎移植的135 个冻融胚胎移植(FET)周期,分析其临床结局及可能的影响因素,探讨非优质胚胎的冷冻/移植价值,为临床工作提供参考。
资料与方法
一、研究对象
收集2010年1月至2012年12月在武汉大学人民医院生殖医学中心144例行非优质胚胎FET夫妇的资料,并纳入2011年1月至2011年10月行优质胚胎FET 的202对夫妇作为对照。排除子宫肌瘤、子宫内膜异位症和其他可能影响胚胎着床的因素,如男方和/或女方染色体异常;排除供胚移植的患者。患者年龄21~43岁,不孕年限1~17年。
二、治疗方法回顾
1.促排卵及受精:采用我中心常规使用的短方案、长方案、超长方案促排[7]。超声检查发现有3个以上直径≥18mm 的卵泡时,予以5 000~10 000U剂量的HCG(雪兰诺,瑞士),36h后在阴道超声引导下采卵。根据男方精子质量决定自然受精或卵胞浆内单精子注射(ICSI)受精。
2.胚胎冻融及培养:采用本中心常规方案[8],选择正常受精第3天的胚胎冷冻保存。玻璃化法冷冻按试剂盒(Kitazato,日本)操作程序进行。胚胎解冻后继续培养18~24h,再行移植。按解冻试剂盒(Kitazato,日本)说明书解冻胚胎,再转入Quinn’s培养液(SAGE,美国)培养。
3.胚胎质量评估:D3、解冻后、移植时各评估1次。根胚胎形态学对胚胎进行分级:解冻前评估时包含6个以上均匀一致的卵裂球且细胞碎片小于20%的胚胎定义为优质胚胎[8],其余为非优质胚胎,包括大小不一的卵裂球5个(4或4以下)且胚胎碎片>20%的非优质胚胎,即5B(4B 或4B 以下)胚胎。
4.内膜准备及胚胎移植:内膜准备方案包括人工周期和自然周期。月经正常的患者于月经周期第11天阴道超声监测卵泡发育,当卵泡直径≥14mm时开始查血清促黄体生成素(LH),LH 峰值出现后3d行FET;对于月经不规则的患者于月经周期第2~3天行阴道超声监测,根据患者的个体情况决定戊酸雌二醇(补佳乐,先灵,德国)的起始用量,依激素水平调整补佳乐的用量,待超声监测内膜≥8mm时肌注黄体酮,具体用药参考本中心常规方案[8]。
根据患者年龄、内膜准备情况等决定移植胚胎数,一般为2~3枚。所有患者在移植后均肌注黄体酮行黄体支持及口服戊酸雌二醇。胚胎移植后14d检测血β-HCG>10U/L,2周后B超下见孕囊确定为临床妊娠。
三、分析指标
本项研究收集并分析了两组患者年龄、周期数、不孕年限、体重指数(BMI)、HCG 日子宫内膜厚度、移植胚胎数、着床数以及胚胎解冻后继续培养的结果等资料。
判断标准及计算方法:移植前50%以上胚胎卵裂球透亮为胚胎存活[5];移植时胚胎细胞数与D3胚胎细胞数一致或小于D3胚胎细胞数定义为胚胎未生长;移植时胚胎细胞数大于D3 胚胎细胞数或移植时发育为囊胚定义为胚胎继续生长;移植时形成囊胚的比例定义为形成囊胚的胚胎数/解冻后存活的胚胎数;胚胎种植率定义为超声扫描可见孕囊数/移植胚胎数;临床妊娠率定义为临床妊娠例数/总周期数;流产率为流产例数/临床妊娠例数。
四、统计学分析
应用SPSS 19.0统计学软件进行分析。计数资料结果以均数±标准差表示,计量资料以率表示。定量资料比较采用t检验,定性资料的比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、患者基础资料及临床结局
本项回顾性研究共纳入346个冻胚移植周期,其中,非优质组144个周期,优质组202个周期,两组分别取消了9个和8个周期。
两组间不孕年限、HCG 日内膜厚度、移植胚胎数均无统计学差异(P>0.05);非优质组女方年龄明显高于优质组(P<0.05)(表1)。
二、胚胎解冻后继续培养情况
非优质组胚胎解冻后存活率为95.86%(324/338),优 质 组 胚 胎 解 冻 后 存 活 率96.07%(464/483),组间无统计学差异(P>0.05)。两组因解冻及培养过程中胚胎溶解而取消周期的比例分别为6.25%和3.96%,组间无统计学差异(P>0.05)(表2)。
非优质胚胎解冻后存活324枚,其中卵裂球继续分裂的胚胎238枚(2枚发育为囊胚),86枚胚胎未生长;优质胚胎解冻后存活464枚,其中未生长胚胎72枚,19枚在移植时发育为囊胚。两组胚胎未生长比例(26.54%vs.15.52%)和移植时形成囊胚的比例(0.62%vs.4.10%)均有统计学差异(P<0.05)(表2)。
三、两组患者妊娠结局比较
135个非优质胚胎移植周期中,共移植322 枚胚 胎,种 植 率13.66% (44/322),临 床 妊 娠 率26.67%(36/135),流产率8.33%(3/36);194个优质胚胎移植周期中,共移植459 枚胚胎,种植率30.28%(139/459),临 床 妊 娠 率51.55% (100/194),流产率为7.00%(7/100)。两组间种植率、临床妊娠率均有显著差异(P<0.001),而组间流产率无显著差异(P>0.05)(表3)。
四、非优质胚胎的组成情况及其解冻结局
135个非优质胚胎移植周期中,共移植胚胎322枚,其中4B以下胚胎1枚,4B胚胎181枚,5B胚胎140枚。44枚胚胎着床。
5B组胚胎解冻后存活率显著高于4B 组(P<0.001);与4B胚胎组相比,5B胚胎组未生长胚胎的比例较低,而继续生长胚胎的比例较高,但无统计学差异(P>0.05)(表4)。4B组有2枚胚胎解冻培养后形成囊胚。
五、不同内膜准备周期对非优质胚胎移植临床结局的影响
135个非优质胚胎移植周期中,35个自然周期,100个人工内膜准备周期。人工与自然周期患者的年龄、不孕时间、BMI、移植胚胎数、妊娠率及种植率均无统计学差异(P>0.05)(表5)。
表1 两组患者基本资料(±s)

表1 两组患者基本资料(±s)
注:与非优质组比较,*P<0.05
组 别 年龄(岁)不孕时间(年)BMI(kg/m2)移植胚胎(枚)内膜厚度(cm)原发不孕(%)继发不孕(%)周期取消率(%)优质组 30.48±4.23* 4.79±3.60 21.85±3.11 2.37±0.57 0.85±0.14 48.45 51.55 3.96非优质组32.08±4.39 5.61±3.69 21.37±2.58 2.41±0.56 0.87±0.11 46.67 53.33 6.25

表2 胚胎解冻后继续培养情况[n(%)]

表3 患者临床结局[n(%)]
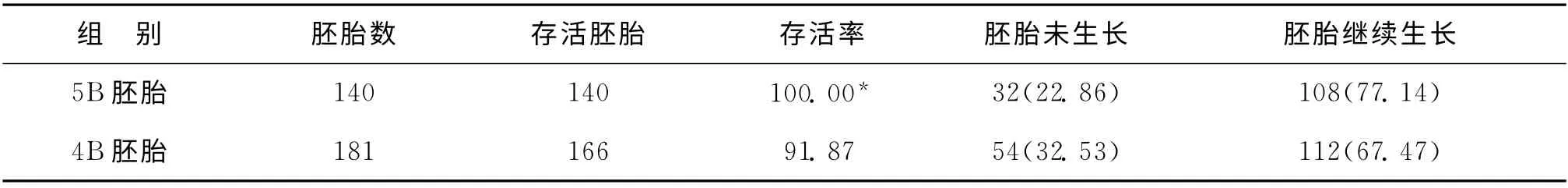
表4 非优质组胚胎的组成情况及解冻结局[n(%)]
表5 非优质组不同内膜准备方案的临床结局(±s)

表5 非优质组不同内膜准备方案的临床结局(±s)
组 别 周期数 年龄(岁) 不孕时间(年) BMI(kg/m2) 移植胚胎(枚) 种植率(%) 临床妊娠率(%)自然周期 35 32.86±2.66 5.91±3.85 21.00±2.40 2.37±0.4 9 14.63 28.57人工周期 100 31.81±4.61 5.50±3.65 21.50±2.64 2.42±0.59 13.33 26.00
讨 论
自1983年首例冷冻胚胎复苏后移植成功分娩活婴以来,FET 在辅助生殖技术中越来越受到重视,它不仅能在一定程度上避免中、重度卵巢过度刺激综合征的发生,还能提高累计妊娠率,减少患者经济负担[9-11]。影响FET 临床结局的因素有很多,包括胚胎的数目和质量、妇女年龄、患者子宫内膜的容受性等[1-3]。有研究表明,在所有因素中胚胎质量的影响最为显著[4]。优质冻胚的种植率显著高于非优质胚胎冻胚,非优质胚胎可能不能耐受冻存过程中降温及复温所带来的损伤[12],且发育潜能较差,所以有的中心选择将非优质胚胎丢弃。然而,对于年龄较大及获卵困难的患者来说,非优质胚胎的移植可能是其最好的助孕选择之一。
在本项研究中,优质胚胎移植患者的种植率及临床妊娠率均较非优质胚胎移植者高,且优质组移植时形成囊胚的比例也显著高于非优质组,这与国内学者研究结果一致[5,13]。在此项研究中,非优质组移植时形成囊胚的比例为0.62%,2枚非优质胚胎(均为4B 胚胎)发育为囊胚,其中1 例妊娠。表明D3形态学评价为非优质的胚胎部分仍具有发育至囊胚的潜能。
胚胎质量较好者耐受胚胎降温、复温损伤的能力更强[14],这可能是5B胚胎存活率显著高于4B胚胎的原因之一。此项研究结果表明,在非优质胚胎周期中,胚胎解冻后继续培养,5B 胚胎组的生长发育情况更好,而5B 以下胚胎继续发育的可能性很低,可能的原因是早期胚胎的发育依赖于胚胎型基因的激活和母源性遗传物质适时的表达,而2-细胞期是母型调控向合子型调控过渡的起始时期[15],因此我们推测5B以下胚胎因为早期卵裂没有适时发生,从而影响了胚胎的进一步发育。梁菊艳等[16]的研究表明,非优质周期中有囊胚形成的患者,其妊娠率显著高于无囊胚形成的患者,提示其胚胎有较好的发育潜能,妊娠失败的原因可能包括子宫内膜容受性、体内激素等方面。
本研究结果表明,解冻前评估为非优质的胚胎仍然有继续发育的潜力,移植后仍有着床、继续妊娠的可能,表明胚胎的发育潜能和胚胎形态并不完全一致。有研究证实胚胎形态学不能完全反映胚胎的质量,不能预测胚胎发育的潜能,形态学评分为优质胚胎的胚胎染色体异常的发生率高达25%[17]。我们的研究中4B以下的胚胎仅移植1枚,关于4B以下胚胎的发育潜能及冷冻价值需进一步研究。
胚胎移植的内膜准备包括自然周期和人工周期。关于不同内膜准备方案对FET 妊娠结局的影响存在争议,在本项研究非优质组中两种内膜准备方案的胚胎移植结局没有统计学差异。
年龄是显著影响女性生殖能力的一个因素[1],FET 患者妊娠率随着年龄的升高而下降[18]。在本研究中,非优质胚胎组患者的年龄显著高于优质组,年龄越大获得优质胚胎的几率越小。年龄对女性生殖能力的影响主要在于对卵母细胞质量以及子宫内膜容受性的影响[19-21]:年龄的增加使卵母细胞非整倍体发生率也增加,这可能与卵母细胞纺锤体、线粒体老化,细胞非极性增加,同源染色体不分离、姐妹染色单体过早分离等有关[19-20];且年龄的增加使子宫内膜发生一系列的变化,包括细胞中雌、孕激素受体的减少、内膜血流量的减少等,这些变化都可能使内膜容受性降低[21]。
总之,本研究表明,部分非优质胚胎有继续发育的潜能,患者行非优质胚胎移植后可能成功妊娠。由于胚胎形态学观察并不能完全客观准确地反映胚胎的发育潜能,因此,在辅助生殖过程中,对于年龄较大、卵巢功能减退、获得胚胎困难的患者,临床工作者应谨慎对待,在没有剩余胚胎的情况下,建议将其形态学评估为5B、4B 甚至更低质量的胚胎冷冻后移植,可以提高这些患者的累积妊娠率,改善临床结局。
[1] Lahav-Baratz S,Koifman M,Shiloh H,et al.Analyzing factors affecting the success rate of frozen-thawed embryos[J].J Assist Reprod Genet,2003,20:444-448.
[2] Urman B,Balaban B,Yakin K.Impact of fresh-cycle variables on theimplantation potential of cryopreserved-thawed human embryos[J].Fertil Steril,2007,87:310-315.
[3] Weissman A,Levin D,Ravhon A.What is the preferred methodfor timing natural cycle frozen-thawed embryo transfer[J/OL].Reprod Biomed Online,2009,19:66-71.
[4] Racowsky C,Combelles CM,Nureddin A.Day 3and day 5 morphological predictors of embryo viability[J/OL].Reprod Biomed Online,2003,63:23-31.
[5] 邓莲,李永刚,马艳萍,等.体外受精-胚胎移植中非优质胚胎的冷冻价值[J].生殖医学杂志,2012,21:230-232.
[6] Chen H,Qian K,Hu J.The derivation of two additional human embryonic stem cell lines from day 3embryos with low morphological scores[J]. Hum Reprod,2005,20:2201-2206.
[7] 余楠,杨菁,赵庆红,等.卵巢低反应患者不同剂量促性腺激素促排卵对体外受精结局的影响[J].中华临床医师杂志(电子版),2012,6:1019-1021.
[8] 肖卓妮,徐望明,杨菁.两种子宫内膜准备方法对玻璃化冻融胚胎移植妊娠结局的影响[J].中华临床医师杂志(电子版),2012,6:6898-6901.
[9] Alama P,Melo MA,Garcia G,et al.Higher ongoing pregnancy rates in blastocyst transfer of frozen-thawed embryos in natural cycles than in hormone replacement therapy cycles[J].Fertil Steril,2007,88:s161.
[10] Eftekhar M,Aflatoonian A,Mohammadian F,et al.Transfer of blastocysts derived from frozen-thawed cleavage stage embryos improved ongoing pregnancy[J].Arch Gynecol Obstet,2012,286:511-516.
[11] Ghobara T,Vandekerckhove P.Cycle regimens for frozenthawed embryo transfer[J/CD].Cochrane Database Syst Rev,2008,(1):CD003414.
[12] Kattrea S,Sbrivastav P,Craft I,et al.Comparison of pregnancy outcome of pronuclear and multieelllular-stage frozen-thawed embryo transfers[J].J Assist Reprod Genet,1999,16:358-362.
[13] 甄璟然,王雪,孙正怡,等.人类低质量卵裂期胚胎体外发育至囊胚能力的研究[J].生殖医学杂志,2011,20:253-256.
[14] 戴善军,孙莹璞,苏迎春,等.体外受精非优质胚胎冻融的临床价值[J].徐州医学院学报,2007,27:254-257.
[15] 谭兵兵,杨智敏,刁英.早期卵裂与胚胎形态学和生长速率联合评分预测胚胎发育潜能[J].中国妇幼保健,2007,22:2670-2672.
[16] 梁菊艳,王芳,孙莹璞,等.废弃胚胎继续囊胚培养研究[J].生殖与避孕,2008,28:598-601.
[17] Ziebe S,Lundin K,Loft A,et al.FSH analysis for chromosomes 13,16,18,21,22,X and Y in all blastomerse of IVF pre-embryos from 144randomly selected donated human oocytes and impact on pre-embryo morphology[J].Hum Reprod,2003,18:575-581.
[18] Wang JX,Yap YY,Matthews CD.Frozen-thawed embryo transferinfluence of clinical factors on implantation rate and risk of multipleconception[J].Hum Reprod,2001,16:2316-2319.
[19] Coco C,Jeanty P.Isolated fetal pyelectasis and chromosomal abnormalities[J].Am J Obstet Gynecol,2005,193:732-738.
[20] Pellestor F,Anahory T,Hamamah S.Effect of maternal age on the frequency of cytogenetic abnormalities in human oocytes[J].Cytogenet Genome Res,2005,111:206-212.
[21] Lim AS,Tsakok MF.Age realted dacline in fertility:a link to degenerative oocytes[J].Fertil Steril,1997,68:265-271.

