抗苗勒管激素与卵巢反应性及妊娠结局的相关研究
魏晓丽,周远征,邓成艳,何方方,郁琦,孙正怡,甄璟然
(1.中国医学科学院 北京协和医学院 北京协和医院 妇产科,北京 100730 2.北京怀柔医院妇产科,北京 101400)
体外受精-胚胎移植(IVF-ET)过程中,控制性卵巢刺激(COH)方案及卵巢刺激药物剂量的选择是保证成功的重要环节,而评估卵巢的储备功能、预测卵巢对药物的反应性是至关重要的第一步。卵巢对外源性促性腺激素(Gn)反应差意味着药物刺激卵巢后回收的卵母细胞数少,可供移植的胚胎数减少,从而影响妊娠率。抗苗勒管激素(AMH)仅由卵巢内的窦前及小窦卵泡的颗粒细胞分泌,AMH的血清水平与窦卵泡数量呈正相关[1],并且参与窦卵泡的募集。测定AMH 水平可以相对真实地反映原始卵泡库存情况,目前许多研究已证明AMH 可以更早、更准确的评估卵巢的储备功能[2-4]。关于AMH 在IVF-ET 过程中预测卵巢反应性及妊娠结局方面并没有统一观点[1-2,5]。在COH 过程中的不同时间点检测的AMH 水平能否更好地反应卵巢的反应性,以指导COH 过程中的用药剂量,及能否预测妊娠结局,都是目前关注的问题。因此,本文就此做进一步的研究,以期能找到一些答案。
资料与方法
一、病例来源
选择2009年3~9月期间因不孕症就诊于北京协和医院生殖医学中心的患者,共60 例。其中30例行短方案,30 例行长方案;平均年龄(31.92±5.02)岁(24~43岁),平均不育年限(4.3±3.4)年(1~17年)。
纳入标准:3个月内未接受过促性腺激素治疗;具有规律的月经周期(24~35d);基础FSH<11 U/L(包括以前出现过基础FSH 水平升高但进入治疗周期的FSH 正常);双侧卵巢均存在;体重指数(BMI)18~25kg/m2;无多囊卵巢综合征、高泌乳素血症及子宫内膜异位症,并排除全身其它系统疾病。
按不孕原因可分为:输卵管因素38例(63.3%),男 方 因 素24 例(40.0%),不 明 原 因 不 孕1 例(1.67%),男方因素合并输卵管因素6例(10.0%)。均经子宫输卵管碘油造影、腹腔镜、男方精液检查、睾丸或附睾穿刺证实。所有患者均知情同意。
二、实验方法
1.基础窦卵泡数(AFC)及激素水平检测:采用超声诊断仪频率50HZ,于月经第2~4天对所有参加研究的患者行消毒阴道超声检查。用二维超声观察双侧卵巢位置、形态、计数窦卵泡(直径2~10mm 的卵泡)。留取60例患者月经周期第2~4日、IVF周期注射Gn第5日及HCG 注射日清晨(大约8:00~9:00am)空腹静脉全血4 ml(要求无溶血,非高脂血),2h内离心2 000~3 000r/min,离心10min,分离出血清后装至0.5ml的EP管内,-20℃冰箱冻存待查。
血清 AMH 测定采用酶联免疫吸附法(ELISA),其他激素测定采用电化学发光免疫法。记录获卵数、成熟卵数、受精卵数、卵裂数及优质胚胎数。
2.控制性卵巢刺激(COH):采用本中心常规短方案及长方案。根据患者的年龄、基础FSH 值及AFC综合评估,来决定具体采用何种方案。一般对于年龄较大,卵巢功能不太好及窦卵泡数较少者采用短方案。
短方案:即从月经第2天开始皮下注射基因重组的FSH(果纳芬,瑞士雪兰诺),一般为300 U,qd,及促性腺激素释放激素激动剂醋酸曲普瑞林(达必佳,德国辉凌)0.1 U,qd;用药过程中根据卵泡的生长情况及激素(LH、E2)水平调整用药,待卵泡成熟时,肌肉注射HCG 10 000U(丽珠制药),约36h后取卵。取卵后实验室常规受精或卵胞浆内单精子注射。受精后第1天观察受精情况,第3天进行卵裂球胚胎评分,进行卵裂球移植。黄体期给予黄体酮支持,取卵后两周测血清HCG,确定妊娠两周后行阴道B 超,若宫腔可见妊娠囊则确定为临床妊娠。
长方案:月经周期第2~4 天开始服用避孕药(OC)1#qd×21d,在服用OC第18天时阴道超声检查无大卵泡则开始皮下注射促性腺激素释放激素激动剂醋酸曲普瑞林(达必佳)0.05Uqd或者0.1 U qd),达必佳一直用至HCG 日。待达必佳用到18 d时,即开始皮下注射基因重组的FSH 进行药物刺激卵巢。之后过程均同以上短方案。
三、分组标准及检测指标
1.卵巢反应性:根据获卵数分为卵巢低反应组(获卵数≤5 个)与正常组获卵数>5 个[6],并根据Golan 1989年推荐标准确定卵巢过度刺激综合征
(OHSS)。
2.临床妊娠:取卵后两周测血清HCG,确定妊娠两周后根据超声下是否见到妊娠囊诊为临床妊娠组与未妊娠组。
3.检测指标:激素水平、获卵数、成熟卵数、受精卵数、卵裂数及优质胚胎数。
四、统计学方法
结 果
一、不同COH 方案患者一般情况
COH 方案中长、短方案各有30例。短方案患者与长方案患者相比,年龄、基础FSH 值、AFC 均有统计学差异(P<0.05);基础LH、E2、不育年限及BMI均无统计学差异(P>0.05)(表1)。
在短方案治疗组中,有9 例患者曾出现基础FSH 水平升高的情况,既往基础FSH 为10.02~18.00U/L,平均值为(12.48±2.97)U/L,但进入治疗周期的基础FSH<11U/L。
二、卵巢不同反应组间的一般资料及AMH 水平比较
1.不同的卵巢反应组的一般情况比较:卵巢低反应组6例,正常反应组49例,OHSS组5例。年龄、BMI、基础FSH、E2组间差异均无统计学意义(P>0.05);AFC、获卵数、成熟卵数、受精卵数、卵裂数及优质胚胎数在组间均存在差异,低反应组<正常反应组<OHSS组,通过两两比较发现,除优质胚胎在正常反应组及OHSS组间无统计学差异(P>0.05),其余均有统计学差异(P<0.05)(表2)。
表1 不同控制性卵巢刺激方案比较(±s)

表1 不同控制性卵巢刺激方案比较(±s)
注:与长方案组比较,*P<0.05
组 别 例数 年龄(岁)不育年限(年)BMI(kg/m2)AFC(个)FSH(U/L)LH(U/L)E2(pmol/L)长方案 30 29.87±4.13 4.02±3.30 21.91±3.25 16.77±5.94 6.44±1.46 2.82±1.57 129.00±59.09短方案 30 33.97±5.05* 4.60±3.53 22.21±2.66 10.73±5.01* 8.06±2.38*2.48±1.88 130.36±65.33
2.不同的卵巢反应组间各时间点的AMH 水平比较:根据卵巢反应性进行分组,基础日、Gn第5日及HCG 日AMH 水平在不同反应组间存在差异,低反应组<正常反应组<OHSS组,通过两两组间比较发现,其差异均有统计学意义(P<0.05)(表3)。
三、COH 过程中AMH 及常用指标预测卵巢低反应性及OHSS的预测价值
1.预测卵巢反应性:以获卵数≤5作为低反应性的判断标准,将常用预测指标(年龄、基础FSH、E2、AFC)和三个时间点的AMH 水平做ROC 曲线分析。具有预测价值的指标包括AFC以及基础日、Gn第5日及HCG 日的AMH 水平(P<0.05);其中基础日、Gn第5日及HCG 日的AMH 预测卵巢反应性的准确性最高,曲线下面积(AUC)-ROCAUC分别为0.923、0.932、0.934;紧随其后的为AFCROCAUC0.877;年龄、基础FSH、E2均未显示出预测价值(P>0.05)(表4、图1)。
2.预测OHSS:以是否发生OHSS作为判断标准,将常用预测指标(年龄、BMI、AFC)和三个时间点的AMH 水平做ROC 曲线分析。具有预测价值的指标包括AFC、基础日、Gn第5日及HCG 日的AMH 水平(P<0.05);年龄及BMI未显示出预测价值(P>0.05)(表5、图2)。
四、COH 过程中不同时间点的AMH 与获卵数、成熟卵数、受精卵数等相关性分析
不同时间点的AMH 水平均与获卵数、成熟卵数、受精卵数、卵裂数呈明显正相关(P<0.01);不同时期的AMH 水平均与优质胚胎数无统计学相关性(P>0.05)(表6)。
五、AMH 与妊娠结局的相关性
60例患者共有29例于取卵后14d查出HCG阳性,其中27例(45%)达到临床妊娠;其中短方案组的临床妊娠率为33.3%(10/30),长方案的临床妊娠率56.7%(17/30)。
根据是否达到临床妊娠将60例患者分为妊娠组和未妊娠组。年龄在两组中存在统计学差异(P<0.05);基础日、Gn第5日及HCG 日血清AMH水平在两组间均无统计学差异(P>0.05);基础FSH 水平及AFC在妊娠组与未妊娠组均无统计学差异(P>0.05)(表7)。
表2 不同的卵巢反应组间一般情况比较(±s)

表2 不同的卵巢反应组间一般情况比较(±s)
注:与正常反应组比较,*P<0.05;与低反应组比较,#P<0.05
组 别 病例数 年龄(岁)BMI(kg/m2)AFC(个)FSH(U/L)E2(pmol/L)低反应组 6 35.50±5.65 23.21±3.96 7.33±3.67*7.25±2.73 130.58±76.23正常反应组 49 31.41±4.70 21.94±2.93 13.55±5.07 7.41±2.06 130.98±63.49 OHSS组 5 32.60±6.66 21.90±1.94 23.40±8.41*# 5.65±1.64 115.79±19.71组 别 病例数 获卵数(个)成熟卵数(个)受精卵数(个)卵裂数(个)优质胚胎数(个)低反应组 6 4.17±1.17* 3.17±0.75* 2.67±0.82* 2.17±0.41* 0.67±0.52*正常反应组 49 11.06±3.43 9.12±3.58 8.49±3.82 8.43±3.87 2.33±1.43 OHSS组 5 20.80±4.66*# 19.4±4.34*# 16.20±8.07*# 15.20±6.76*# 3.20±2.17#
表3 不同卵巢反应组间AMH 水平比较(±s)

表3 不同卵巢反应组间AMH 水平比较(±s)
注:与正常反应组比较,*P<0.05;与低反应组比较,#P<0.05
组 别 病例数 基础AMH(ng/ml) Gn第5日AMH(ng/ml) HCG 日AMH (ng/ml)低反应组 6 0.76±0.77* 0.42±0.41* 0.15±0.13*正常反应组 49 3.45±2.51 2.69±1.93 1.29±1.09 OHSS组 5 8.30±4.29*# 6.83±2.56*# 2.64±1.20*#

表4 各预测指标对于预测卵巢反应性的敏感性比较

表5 各指标预测OHSS的敏感性比较
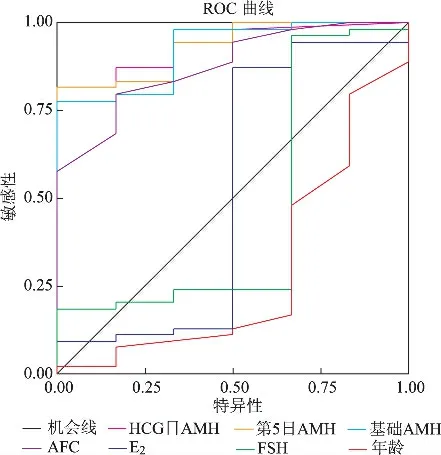
图1 各观测指标预测卵巢低反应性的ROC曲线

图2 各观测指标预测OHSS的ROC曲线
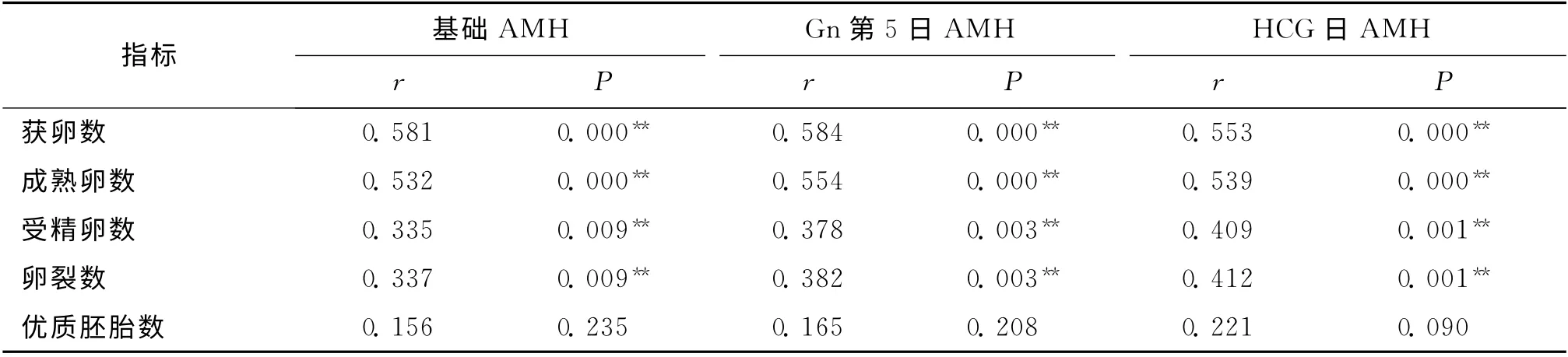
表6 AMH 与促排卵和受精结局相关分析
表7 妊娠组与未妊娠组各指标比较(±s)
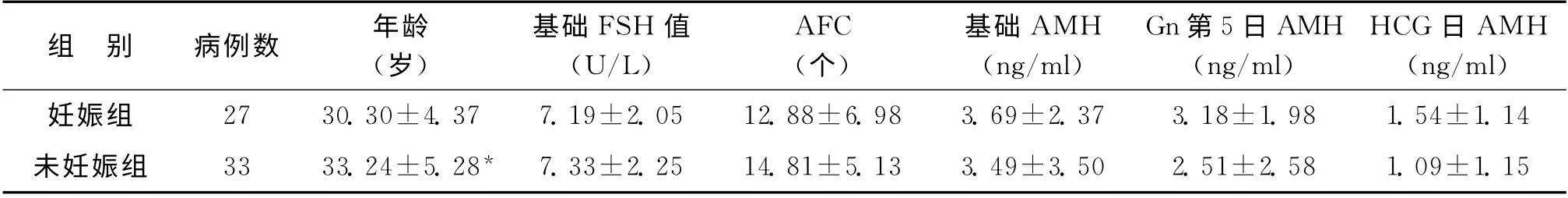
表7 妊娠组与未妊娠组各指标比较(±s)
注:与妊娠组比较,*P<0.05
组 别 病例数 年龄(岁)基础FSH 值(U/L)AFC(个)基础AMH(ng/ml)Gn第5日AMH(ng/ml)HCG 日AMH(ng/ml)7 3.18±1.98 1.54±1.14未妊娠组 33 33.24±5.28* 7.33±2.25 14.81±5.13 3.49±3.50 2.51±2.58 1.妊娠组 27 30.30±4.37 7.19±2.05 12.88±6.98 3.69±2.3 09±1.15
讨 论
一、AMH 与卵巢反应性及预测价值
在IVF 过程中,卵巢低反应的发生率约为10%[7]。我们的60例符合入组标准患者中,卵巢低反应性的发生率与目前的报道一致,为10%(6/60)。目前临床上常用的评价卵巢储备能力和在ART 中预测卵巢反应性的指标有年龄、基础血清FSH、基础LH、基础E2、AFC等。
随着年龄增长卵巢储备逐渐降低,但其下降速度有明显的个体差异。实际年龄并不等于卵巢生物年龄,女性年龄不能成为评价卵巢储备的绝对指标。在我们的研究中就有两名年龄分别为27及30岁的患者出现了低反应,可见,实际年龄并不一定能反应卵巢的真实年龄。该实验的统计表明,低反应组的平均年龄较正常反应组大4岁,所以,两组在年龄上是有差异的,即年龄越大,越容易出现低反应。但是统计结果并无显著性差异,可能是由于我们两组样本量相差太大所致。
AFC是指在卵泡早期阴道超声所观测到的2~10mm的卵泡数量。目前认为AFC能很好地预测卵巢的反应性,且其预测价值要高于基础FSH、E2等[8]。我们也发现,在低反应组的窦卵泡数明显低于正常反应组,差异有统计学意义。由于AFC的测定对检测医生的经验有一定要求,并且结果易受医生主观因素的影响,在一定程度上降低了其预测的灵敏度。
Dolleman等[3]认为AMH 可以直接反应卵巢年龄,从而预测更年期的发生。Eman等[4]分析了早卵泡期、取卵日及黄体中期的AMH 水平与卵巢的反应性,结果也提示这三个阶段的AMH 水平均可以反映卵巢的反应性,并且与获卵数显著相关。Tsepelidis等[9]对FSH<10 U/L 行IVF 的患者观察发现,在FSH 的水平尚未发生明显改变时,用AMH 评估IVF周期中卵巢低反应的灵敏度、特异度分别达80%、85%,说明在预测卵巢反应时,AMH 比FSH 更灵敏。Arce等[5]认为AMH 与获卵数明显相关,且比FSH、inhibin B及AFC的相关性更高,能更好地预测卵巢低反应性(获卵数≤3)及高反应性(获卵数≥15)。我们研究的结果显示:低反应组基础日、Gn第5日及HCG日的血清AMH 水平均明显低于正常反应组,而促性腺激素和雌激素均在正常水平。各时间点的AMH 与AFC、获卵数、成熟卵数、受精卵数、卵裂数呈显著相关性,进一步提示AMH 可以很好地预测卵巢的反应性。因此,AMH 可以很好地预测卵巢反应性,且不受时间限制。也有研究认为Gn第5 天的AMH 水平可以更好地预测卵巢的反应性[10]。而我们的结果提示HCG日的AMH 水平在预测卵巢低反应性方面较其他指标敏感性更高,但三个时期的AMH 水平在预测卵巢低反应性方面其预测价值并无统计学差异。所以,分析认为在预测卵巢低反应方面,AMH 比其他指标更敏感,但各时期预测价值相当。而AMH 与优质胚胎数之间并没有存在明显的相关性,分析原因可能是由于优质胚胎数的影响因素很多,如卵母细胞质量、精子质量等,而AMH 是由颗粒细胞所产生,所以不能够直接反映卵母细胞及胚胎的质量。
OHSS是IVF过程中最严重的并发症。易发生OHSS并发症的因素包括年龄<35岁、窦卵泡数多或PCOS患者、HCG 日E2水平过高等。有研究表明发生OHSS的患者与高水平的AMH 水平相关,重度OHSS患者基础AMH 血清水平是卵巢正常反应组妇女的6倍[11]。Lee等[12]对262个IVF周期观察发现,用基础AMH 水平来预测OHSS 的发生,其ROCAUC为0.902,Cut-off值取3.36ng/ml,其灵敏度、特异度分别可达90.5%、81.3%,比年龄和BMI更能预测OHSS的发生。我们观察了60例行IVF的患者,其中5例发生OHSS(8.3%),其周期各时间点的AMH 水平均明显高于正常反应组及低反应组,其中基础AMH 平均水平达到(8.30±4.29)ng/ml,是正常反应组的2~3倍,提示血清AMH 水平也可作为预测OHSS的指标。同时从表5中我们观察到HCG日的AMH 水平,较基础日的预测价值更高。由于我们观察到的阳性样本数仅5例,所得结果仅供参考,还需进一步扩大样本进行研究。
二、AMH 与IVF-ET 结局
目前认为在IVF周期中,年龄在预测妊娠结局方面具有明显优势。我们的资料显示,年龄在临床妊娠组与未妊娠组存在差异,且具有统计学意义。而目前关于血清AMH 水平是否与妊娠结局相关一直存在争议。Aboulghar等[13]研究表明正常水平AMH 组的妊娠率为42%,而低AMH 水平组的妊娠率仅为20%。Arce等[5]也认为血清AMH 与妊娠率正相关。也有文献报道AMH 并不能预测IVF的妊娠结局[1-2,14]。我们的资料表明:各时间点的AMH 水平,均与临床妊娠结局无关。分析原因可能是由于AMH 由颗粒细胞产生,所以不能够直接反映卵母细胞和胚胎的质量。另外,胚胎种植率及妊娠率除与卵巢储备功能有关外,还与胚胎质量、移植技术、子宫内膜容受性等其他很多因素有关。
Broer等[15]分 析 了 近10 年 来 的 文 献,认 为AMH 是目前预测卵巢储备功能最好的血清标记物。我们的研究提示了血清AMH 可作为评价卵巢反应性及卵巢储备功能的血清学标记物,而且对于OHSS的发生也有预测作用。同时通过对三个时间点的AMH 值进行比较发现,HCG 日AMH 水平的预测价值最高,故在控制性超排卵治疗过程中,可考虑通过检测AMH 值来调整治疗方案,若HCG 日的AMH 水平较高,可暂不进行移植,以避免OHSS的发生。但是目前关于AMH 是否能预测妊娠结局还需做进一步统计研究。如果希望得到更准确的预测卵巢反应性、卵巢过度刺激、卵巢老化的AMH 水平的临界值,还有待更深入的研究。
[1] Van Rooij IA,Broekmans FJ,te Velde ER,et al.Serum antimüllerian hormone levels:a novel measure of ovarian reserve[J].Hum Reprod,2002,17:3065-3071.
[2] Anckaert E,Smitz J,Schiettecatte J,et al.The value of anti-Mullerian hormone measurement in the long GnRH agonist protocol: association with ovarian response and gonadotrophin-dose adjustments[J].Hum Reprod,2012,27:1829-1839.
[3] Dolleman M,Faddy MJ,van Disseldor PJ,et al.The relationship between anti-Müllerian hormone in women receiving fertility assessments and age at menopause in subfertile women:evidence from large population studies[J].Clin Endocrinol Metab,2013,98:1946-1953.
[4] Eman AE,Dahlia OE,Azza ES,et al.Anti-Müllerian hormone:correlation of early follicular,ovulatory and midluteal levels with ovarian response and cycle outcome in intracytoplasmic sperm injection patients[J].Fertil Steril,2008,89:1670-1676.
[5] Arce JC,La Marca A,Mirner Klein B,et al.Antimüllerian hormone in gonadotropin releasing-hormone antagonist cycles:prediction of ovarian response and cumulative treatment outcome in good-prognosis patients[J].Fertil Steril,2013,99:1644-1653.
[6] Kansal Kalra S,Ratcliffe S,Gracia CR,et al.Randomized controlled pilot trial of luteal phase recombinant FSH stimulation in poor responders[J/OL].Reprod Biomed Online,2008,17:745-750.
[7] Luisi S,Florio P,Reis FM,et a1.Inhibins in famle and male reproductive physiology:role in gametogenesis,conception,implantation and early pregnancy[J].Hum Reprod,2005,11:123-135.
[8] Bancsi LF,Browkmans FJ,Eijkemans MJ,et al.Predictors of poor ovarian response in vitro fertilization:a prospective technology cycles[J].Fertil Steril,2000,74:518-524.
[9] Tsepelidis S,Devreker F,Demeestere I,et a1.Stable serum levels of anti-Müllerian hormone during the menstrual cycle:a prospective study in hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome[J].Clin Endocrinol Metab,2006,91:941-945.
[10] Peñarrubia J,Fábregues F,Manau D,et al.Basal and stimulation day 5 anti-Mullerian hormone serum concentrations as predictors of ovarian response and pregnancy in assisted reproductive technology cycles stimulated with gonadotropin-releasing hormone agonistgonadotropin treatment[J].Hum Reprod,2005,20:915-922.
[11] Gnoth C,Schuring AN,Friol K,et al.Relevance of anti-Müllerian hormone measurement in a routine IVF program[J].Hum Reprod,2008,23:1359-1365.
[12] Tsung-Hsien Lee,Chung-Hsien Liu,Chuin-Chia Huang,et al.Serum anti-müllerian hormone and estradiol levels as predictors of ovarian hyperstimulation syndrome in assisted reproduction technology cycles[J].Hum Reprod,2008,23:160-167.
[13] Aboulghar M,Saber W,Amin Y,et al.Impact of antimüllerian hormone assays on the outcomes of in vitro fertilization:aprospective controlled study[J].Fertil Steril,2014,101:134-137.
[14] Tokura Y,Yoshino O,Ogura-Nose S,et al.The significance of serum anti-Müllerian hormone(AMH)levels in patients over age 40in first IVF treatment[J].Assist Reprod Genet,2013,30:821-825.
[15] Broer SL,Broekmans FJ,Laven JS,et al.Anti-Müllerian hormone:ovarian reserve testing and its potential clinical implications[J].Hum Reprod Update,2014,20:688-701.

